オンコロジー入門(3)
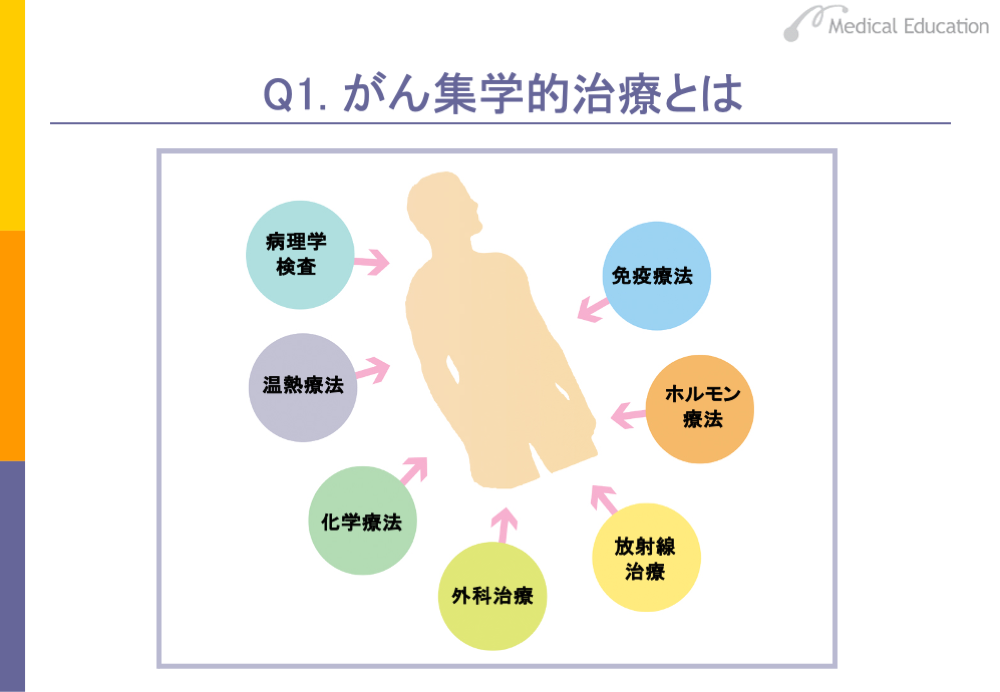
がんの治療法においては、①外科治療②化学療法③放射線治療―が3本柱になっています。30年ほど前までは、外科治療は外科系、化学療法は内科系、放射線治療は放射線科とそれぞれの領域の医師が個別に行い、各科が連携して治療を行うことはほとんどありませんでした。しかし、これではがんの治療成績があがらず、手術、放射線療法、化学療法などを組み合わせて治療を行う必要が出てきたことから、現在では、各科の医師が連携して1人の患者さんに治療を行い、成績をあげていくという考え方になっています。
最近ではまた、外科医が手術して切り離した組織をその場で病理の医師がみて、次にどこまで切除するかを決めるなど、多領域の医師が協力して治療を行っています。このように、広範な領域に渡る診療科や医師が複数かかわって、多手法的な治療を行うことを「集学的治療」といっています。昔といまのがん治療の大きな違いは、個別の科で行っていた治療を、各科が協力して集学的に治療を行うようになったことです。

がんの治療は、局所療法と全身療法の2つに大きく分けることができます。がんが局所に限局している固形がんの場合は局所療法が第一選択になり、全身に広がっている場合には全身療法が選択されます。
局所療法として、まずあげられるのは外科治療です。がんを切り取って、その周りのリンパ節を郭清することにより、がんを治します。早期がんの場合は、内視鏡切除術や鏡視下切除術が行われます。
放射線でがんを死滅させる放射線療法も、局所療法の1つです。放射線療法の最近の話題としては、陽子線治療があります。ただし、陽子線治療が実施できる施設は限られています。また、肝臓がんなどに対して行われている、がんに栄養を送っている血管に抗がん剤などを選択的に注入する動注療法も局所療法といえます。
温熱療法も局所療法に含まれますが、最近は下火になっています。がん細胞はおおよそ43℃以上に加熱すると死滅する率が高くなるため、がんの周りをお湯や電子レンジと同様な装置により局所的に温めて、がん細胞を死滅させる療法です。
なお、固形がんとは、胃がんや乳がんなど塊をなして存在するがんを指しています。固形がんでないものの代表が白血病です。
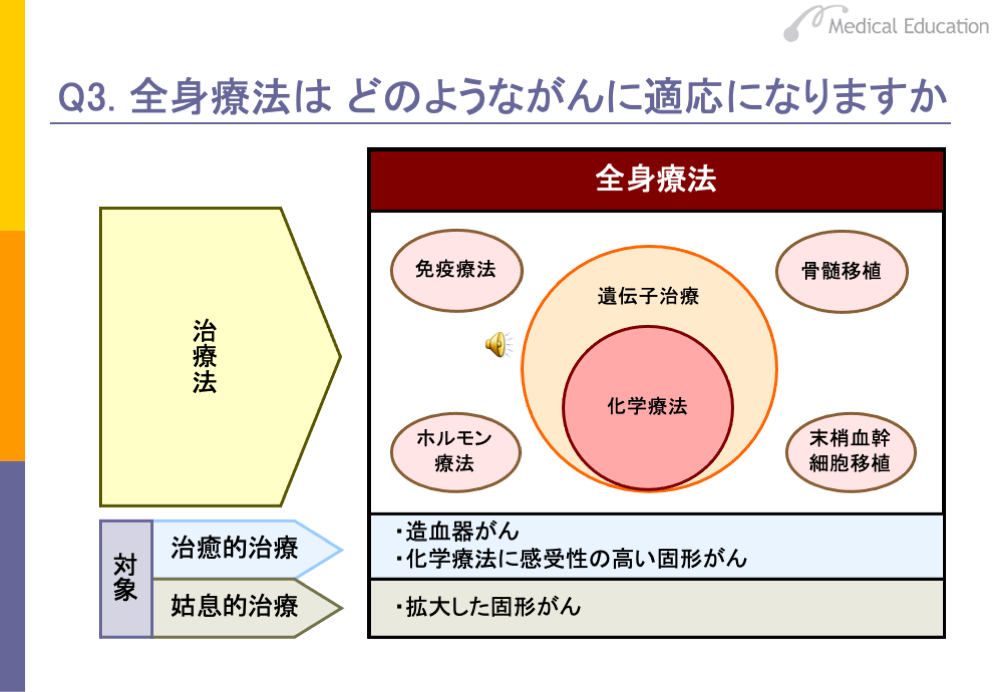
全身療法の適応となるのは、白血病や全身にがんの転移が及んでいるようなケースです。全身療法の中心となるのは化学療法です。
化学療法は、化学物質、すなわち抗がん剤を用いてがん細胞の分裂を抑え、がん細胞を破壊するものです。抗がん剤は投与後血液中に入り全身をめぐって体内のがん細胞を攻撃することから、がん細胞がどこにあっても効果が得られます。また、肺の小細胞がんなどの化学療法に感受性の高い固形がんも適応となります。化学療法で完全にがんを治すことができない場合でも、がんの大きさを小さくすることで、延命効果や痛みなどの症状を和らげることが期待できます。
化学療法の一環として、最近は遺伝子治療を加える試みが行われています。ただし、現在の遺伝子治療は、あくまでも化学療法の効き目をうまく引き出すために行われるのが主流です。
全身療法としては、他に免疫療法、ホルモン療法等があげられます。ホルモン療法は、乳がんや前立腺がん、子宮体がんなどのがんの発育にホルモンが必要ながんに限定して行われる療法です。
造血器のがんである白血病、悪性リンパ腫などには、化学療法のほかに骨髄移植や末梢血幹細胞移植などが行われます。

現在のところ、がんを完全に治せる治療法の主体は、外科治療です。したがって、外科治療は非常に重要な治療法であるといえます。外科治療が第一選択となるのは、固形がんのようにがんが局所に限局している場合です。血液のがんである白血病のように、がんが全身に広がっている場合は対象になりません。また、がんが進行して他の臓器に転移を起こしている場合も、転移先の臓器を切除する場合も例外的にありますが、一般的には対象になりません。
患者さんの状態が悪く、手術に耐え得るだけの体力がない場合も同様です。80歳以上の高齢者なども体力がないケースが多いので、外科治療の対象にならないといえます。ただし、最近では80歳以上でも体力がある高齢者も多く、このような場合には外科治療が行われています。
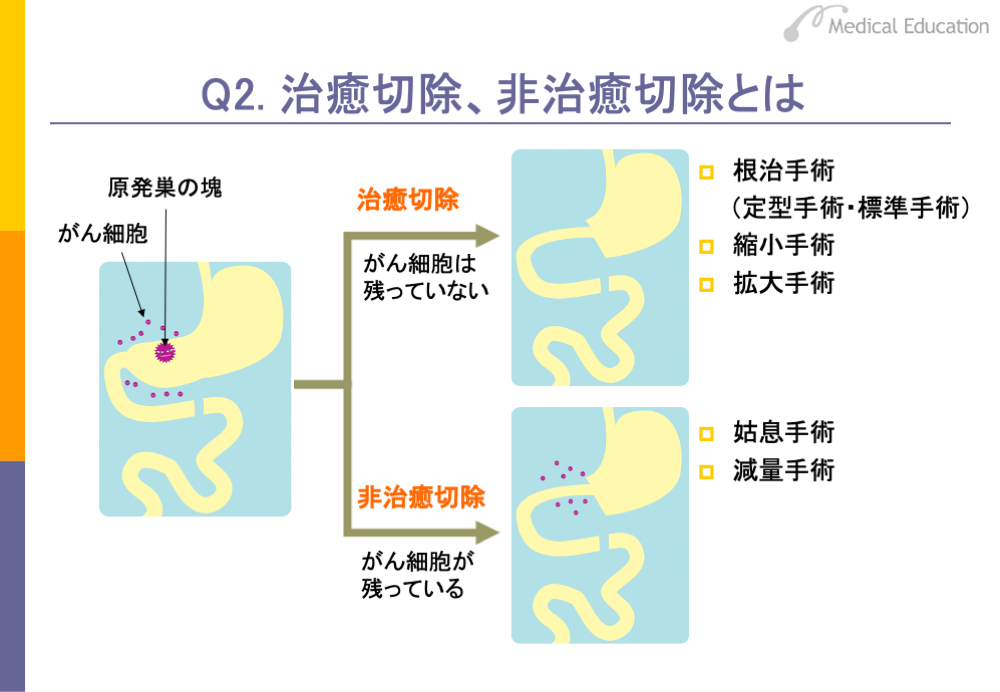
手術には「治癒切除」と「非治癒切除」という考え方があります。治癒切除とは、
がん細胞が残らないよう切除する根治手術で、治癒が期待できるものをいいます。
根治手術は、がんを含めてその周囲組織を切除し、合わせて領域リンパ節を郭清するものです。臓器ごとにがんの定型的な根治手術が確立されており、それは定型手術あるいは標準手術と呼ばれています。また、治癒切除には、拡大手術や縮小手術と呼ばれるものもあります。
一方、非治癒切除とは、がんが進行していて根治手術を望めない、切除してもその周りにがん細胞が残る、治癒しないものをいいます。姑息手術や減量手術と呼ばれるものがあります。
最近は治癒切除をR0切除と呼ぶことがあります。Rは、residual tumorの略で、R0はがんが残っていないことを示します。同様に、非治癒切除はR1切除とR2切除に分けられます。R1は肉眼的には完全に腫瘍を切除したものの、顕微鏡で見たらがんが残っているものを、R2は肉眼的にがんが残っているものを意味します。
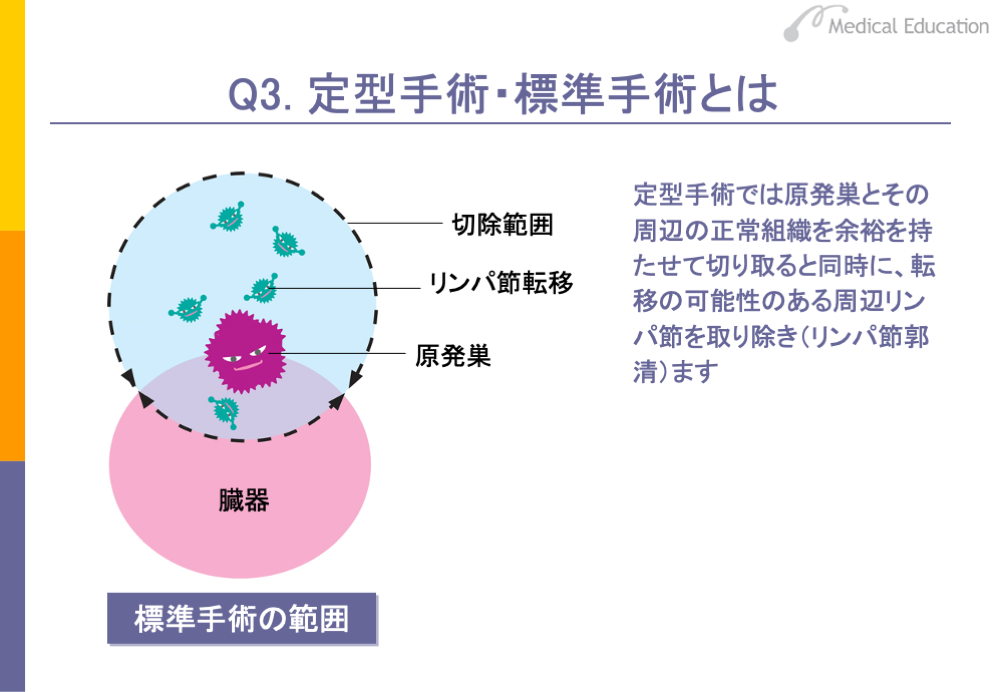
根治手術には、定型手術、または標準手術と呼ばれるものがあります。
定型手術・標準手術とは、がんの原発巣の周りを正常組織も含めて余裕を持って切除し、同時に転移の可能性のある周辺のリンパ節も郭清する手術をいいます。
多くのがんでは、定型手術、標準手術が決められています。たとえば胃がんでは、「胃癌治療ガイドライン」において、胃の3分の2以上の切除とD2リンパ節郭清が定型手術(標準手術)とされています。また、肺がんの場合は分葉以上の切除と肺内リンパ節、肺門リンパ節、縦隔リンパ節の郭清が定型手術となっています。
なお、リンパ節郭清とは、リンパ節を取り除くことをいいます。
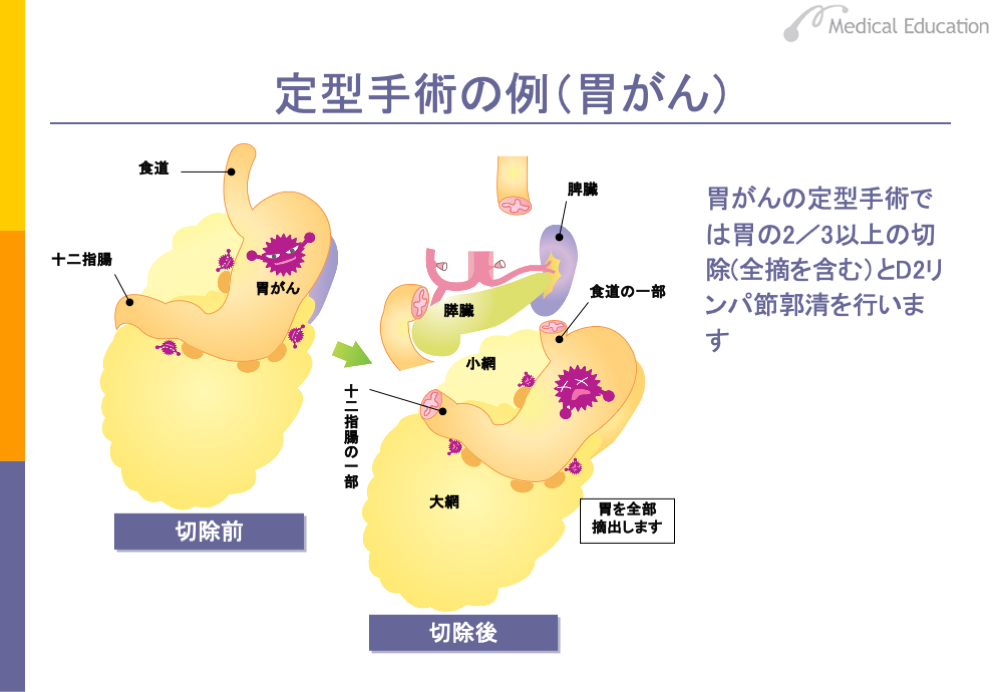
胃がんでは、「胃癌治療ガイドライン」において胃の3分の2以上の切除とD2リンパ節郭清が定型手術(標準手術)とされていますが、具体的には、胃の定型手術には2つの方法があります。
1つは、胃の3分の2以上とそれに付随する領域リンパ節を切除し、残りの胃と腸管をつなぐ方法です。もう1つは、胃を全部取り、胃についているリンパ節を郭清して食道と腸管をつなぐ方法です。前者を亜全摘術、後者を全摘術といいます。
胃がんでは切除する胃の範囲別に標準的に郭清すべきリンパ節が決められています。これらのリンパ節を郭清する手術をD2リンパ節郭清と呼んでいます。
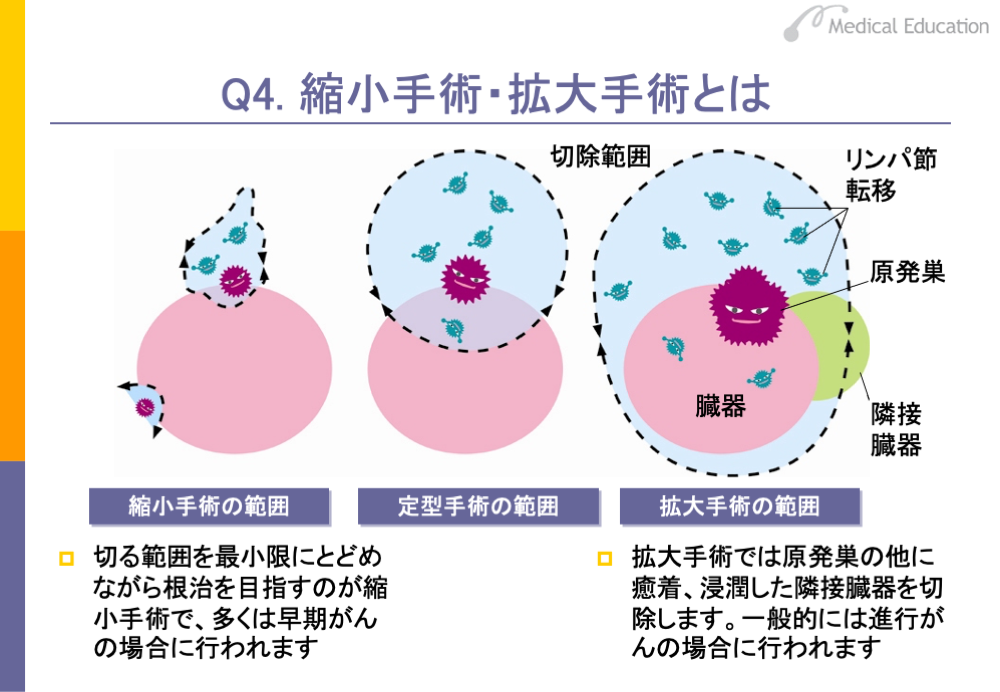
縮小手術と拡大手術という考え方があります。
縮小手術の場合はがんの原発巣とリンパ節の郭清を行いますが、このとき余裕を持たせずにぎりぎりのところで切る方法です。多くは早期がんで行われます。定型(標準)手術では少し余裕を持って切除しますので、そこが縮小手術とは違うところです。乳がんに対する乳房温存術、胃がんに対する幽門保存胃切除術や分節切除、直腸がんに対する肛門括約筋温存術や自律神経温存術などが、縮小手術に当たります。このような縮小手術は、手技的には腹腔鏡や胸腔鏡などを用い内視鏡外科手術として行われます。
一方、拡大手術は、がんが他の臓器まで浸潤、進行している場合に、原発巣の臓器だけではなく、転移が及んでいる可能性のある隣接臓器まで切除する方法です。たとえば胃がんで、D2リンパ節郭清をした場合は標準手術ですが、それ以上のリンパ節まで郭清した場合は拡大手術ということになります。
近年、臨床研究により、拡大手術が必ずしも治療成績の向上に寄与しないことが明らかになったことから、「胃癌治療ガイドライン」では、拡大手術が有用とされるには、安全であること、標準手術より成績が良好なことが確認されることが必要であるとしています。

縮小手術の代表的なものに、乳房温存術があります。乳房温存術とは、乳房を残し、がんとその周りの組織を切除すると同時に、予防的に腋窩リンパ節を郭清する手術です。30年ほど前までは、定型的乳房切除術(Halsted手術)という、乳房および大胸筋、小胸筋といった胸の筋肉すべてを切除する手術が行われていました。しかし、この手術では術後、あばら骨がみえてしまったり、腕が腫れあがったり、痛みやしびれなどを伴うなど、患者のQOL(Quality of life )が非常に悪いものでした。
その後、いまから20年ほど前に欧米で、乳房を残しても、術後に放射線を当てることで定型的乳房切除術と変わらない生存率が得られるという研究成果が公表され、それ以降は乳房温存術が行われるようになりました。現在では乳房温存術が乳がんの主な治療法になっています。
また、リンパ節郭清については、センチネルリンパ節生検が行われようになっています。

がんの進展状況や患者の状態が不良で、根治手術ができない場合は、がんによるさまざまな症状が出てきます。がんそのものを切除して治すことはできなくても、その症状を少しでも軽くするための手術を行うことがあります。これを姑息手術あるいは姑息的切除といいます。
たとえば膵臓がんでは、十二指腸にがんが浸潤すると腸管が狭くなり食べ物が通過しにくくなります。この場合、膵臓のがんそのものを切除するのは難しいため切除せず、食べ物の通りをよくするために胃と十二指腸をつなぐ手術を行います。さらに、胆汁の流れも悪くなるため、胆のうと空腸をつなぐ手術も行います。このような手術が姑息手術といわれるものです。ただし、姑息手術は、がんが非常に大きくなっている状態で症状をとるだけの手術であるため、患者さんの生存期間はあまり長くないのが現状です。
また、化学療法や放射線療法の治療効果増強を目的に、がんの病巣を小さくする減量手術は、姑息手術に含まれます。
通常、がんの手術における外科的切除では、がんそのものだけでなく、周りの正常組織も一緒に取り除き、同時に転移の可能性のあるリンパ節を郭清します。
なぜ、リンパ節郭清を行うかというと、転移のあるリンパ節を郭清することで、治癒が得られ、予後を改善すると一般的に考えられているからです。また、リンパ節郭清は、リンパ節転移が血行性転移、播種よりも早く出現する胃がん、乳がん、大腸がんなどでその効果は大きいと考えられています。
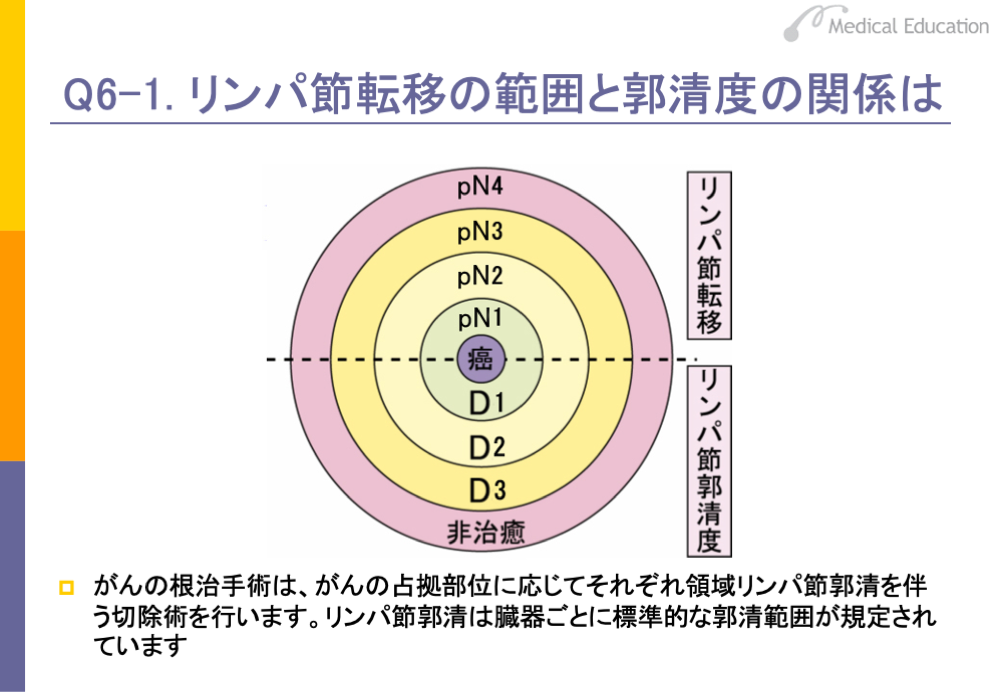
リンパ節をどこまで郭清するかは、リンパ節転移の程度により決まります。原則として病理所見でリンパ節転移がどの程度進んでいるかを、 pN1~ pN4で表します。癌取扱い規約により各臓器ごとに規定されています。たとえば、大腸がんでは、 pN1~pN3の3段階に分類し、 腸管傍リンパ節と中間リンパ節を合わせて転移個数3個以下をpN1、4個以上をpN2、主リンパ節または側方リンパ節に転移があった場合をpN3としています。肝がんは転移なし(pN0)、転移あり(pN1)の2段階で表します。
一方、D1~D3は、リンパ節をどの程度まで郭清したかというリンパ節郭清度を表します。リンパ節郭清は臓器ごとに標準的な郭清範囲が規定されています。標準的に郭清されるリンパ節の領域まで郭清した場合はD2、それ以下の場合はD1、標準以上に郭清した場合はD3となります。
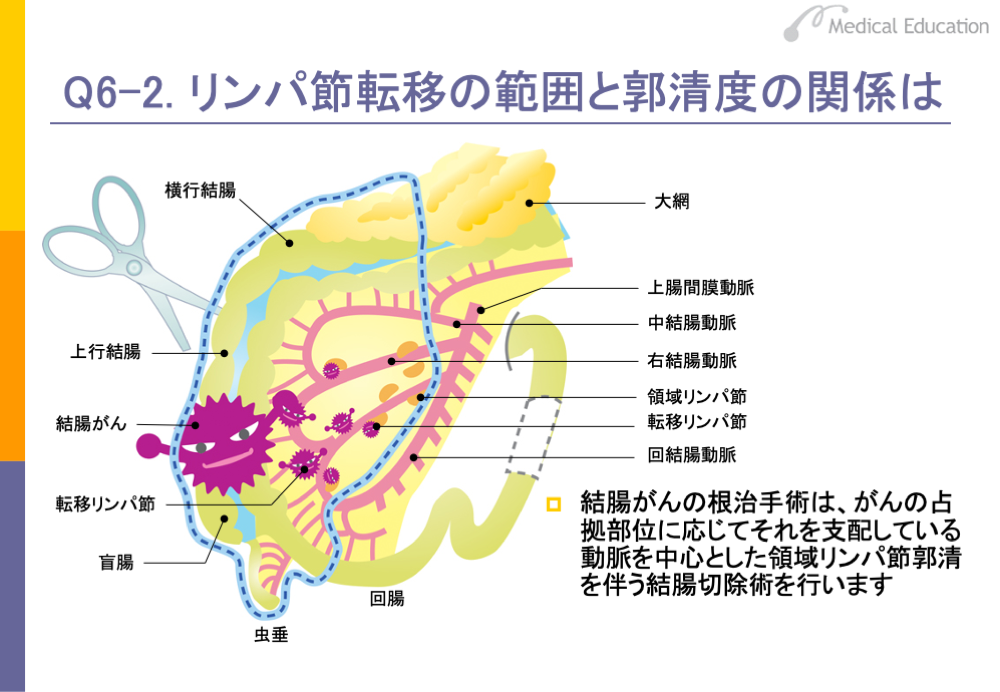
スライドは大腸がん(結腸がん)の例です。
「大腸癌取扱い規約第8版」以降、腸管傍リンパ節・中間リンパ節・主リンパ節を合わせて領域リンパ節と定義し、腫瘍を支配している支配動脈を中心として領域リンパ節を郭清することを原則としています。
また、「胃癌治療ガイドライン第3版」では、内視鏡治療の対象とならないT1N0のがんではD1郭清を行い、リンパ節転移があったりT2以上に進行している場合はD2郭清を行うとしています。
リンパ節は、脂肪組織、動脈に沿ってリンパ管が走っているところに存在します。そのため、通常は支配動脈とリンパ節を一緒にとりますが、これらの周りには脂肪組織があり、実際に手術をするときには、血管、リンパ節、リンパ管、脂肪組織を一塊にして切除します。

治癒切除とは、前にも述べたとおり、がんのある範囲をすべて取り除き、がん細胞が残らないよう切除することです。そのため、がんの外科手術で治癒切除を行った場合は、理屈の上は、継続的な治療を行う必要はないということになります。しかし、現状では、治癒切除後も継続的に化学療法等の治療が行われています。
なぜならば、治癒切除により目にみえるがんは取り除いても、目にみえない転移巣や、微小ながんが切り取った周りに残っている(がんの遺残)可能性があるからです。このような場合は、外科的にがんを完全に取り除いたとはいえず、そのまま放っておくと、目にみえないがんが増殖して再発する可能性があります。そのため、現在では、治癒切除を行ったあとも継続的に治療を行うことが一般的になっています。通常は、外来通院で一定期間、経口または静注での抗がん剤投与が行われます。
ただし、治癒切除後の継続的な治療は、あくまでも浸潤がんの場合に限られます。がんが上皮にとどまっているような非常に早期のがんの場合は、治癒切除を行ったあとの継続的な治療は必要ないというコンセンサスが得られています。
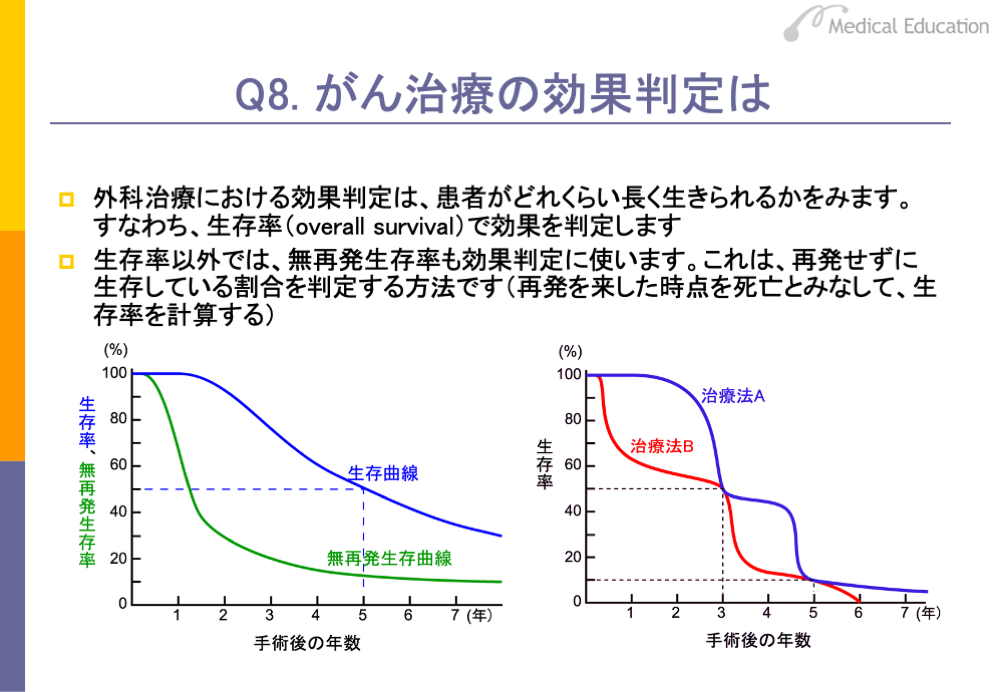
外科治療における治療効果の判定は、生存率で行います。生存率とは外科治療を行ったことにより、患者さんがどれくらい生きているかという割合のことです。手術後の、あるいは治療開始後の生存率を時間に対してプロットしたものを全生存率(overall survival,オーバーオールサバイバル)といい、この曲線を生存曲線と呼びます。生存曲線は、また、患者さんがどれくらい生きられるかを示しているので、overall survivalは生存期間ともいえます。たとえばスライドの左の図の青い色の生存曲線では生存率50%のところに位置する患者さんは5年間生きられるということがわかります。この全体の50%に相当する患者さんの生存期間を生存期間中央値(median survival,メディアンサバイバル)といいます。
ところが乳がんのように手術後に再発しても、長期生存が可能ながんもあります。このようながんの場合、再発した場合と再発しなかった場合の生存率や生存期間を同等に扱うと、正確な治療効果の判定が行えません。そのため生存率以外に無再発生存率も効果判定に用います。無再発生存率(relapse-free survival,リラプスフリーサバイバル)は再発を来さずに生存している人の割合です。再発した時点で患者さんを死亡したとみなして生存率の計算を行います。
治療効果の比較には5年生存率や生存期間中央値といった簡単に算出できる方法で行えばよく、わざわざ生存曲線を求める必要はないように一見思われます。スライド右側の図は2つの治療法の生存率を比較した模式図です。この二つの治療法は5年生存率や生存期間中央値は全く一緒ですが、明らかにAのほうが長生きしている患者さんが多いことがわかります。このように、治療法の比較にあたっては、生存曲線や無再発生存曲線を求めることが重要になります。
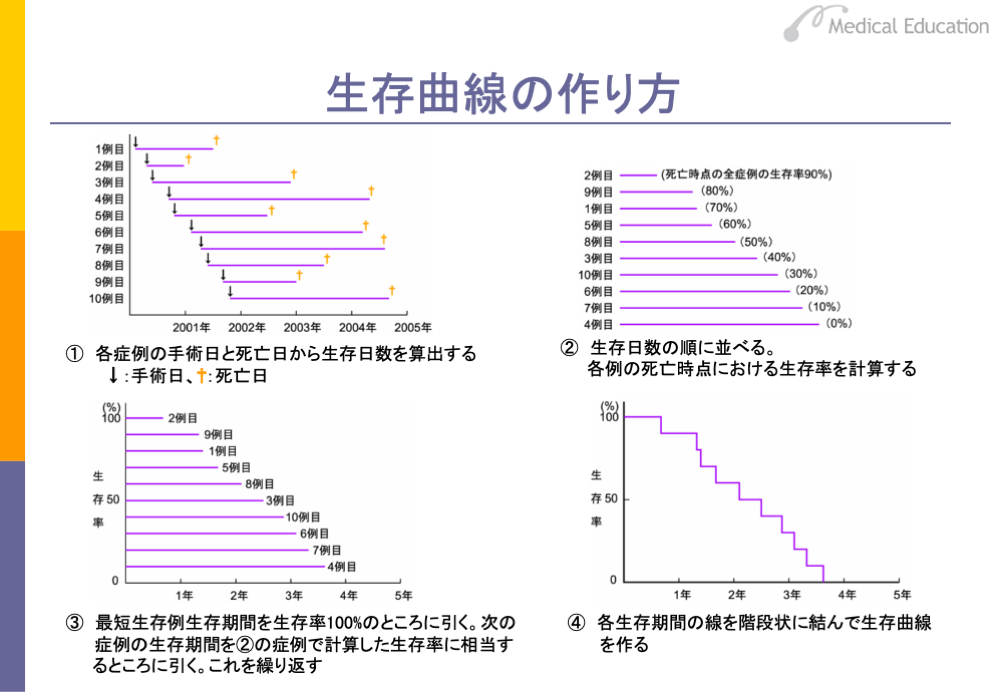
生存曲線の作り方は、スライドでみるように、まず各症例の手術日から死亡した日までの生存日数を計算します。次にこの生存日数の順に、各症例を並べ各症例の死亡時点における生きている人の割合(生存率)を計算します。続いて生存期間の最も短い症例の生存期間を生存率100%のところに横棒として引きます。さらに次に生存期間の短い症例を最初の症例で計算された生存率に相当するところに横棒として引きます。このようなことを全症例について行います。最後に生存期間の間を線で結ぶと生存曲線ができあがります。このような生存曲線の作り方をKaplan-Meyer(カプランマイヤー)法といいます。
2つの生存曲線の間に統計的に差があるかどうかについては、Wilcoxon(ウィルコクソン) testやLog-rank(ログランク)testと呼ばれる方法を用いて解析が行われます。

治癒切除後フォローアップとして、どのような検査をどのくらいの間隔で行うかが問題になってきます。まず、術後フォローアップの間隔は、早期がんと進行がんでは異なります。早期がんの場合は、転移・再発のリスクが非常に少ないため、1年ごとに内視鏡検査、あるいは画像検査を行うだけで十分です。
進行がんの場合は再発リスクが高く、最初の2年間は3ヵ月または6ヵ月ごとに検査を行います。2年間というのは、多くの進行がんは2年以内に再発することが多く、再発リスクが高い最初の2年間はこまめにチェックする必要があるためです。2年以降は再発リスクが減るため、1年ごとにチェックを行います。

放射線治療は局所療法であるため、基本的な部分は外科治療と似ていますが、がんの種類や大きさによって効果が異なります。
放射線治療と外科治療の違いの1つは、外科治療では正常組織も一緒に切り取るため、臓器の機能を損う場合がありますが、放射線治療では正常な部位を傷つけることが少なく、治療部位の変形を来すこともほとんどない点です。
もう1つの大きな違いは、重要な臓器が密接しているような部位にあるがんでは、手術では重要な臓器を傷つけるリスクが大きく、放射線治療ではリスクが少ないといった点です。そのため、重要な臓器が密接しているような部位にあるがんでは、放射線治療が第一選択となります。

放射線治療は、治癒を目的としたものから症状を和らげるためのものまで、幅広く行われています。
根治的照射は、手術と同様に遠隔転移のないがんが対象になります。なかでも放射線に感受性が高いがんや小さながん、切除困難な部位のがんなどが適応となります。また、進行がんには、抗がん剤による化学療法との併用が一般的になってきています。
放射線治療と手術との併用は、がん治療ではしばしば行われています。術前照射は、事前にがんにダメージを与えることや小さくしておくことで、患者さんの身体的負担や後遺症のリスクを軽減できます。術後照射の代表的な例としては、乳がんに対する乳房温存術後の術後照射があげられます。再発の可能性を低くできるので、切除範囲を最小限に抑えることができます。
緩和的照射は、がんが大きくなって周囲の組織を圧迫したり、骨に転移したときの痛みや神経症状などを軽減し、患者さんのQOLを改善できることから、緩和ケアの面から重要な役割を果たしています。
予防的照射とは、他の治療法でがんを治療した後に、将来的に転移しやすい部位に予防的に照射を行うことをいいます。肺がん患者への全脳照射が知られています。

がん治療に用いられる放射線は、電磁波と粒子線の2種類に分けられます。現在最も多く使われているのは、電磁波を使う治療です。一般的には、γ線あるいはX線が主体になっています。
粒子線は原子を構成する粒子(電子、陽子、中性子など)がいろいろな速度で飛んでくるものです。電磁波に比べてがん病巣にその効果を集中させることが容易ですが、電子線以外の粒子線は、設備に多額の費用や場所を必要とすることから、ごく限られた施設でしか使用されていません。
陽子線を用いた治療を行っているのは、国立がん研究センター東病院、県立静岡がんセンターなど9施設あります。また、重粒子線を用いた治療を行っているのは、千葉市にある放射線医学総合研究所(放医研)と兵庫県立粒子線医療センターなど5施設あります(2013年9月現在)。
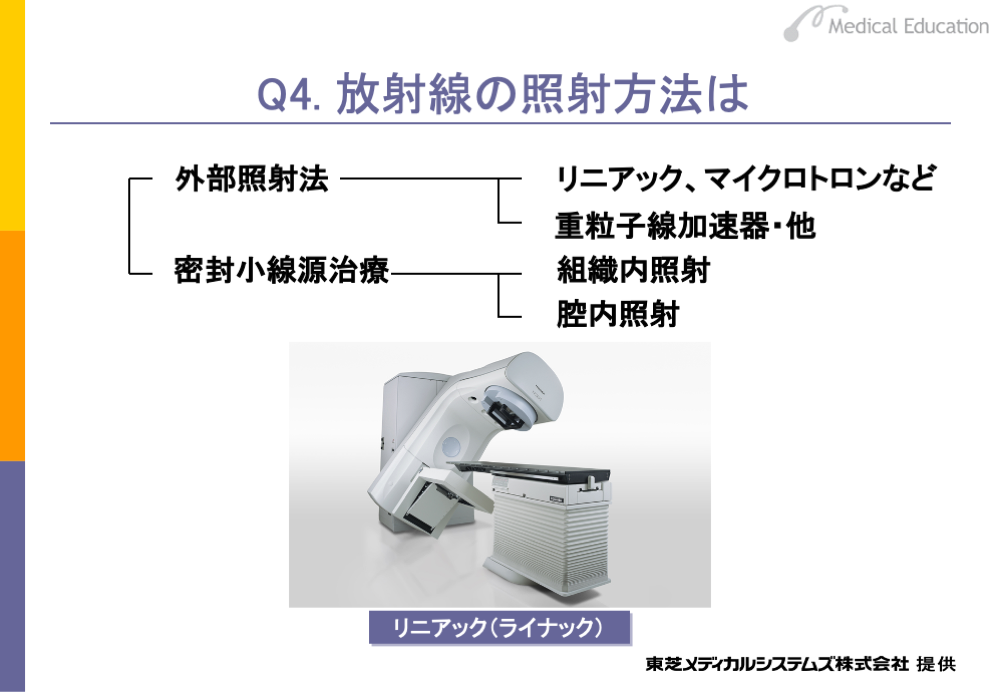
放射線の照射方法には、身体の外から放射線を照射する外部照射法と、放射線源を身体の組織や前立腺、子宮などに挿入する密封小線源治療があります。
このうち、放射線治療の中心をなすのは外部照射法です。外部照射法に使われる機器(装置)には、電子を加速してX線や電子線をとり出すリニアックや、粒子線をとり出す重粒子線加速器などがあります。臨床の現場では、リニアックなどから発生させた高エネルギーのX線や電子線を用いて照射が行われています。
外部照射では、事前に放射線をどの部位に、どの方向からどのくらいの量を何回に分けて治療するかという治療計画を立てます。CT撮影やX線シミュレータと呼ばれる透視装置を使って、どのくらいの範囲でどの方向から照射するかを決め、がんの周囲の正常組織にあまり当たらないように放射線を照射するための方向を検討します。一方向あるいは、多方向(2~4)から照射するケースが大部分です。毎回同じ部位に照射するために固定具を使用することもあります。
一方、密封小線源治療は、放射線を出す物質を針状等に加工し、これを組織に刺すなどして治療を行います。

密封小線源治療は、管、針、ワイヤー、粒状などの形状となった容器に密封されたラジウム、セシウム、イリジウムなどの放射性物質を放射線源として使います。口腔、舌、乳房、前立線などのがんでは、放射腺源を針状の容器に密封し、がん病巣や周囲組織に刺し、針から放射線を照射するという組織内照射が行われます。一方、食道がん、子宮頸がん、肺がんでは、食道、子宮腔、気管などの腔内にあらかじめチューブを適当な位置に装着し、その後放射線源を挿入する腔内照射が行われます。
密封小線源治療は、がん組織やその周辺のわずかな正常組織に放射線が照射されるため、がんを治す確率が高く、しかも副作用が少ない治療法といえます。一般的に小さながんに効果が高いとされています。外部照射と組み合わせて行う場合もあります。放射線源の強さにより、24時間から7~8日に渡って治療する場合と、数分の治療を繰り返す場合があります。
なお、体内照射として、甲状線がんなどに対し、非密封の放射性物質(ヨード131)を用いる場合があります。
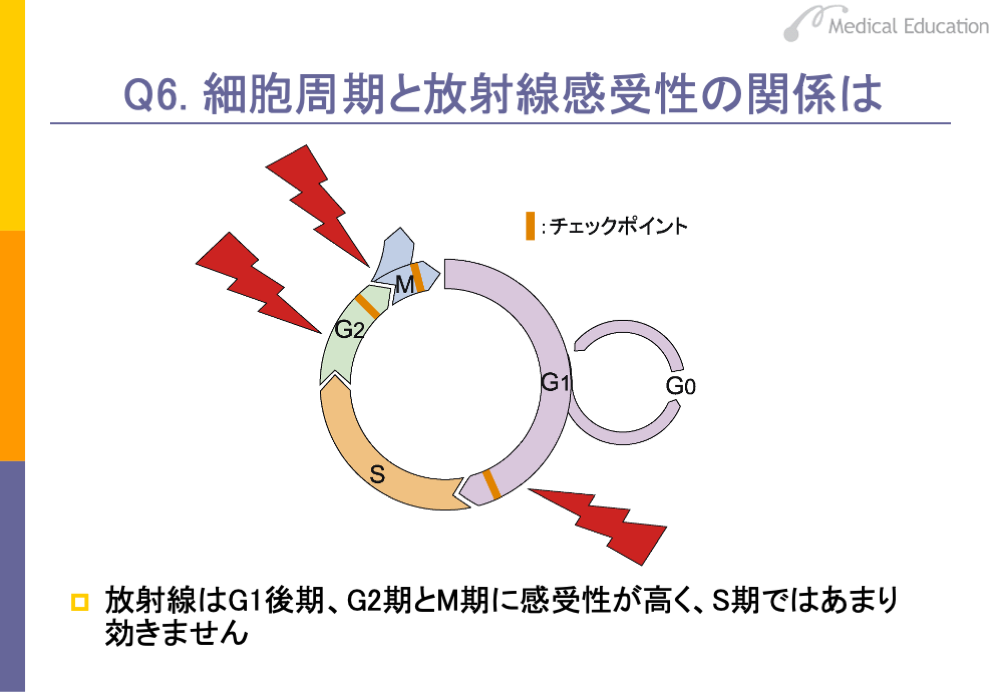
細胞周期と放射線の感受性をみた場合、G1後期とG2期、M期に感受性が高くなっています。逆にS期は感受性が低く、G0期にはほとんど効かないことが知られています。G1期、G2期、M期が放射線の感受性が高いのは、これらにはチェックポイントがあり、DNAが放射線で傷つくと、このチェックポイントでチェックされ、がん細胞がアポトーシスを起こして死んでいくためです。

がんには、放射線療法がよく効くがん、つまり放射線に感受性の高いがんと、あまり効かない抵抗性のがんがあります。一般的に放射線がよく効くのは、扁平上皮がんです。ただし、扁平上皮がんの中でも分化度が高いものにはあまり効きません。低分化の扁平上皮がんが、放射線に高感受性の組織型になります。高感受性のがんとしては、スライドの表のように卵巣がん、精上皮腫などがあります。
また、乳がんや膀胱がんなどは、中等度の感受性を持っています。浸潤性の膀胱がんでは、通常、経尿道的切除術でがんをできる限り切除した後に外部照射を行います。また、乳がんでも乳房温存術の後に放射線を照射することにより、定型的な乳房切除術と同等の成績が得られるといわれています。

日本では放射線で治るがんに対しては、放射線の単独治療が行われています。放射線で治せる治療を根治的照射、がんが縮んである程度症状がとれる場合は緩和的照射と呼んでいます。根治的照射が行われるものには、上顎洞がん、口腔がん、上・中・下咽頭がん、喉頭がん等の頭頸部がん、食道がん、肺がん、子宮頸がん、悪性リンパ腫などの血液のがんなどがあります。このうち食道がん、肺がんでは、同時に緩和的照射も行われます。食道がん、肺がんで根治的照射ができる症例は限られており、大半は緩和的照射で終わるのが現状です。根治は可能ですが、あまり治癒率が高くないため、ほとんどが緩和的照射になってしまいます。

放射線の副作用は、急性反応と晩期反応に分けられます。放射線照射は1回ではなく、たいてい1ヵ月単位で行います。その放射線照射を行っている期間中に出てくる副作用が急性反応です。放射線照射が終わって数ヵ月あるいは数年が経ってから出てくる副作用は晩期反応と呼んでいます。
急性反応で最も多いのは、皮膚の障害です。皮膚障害はほとんどの場合に出るといってよいでしょう。皮膚が赤くなったり、ひどい場合は潰瘍の形成まで至ります。また、放射線宿酔というものがあります。二日酔いと同じように気持ちが悪くなり、食欲不振も起こります。
晩期反応で怖い副作用は白血病です。放射線が骨髄に当たり、骨髄細胞ががん化した結果、白血病になってしまうというものです。もう1つ怖い副作用としては、肺がんへの照射で起こる肺線維症があります。肺線維症になると呼吸困難を起こし、死に至ることがあります。そのほか気をつけなければならない晩期反応に消化管の潰瘍があります。子宮頸がんなどで放射線照射を行った場合、1~2年後に直腸に潰瘍ができることがあります。これは遅く出てくる副作用だけに注意が必要です。ただ最近は、放射線装置が改善され、目的とするがん病変に集中的に放射線が当てられるようになってきたため、これまで述べたような副作用は実際には少なくなっています。




