オンコロジー入門(4)

化学療法は放射線療法や外科療法とは異なり、全身の治療に用いられる治療法です。したがって、化学療法が最も用いられるのは全身的ながんの治療です。ただし、全身的ながんといっても、白血病などのほか、進行がんや再発がんなどで手術や放射線治療ができない場合に用いられます。特に進行がんで、転移がいろいろな臓器に起こっているようなケースでは、化学療法が第一選択となります。
化学療法は、単独ではなく、手術や放射線治療と組み合わせて行う集学的治療に組み入れられることもあります。よく知られているのは、術前や術後の補助化学療法です。補助化学療法にはいくつかの意味がありますが、一般的には術前の場合はdown stagingへの期待、術後の場合は転移再発の予防といった観点から行われます。down stagingとは、補助化学療法によって腫瘍を小さくすることです。腫瘍を小さくしてstageを下げ、手術が可能になることを期待するわけです。たとえば、stageⅢでがんが大きくて手術ができない症例に対して化学療法を行い、がんを小さくしてstageⅡまで下げ、手術ができるようにします。術後の補助化学療法は、手術のあとに目にみえないがん細胞が残っていたり、目にみえない転移が起こっている可能性があるため、再発予防を目的に化学療法でがんをたたく意味で行われています。
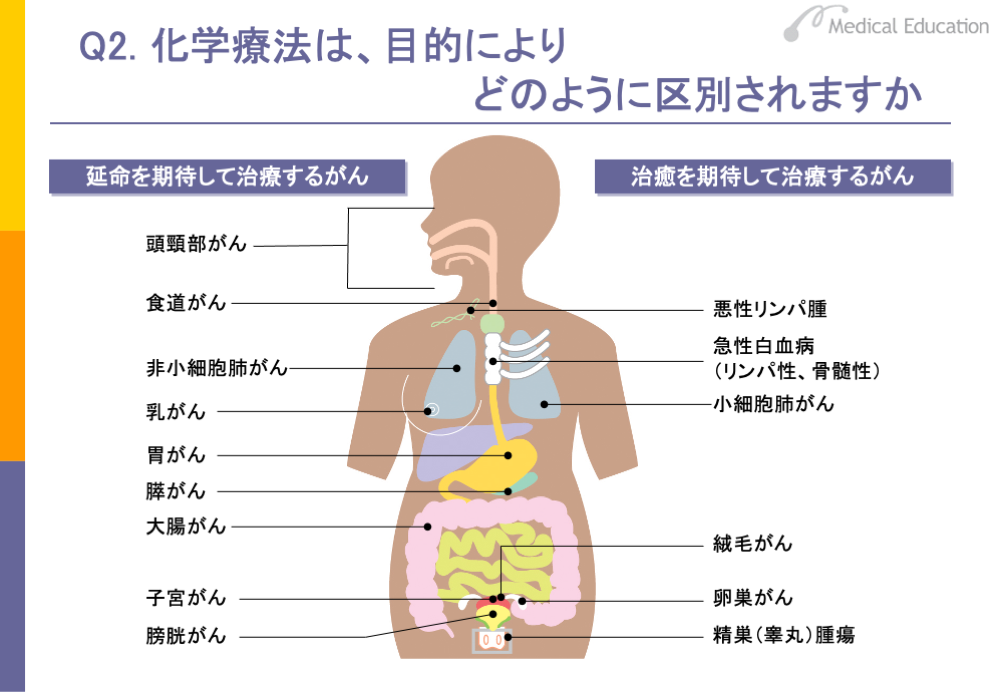
がんの化学療法は、治癒を期待して行うものと、延命を期待して行うものに分けられます。治癒を期待して行うものには、悪性リンパ腫や白血病、肺の小細胞がんなどに対する化学療法があります。また、絨毛がん、卵巣がん、睾丸腫瘍なども化学療法で治癒が期待できるがんです。たとえば、急性白血病では骨髄性でもリンパ性でも完全寛解率は70%以上です。骨髄性の場合は、完全寛解した30%前後の人は、5年以上再発せず治癒していると考えられています。ただし、これらのがんは日本人にはあまり多くありません。
延命を期待して行う化学療法とは、化学療法でがんをコントロールしつつ、できる限りQOLの高い日常生活を送りながら、しかも長期に生存することを目標とするものです。日本人に多い乳がん、胃がん、大腸がん、非小細胞肺がんに対する化学療法が該当します。
たとえば、乳がんでは、手術後にホルモン療法や抗がん剤を用いたときの再発予防効果、再発・転移したがんでの延命効果が証明されています。また、胃がんにおいては、手術が不可能な場合や手術の補助手段、手術後の再発防止など、補助的な治療法として化学療法が用いられています。

抗がん剤の投与方法としては、一般的に静脈内に投与する方法が行われています(静注)。静脈内への投与方法は、通常の注射と同じで、注射器(シリンジ)で末梢静脈に投与するワンショット(one shot )静注か、点滴による点滴静注が一般的です。その他、特殊な方法に、ポンプを用いて持続的に体内に点滴を行う持続点滴静注という方法があります。また、静脈だけではなく、動脈内に投与する方法もあります(動注)。これは、肝臓がん、頭頸部がん、脳腫瘍などで用いられます。その際、体内にリザーバーという薬剤をためておくものを留置して、そこから動脈内に薬剤を流し込む方法が用いられることもあります。
胸腔内投与、腹腔内投与は、胸腔または腹腔に薬剤を投与する方法です。胸水や腹水がたまっていたり、腹膜炎が起こっているような場合は、このような特殊な投与方法を用います。その他、日本でよく行われている方法に経口投与がありますが、これは入院の必要がなく外来で治療が行えるためです。海外では経口投与はあまり行われていませんでしたが、最近では積極的に行われています。

抗がん剤の分類方法にはさまざまなものがありますが、最近の分け方の1つに、抗がん剤を大きくスライドのように9つに分類する方法があります。ここでは、この分類方法に従って、個々の薬剤について説明していきます。
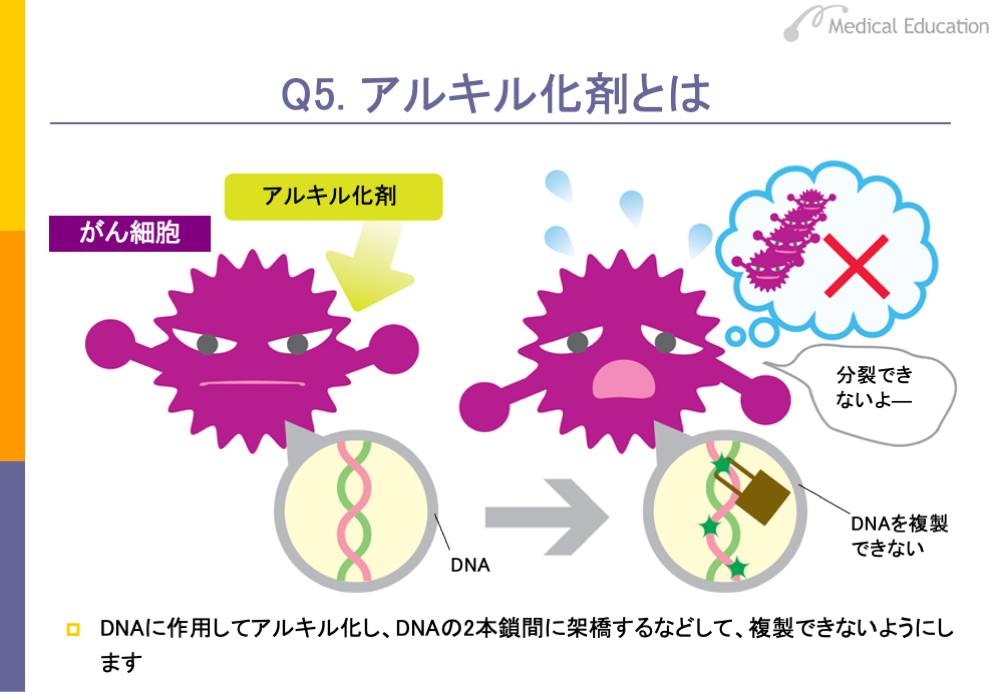
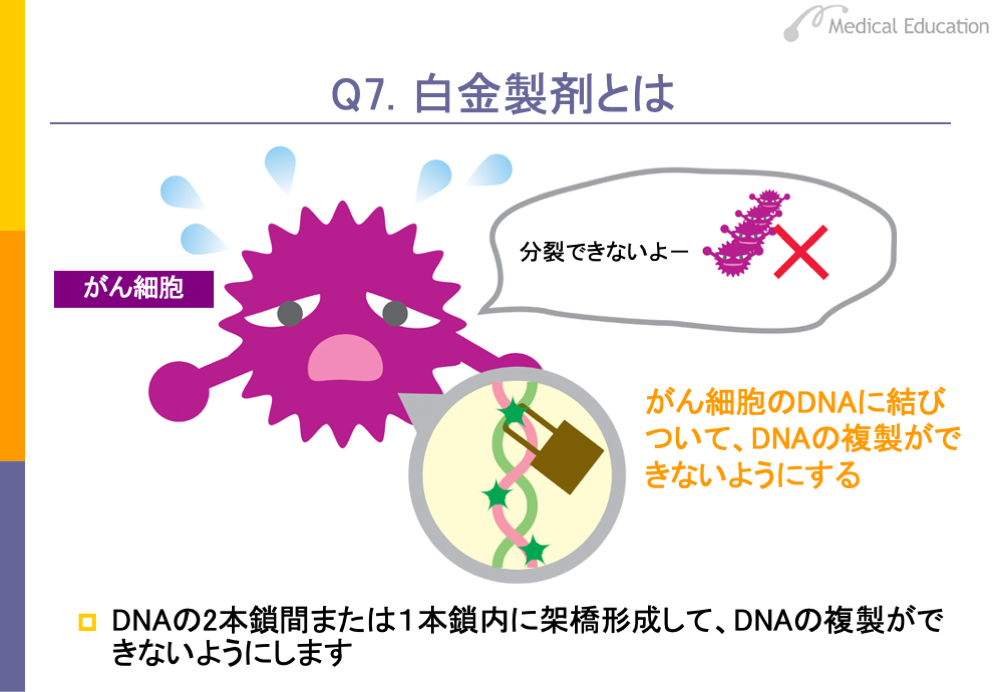
アルキル化剤はDNAに作用し、アルキル化(炭化水素の鎖の付加)という反応を起こしてDNAの2本鎖の間に橋をかけるように化学結合(架橋)するなど、DNAの複製を阻害します。このようにアルキル化により架橋などを形成して、DNAの複製ができないようにする作用を持つ薬剤を、アルキル化剤と呼んでいます。

アルキル化剤は、もともと毒ガスの研究から開発されたものです。アルキル化剤に分類される薬剤には、スライドのようなものがあります。このうち、マスタード薬のシクロホスファミドは、乳がん、卵巣がん、悪性リンパ腫などに対して、他の抗がん剤と併用して使われています。シクロホスファミドは注射剤だけでなく、経口剤も用いられています。
副作用としては、骨髄抑制、悪心・嘔吐のほか、出血性膀胱炎が知られています。出血性膀胱炎の予防のため、輸液などにより尿量の確保が行われます。また、骨髄抑制は、具体的には白血球減少、血小板減少、赤血球減少(貧血)を指しています。
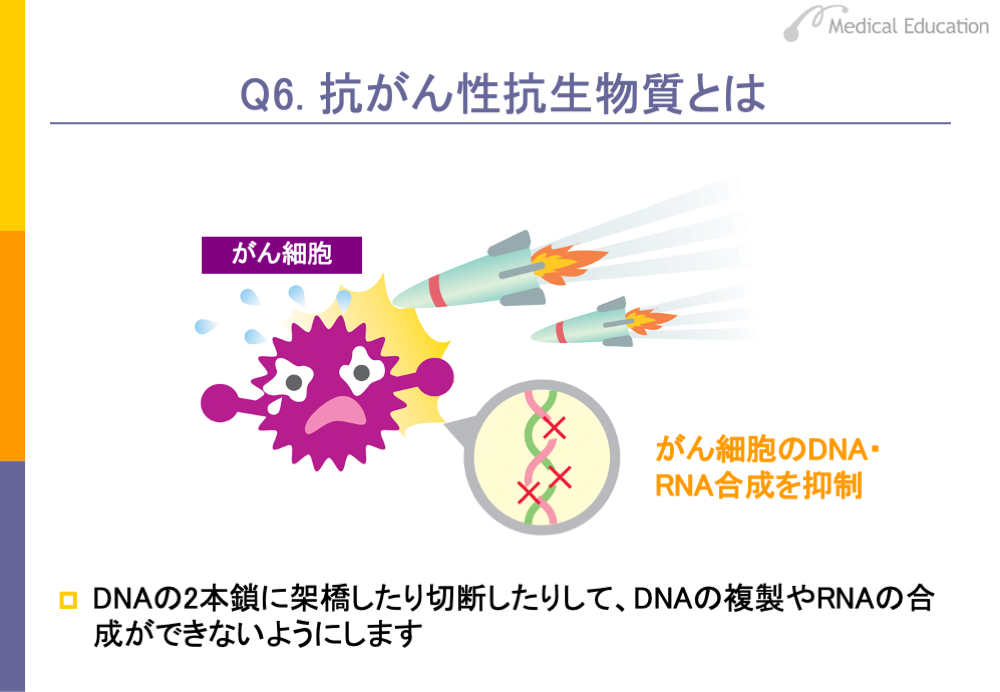
抗がん性抗生物質は、ある種の抗生物質と同じように、土壌に含まれる微生物からつくられたものです。もともと細菌やカビに効く構造を持った抗生物質の化学構造を変化させ、がん細胞への効果を発揮するようにしたものもあります。
抗がん性抗生物質の作用は一概にはいえませんが、一般的にDNAの2本鎖に架橋したり、切断したりして複製ができないようにする、あるいはDNAの情報を読み取るRNAの合成ができないようにするなどです。
DNAとRNAの合成を抑制するのが、抗がん性抗生物質の主な作用機序ということになります。

現在、固形がんなどの治療に最もよく使われているのが、アントラサイクリン系の薬剤です。代表的なものには、ドキソルビシンがあります。乳がんや肺がん、胃がん、胆のう・胆管がんなどの消化器がんなどに用いられます。投与量が増えると心毒性による心筋障害などが出現することがあるため、心機能の低下している患者への投与は慎重に行う必要があります。そのほか、悪心・嘔吐、脱毛などの副作用があります。
また、最近、エピルビシンが海外でよく用いられています。エピルビシンは、ドキソルビシンの類似薬として開発されたもので、ドキソルビシンに比べて心毒性が比較的軽いとされています。
ドキソルビシンとエピルビシンは、乳がんの多剤併用療法などにおいて重要な役割を担っています。

白金製剤で最も広く使われているのは、シスプラチンです。その他、シスプラチンの誘導体であるカルボプラチン、ネダプラチン、オキサリプラチンという薬剤もあります。このうち、オキサリプラチンは日本で開発された薬剤ですが、臨床評価されたのはフランスで、日本に逆輸入されたものです。
シスプラチンは成人の固形がんに対して広く用いられており、扁平上皮がん等によく効きます。腎毒性による腎障害が強いため、使用に当たっては輸液を行って尿量を3,000cc以上確保するなどの対応がとられています。また、嘔吐が必発するため、制吐剤が用いられます。

カルボプラチンはシスプラチンの副作用を軽減する目的で開発された薬剤です。腎毒性はシスプラチンに比べて軽減されましたが、血小板減少の発生頻度は高いとされています。
オキサリプラチンは、近年、大腸がんに対する標準療法として欧米で広く認められているFOLFOX(フォルフォックス)療法の中心的薬剤です。この薬剤独自の副作用として、神経毒性による末梢神経障害があります。投与を重ねるごとに増悪する傾向があります。オキサリプラチンは扁平上皮がんよりむしろ大腸がんなどの腺がんに効くという性質を持っていることから、白金製剤の中では少し傾向が違う薬剤といえます。

代謝拮抗剤とは、がん細胞が分裂・増殖する際に必要な代謝物質に似た物質で、本来の代謝物質の代わりにがん細胞に取り込ませることで、結果的にDNAの合成を阻害します。
具体的には、葉酸・プリン・ピリミジンに構造的に類似した物質で、これらが関連する酵素反応を阻害し、DNAの合成を阻害します。
このような作用機序から代謝拮抗剤は、細胞周期のS期(DNA合成)に特異的に作用するものが多いといえます。

代謝拮抗剤は大きくピリミジン系、葉酸系、プリン系、その他に分けられます。
日本で最も使われているのはピリミジン系薬剤で、フルオロウラシル(5-FU、ファイブエフユ-)、テガフール・ウラシル(UFT)、テガフール・ギメラシル・オテラシル(ティーエスワン、TS‐1)などがあります。このうち、フルオロウラシルは、対象患者や適応疾患が最も多い抗がん剤の1つで、主に腺がんに有効性を示します。一般的な副作用としては、食欲不振、下痢、悪心・嘔吐などの消化器症状、全身倦怠感などがあり、重い副作用としては、激しい下痢や出血性腸炎があります。
また、フルオロウラシルには、体内で分解されやすく、効果の持続時間が短いといった面があります。それを改善することを目的に開発されたのが、テガフール・ギメラシル・オテラシルやカペシタビンです。カペシタビンは、海外でよく用いられています。ゲムシタビンは、日本でも海外でもよく使われています。

テガフール・ギメラシル・オテラシルは経口抗がん剤で、フルオロウラシル類似の成分と抗腫瘍効果の増強および消化器毒性の軽減につながる成分を合わせた薬剤です。日本では、胃がんにおける標準的治療薬になっています。テガフール・ギメラシル・オテラシルは血液中のフルオロウラシルが高い濃度で維持されることから、副作用として骨髄抑制が強く出ることがあります。
葉酸代謝拮抗剤のメトトレキサートは、海外でよく使用されている薬剤です。日本でも、最近、メトトレキサートを組み入れた多剤併用療法が有効ながんが多いため、使われるようになってきました。海外では、乳がん、膀胱がんなどでメトトレキサートを組み入れた併用療法が標準的な治療になっています。メトトレキサート投与の際には、副作用である骨髄抑制や肝・腎障害などを軽減するために、ホリナートカルシウム(ロイコボリン)が投与されます。
その他、前述したピリミジン系薬剤に分類されるゲムシタビンは、膵臓がんにおける標準的治療薬となっています。

トポイソメラーゼ阻害薬は、1990年代に入って発売された薬剤で、現在よく使われています。DNAを複製するときには、DNAの長い2本鎖をいったんほどいて、複製が終わったらまたもとの形に戻すことが行われます。DNAの2本鎖をもとに戻すときに、その途中で絡まることがあります。 2本鎖を絡まったままにしておくと異常なDNAになってしまうため、トポイソメラーゼという酵素が働き、絡まった2本鎖をいったん切断してもとに戻してつなぎ直します。トポイソメラーゼにはトポイソメラーゼⅠとトポイソメラーゼⅡという2種類の酵素があり、トポイソメラーゼⅠは2本鎖のうち1本だけ切ってつなぎ直し、トポイソメラーゼⅡは2本とも切ってつなぎ直します。
トポイソメラーゼ阻害薬は、酵素がDNA鎖を切断するところまでは行わせますが、切断したDNAを修復する段階でその働きを止めてしまいます。その結果、DNA鎖は切れたままになってしまい、DNAの合成が阻害されます。これがトポイソメラーゼ阻害薬の作用機序と考えられています。

前に述べたとおり、トポイソメラーゼにはⅠ、Ⅱという2つの種類があります。
トポイソメラーゼⅠを阻害する代表的な薬剤はイリノテカンです。イリノテカンは、わが国で開発された薬剤で、大腸がんや肺がんの併用療法において重要な役割を果たしています。副作用としては骨髄抑制と下痢が知られており、下痢には、止瀉剤のロペラミド(ロペミン)の投与が効果的とされています。
一方、トポイソメラーゼⅡを阻害する代表的な薬剤には、エトポシドがあります。エトポシドは、肺小細胞がん、悪性リンパ腫、急性白血病などに用いられています。
なお、抗がん性抗生物質のアントラサイクリン系の薬剤も、トポイソメラーゼⅡを阻害します。
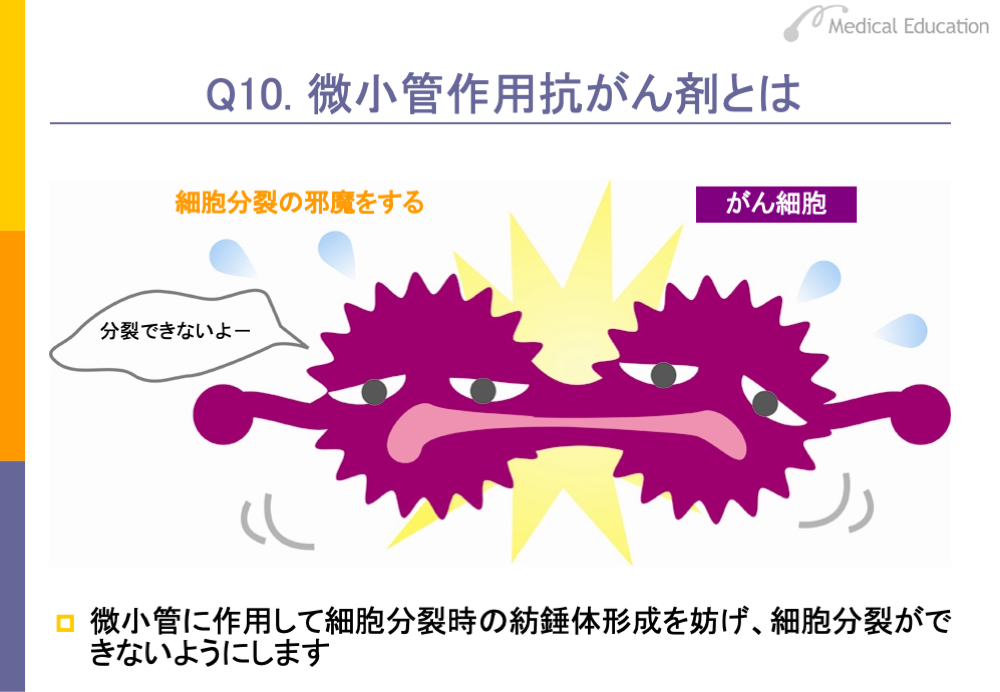
微小管は細胞分裂の際に紡錘体を形成したり、細胞内小器官の配置や物質輸送など、細胞の正常機能維持に重要な役割を果たしています。
細胞が分裂する際には紡錘体が染色体を引っ張って2つの細胞に分けますが、微小管作用抗がん剤は、その際に微小管を構成するたん白に作用し紡錘体の形成を阻害します。紡錘体の形成が妨げられると、細胞分裂ができなくなるため、そのがん細胞はM期のチェックポイントでチェックを受けてアポトーシスを起こします。これが微小管作用抗がん剤の作用機序です。微小管作用抗がん剤はM期に作用する薬剤ということになります。また、微小管は神経細胞の働きにも重要な役割を果たしているため、副作用として神経毒性による手足のしびれなどの末梢神経障害が出現することがあります。
なお、微小管作用抗がん剤は、大半が植物由来です。

微小管作用抗がん剤は、植物由来ですが、現在は多くのものは半合成品です。ビンカアルカロイドとタキサンに分けられます。
ビンカアルカロイドは比較的古い薬剤で、ビンクリスチン、ビンブラスチン、ビンデシンなどがあります。ビノレルビンはビンカアルカロイドですが最近の薬剤で、非小細胞肺がんや手術不能や再発乳がんに有効な薬剤です。神経毒性は低いとされています。
微小管作用抗がん剤でビンカアルカロイドよりも、最近よく使われているのはタキサン系の薬剤で、パクリタキセルとドセタキセルが代表的な薬剤です。

タキサン系の薬剤のうち、パクリタキセルは、アメリカイチイの樹皮などの抽出物からの半合成品です。パクリタキセルは、他の抗がん剤との併用療法で、さまざまながんに有用であるとされています。特に乳がんで有効性が認められており、術後の標準的な治療薬の1つとなっています。副作用としては、白血球減少などの骨髄抑制、手足のしびれ、関節痛などの末梢神経障害のほか、注射剤であることから溶媒による過敏反応(アナフィラキシーショック)があります。アナフィラキシーショックを予防するために治療前に抗ヒスタミン剤やステロイドホルモンを前投与するなどの処置がとられています。
また、ドセタキセルは、ヨーロッパイチイの針葉の抽出物からの半合成品です。ドセタキセルは、パクリタキセルと同様、乳がんの術後の標準的な治療薬の1つです。最近は肺がん、胃がん、頭頸部がん、食道がん、前立腺がんなど、さまざまながんへの有効性が証明されています。副作用はパクリタキセルと同じように過敏反応、白血球減少などの骨髄抑制、末梢神経障害のほか、ドセタキセルに特有なものとして浮腫があります。
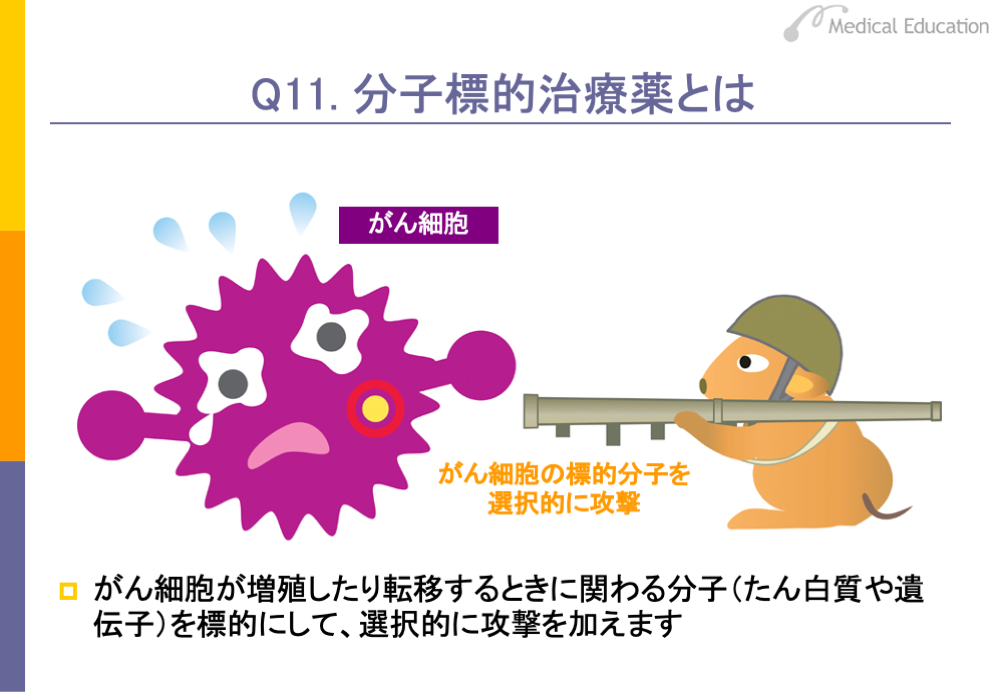
最近話題になっている抗がん剤に、分子標的治療薬があります。分子標的治療薬とは、がん細胞が増殖したり転移するときに関わるたん白質や遺伝子を標的として選択的に攻撃し、がん細胞の増殖の抑制や進展を阻止するものです。
たとえば、代表的な分子標的治療薬であるゲフィチニブは、上皮増殖因子受容体(EGFR:epidermal growth factor receptor)というたん白質を標的とし、細胞増殖を活発にする信号が出るのを阻害することで、がん細胞の増殖を抑制します。
従来の抗がん剤は、がん細胞に対して抗がん作用を示すと同時に、正常細胞にも影響を及ぼしさまざまな副作用が生じ問題となっていたことから、分子標的治療薬は開発されました。そのため開発当初は、従来の抗がん剤のような副作用はないのではないかと考えられていましたが、実際には骨髄抑制が起こったり、従来の抗がん剤ではあまり問題にならなかったような副作用が出現することがわかってきています。

現在、さまざまな分子標的治療薬が開発されています。市販されているものは、シグナル伝達系阻害薬と血管新生阻害薬、その他に分けられます。シグナル伝達系阻害薬は、細胞分裂や増殖、遊走、血管新生、細胞死などの過程を調節する上皮増殖因子受容体(EGFR)のシグナル伝達系などを阻害するものです。トラスツズマブ、ゲフィチニブ、エルロチニブ、イマチニブなどがあります。
このうちイマチニブは、慢性骨髄性白血病の人の95%にみられるフィラデルフィア染色体という異常染色体から産生されるbcr-albチロシンキナーゼという酵素をターゲットにしたもので、その働きを抑制します。bcr-albチロシンキナーゼは、慢性骨髄性白血病の原因物質で、骨髄細胞のたん白質のリン酸化を引き起こし、骨髄細胞の分裂に異常をもたらします。また、イマチニブは消化管間質腫瘍の原因となるKITチロシンキナーゼの働きも抑制することが明らかになったことから、消化管間質腫瘍の治療にも用いられています。
一方、血管新生阻害薬のターゲットはがん細胞ではなく、がん細胞へ伸びる血管です。血管新生阻害薬のベバシズマブは、がん細胞に伸びてくる血管を阻害し、がんに栄養が供給されないようにしてがんを死滅させます。
分子標的治療薬にはもう1つ、リツキシマブという薬剤があります。リンパ腫の中にCD20という特異的な抗原が発現している場合があり、これをターゲットにしています。
リツキシマブは抗体としてCD20に結びつき、がん化したB細胞を直接攻撃するとともに、免疫系を応援します。リツキシマブは「抗体医薬品」といわれるもので、分子標的治療薬の中では、少し傾向が違う薬剤です。
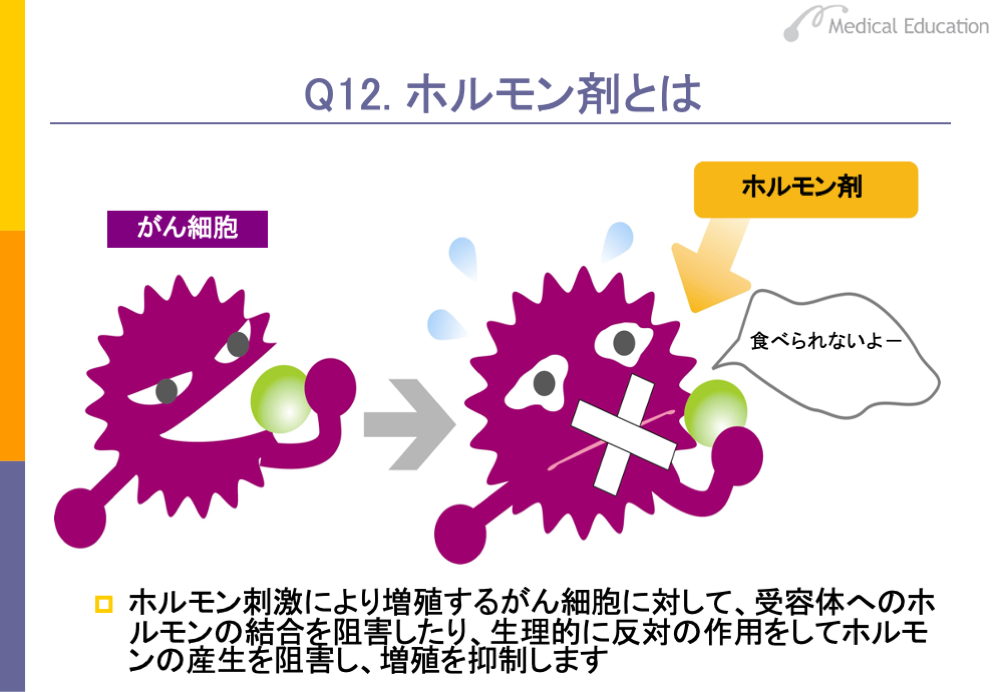
乳がん、前立腺がん、子宮体がんなどでは、がん細胞の増殖にホルモンを必要とします。これらのがんに対してそのホルモンに似せた物質を投与してがんの受容体への結合を妨げたり、生理的に反対の作用をするホルモンを投与してホルモンの産生を阻害し、がん細胞の増殖を抑制する治療法をホルモン療法といいます。そのときに使われる薬剤がホルモン剤です。たとえば、男性ホルモン依存性の前立腺がんに対して、女性ホルモン剤を投与したり、抗男性ホルモン剤を投与します。
ホルモン剤はがんを完全に治すことはできませんが、がんの進行を遅らせることができるほか、他の抗がん剤のように強い副作用はありません。

ホルモン剤には、副腎皮質ホルモン、女性ホルモンに対する抗エストロゲン薬、アロマターゼ阻害薬、男性ホルモンに対する抗アンドロゲン薬、LH-RHアナログ、黄体ホルモン薬があります。これらは、乳がんや前立腺がんの治療に用いられています。
乳がんは、エストロゲンが刺激となってがん細胞が増殖するため、これを止めるために抗エストロゲン薬が用いられます。抗エストロゲン薬の代表的なものに、タモキシフェンがあります。また、エストロゲンは閉経前は卵巣でつくられますが、閉経後は脂肪組織でアンドロゲンから転換されてつくられます。そのときにアロマターゼという酵素が関与しています。このアロマターゼを阻害して、体内のエストロゲンの量を少なくする働きをするのが、アロマターゼ阻害薬です。
一方、前立腺がんは男性ホルモンの一種であるテストステロンの刺激でがん細胞が増殖するため、これを止めるために抗アンドロゲン薬が用いられます。抗アンドロゲン薬は前立腺がん細胞にある男性ホルモン受容体をブロックして、テストステロンが結合できなくします。
LH-RHアナログは、前立腺がんと乳がんの両方に用いられる薬剤です。アナログとは類似品という意味です。性腺刺激ホルモン放出ホルモンであるLH-RHに似た作用を持つ薬剤を投与することで、脳下垂体から性腺刺激ホルモンである黄体形成ホルモン(LH)と卵胞刺激ホルモン(FSH)の分泌を低下させ、結果としてテストステロンやエストロゲンの分泌を抑制します。
悪性リンパ腫などの血液のがんには、糖質コルチコイドであるプレドニゾロンがリンパ球の分裂を抑制することから、用いられています。なお、黄体ホルモン薬は乳がん、子宮体がんに適応があります。

BRM(Biological Response Modifier)は、かつては免疫賦活剤と呼ばれていた薬剤です。正式には生物学的応答修飾剤といいます。BRMはがん細胞に作用するのではなく、免疫細胞に作用して免疫細胞を活発に働かせ、その免疫力でがん細胞を殺します。がん細胞に作用する免疫細胞には、マクロファージやキラーT細胞、ナチュラルキラー(natural killer)細胞があり、BRMはこれらの細胞の活性を高めてがん細胞を排除する作用を持っています。

BRMは、サイトカインであるインターフェロン、インターロイキンとそれ以外のものに分けることができます。インターフェロンにはアルファ型、ベータ型、ガンマ型の薬剤があり、インターロイキンにはインターロイキン2という薬剤があります。それ以外の微生物由来製剤には、溶連菌抽出物のピシバニールがあります。また、BCGもこの微生物由来製剤に含まれます。真菌・植物由来製剤としては、かわらたけ多糖体製剤のクレスチン(PSK)、レンチナン、ソニフィランが発売されています。
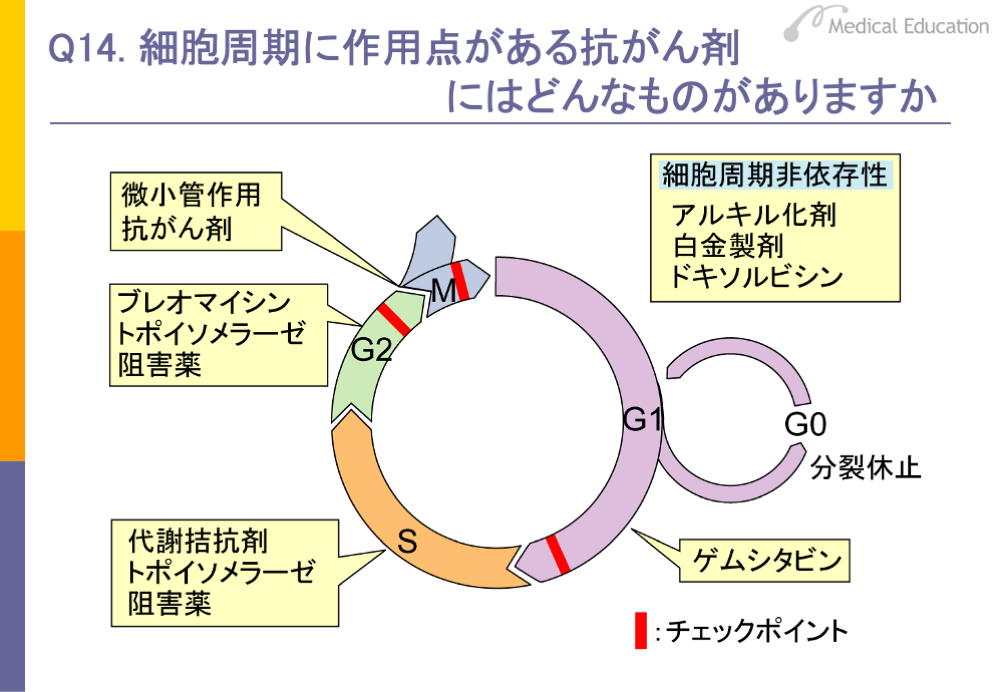
抗がん剤には、細胞周期に作用点があるものとないものがあります。一般的にシクロホスファミドなどのアルキル化剤やシスプラチンなどの白金製剤およびドキソルビシンなど一部の抗がん性抗生物質は、細胞周期にあまり関係なく作用する細胞周期非依存性の薬剤といわれています。
細胞周期に依存するもので、G1期後期に作用点をもつのは代謝拮抗剤のゲムシタビンやマイトマイシンCなど一部の抗がん性抗生物質です。
メトトレキサート、フルオロウラシル(5-FU)などの代謝拮抗剤はS期に作用します。また、トポイソメラーゼ阻害薬もS期に作用します。
G2期には、トポイソメラーゼ阻害薬と抗がん性抗生物質のブレオマイシンが作用することが知られています。
M期に作用するのは、微小管作用抗がん剤であるタキサン系の薬剤とビンカアルカロイド系の薬剤です。
細胞周期非依存性の薬剤は細胞周期のすべての期に作用しますが、G0期には作用しません。G0期はG1期の長くなったものですが、G0期にある細胞は分裂を休止しています。

抗がん剤治療では、何種類かの薬剤を組み合わせる多剤併用療法が一般的に行われています。1種類の薬剤だけでは効果が不十分な場合が多いためです。通常、2~3種類の薬剤を組み合わせます。最も多いのは3種類の組み合わせです。4~5種類併用する場合もありますが、併用薬剤の数を増やせば効果があがるというものではなく、4種類くらいまでが多剤併用療法として効果があがる限度と思われます。
多剤併用療法の原則の1つは、代謝拮抗剤と微小管作用抗がん剤を組み合わせるなど、作用メカニズムの異なる薬剤を組み合わせることです。この中には、細胞周期の作用点が異なる薬剤を組み合わせるということも含まれます。2つ目は、副作用の種類や発現時期の異なる薬剤を組み合わせることです。たとえば、あとから骨髄抑制の副作用が出るものと、神経毒性が出るものを組み合わせるなどです。一度に急激に副作用が出現するのを防ぐためです。3つ目は、至適量で至適スケジュールにより投与することです。一般的には単独で使用する量より少し減らして投与しますが、量が少な過ぎても効きません。適切な量の設定は、多剤併用療法では難題の1つとなっています。また、至適スケジュールとは、たとえば外来で注射による治療を行う場合など、3日おきの薬剤と4日おきの薬剤を組み合わせると患者さんは毎日通院しなければなりません。そのため、2週間に1度の投与で済むようにスケジュールが合った薬剤を組み合わせます。4つ目は、多剤併用療法に限りませんが、可能な限り短い期間で治療を繰り返すということです。

食道がんはシスプラチンとフルオロウラシル(5-FU)の併用に放射線治療を加えるのが標準的な治療となっています。頭頸部でも同様の治療が行われます。
胃がんは海外では標準的化学療法と言えるものはほとんど見当たりませんが、わが国ではテガフール・ギメラシル・オテラシル(TS-1)とシスプラチンの併用が標準的な治療として行われています。
大腸がんは、2000年ごろまではフルオロウラシルとフルオロウラシルの効果を増強するレボホリナートの併用が標準的治療として行われていましたが、現在はFOLFOX(フォルフォックス)やFOLFIRI(フォルフィリ)が標準的治療になっています。
乳がんは、進行がんにはCAF(カフ)やCEF(セフ)が、術後補助化学療法にはCMFが用いられていましたが、最近はアントラサイクリンとシクロホスファミド(AC)投与後にタキサン系薬剤を投与する方法がよく使われています。
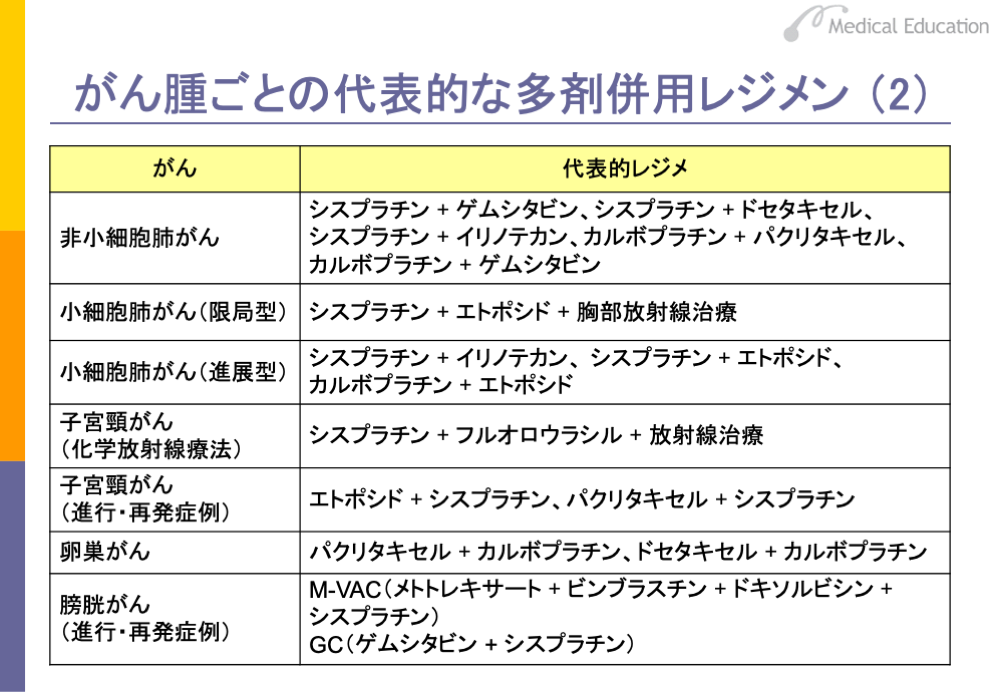
非小細胞肺がんは、白金製剤とタキサン系やゲムシタビンあるいはイリノテカンの併用が行われていますが、いずれの方法によっても生存率に大差はありません。小細胞肺がんは、白金製剤とエトポシドあるいはイリノテカンの併用が行われています。
子宮頸がんは、シスプラチンとフルオロウラシル(5-FU)やエトポシドあるいはタキサン系薬剤の併用がよく行われています。卵巣がんは、白金製剤とタキサン系薬剤の併用が行われています。
膀胱がんは、欧米では、進行・再発例に対してM-VAC(エムバック)療法が20年ほど前から標準的治療として行われてきましたが、日本では数年前にようやく認可されました。最近ではGC療法が、膀胱がんの標準的な化学療法になっています。
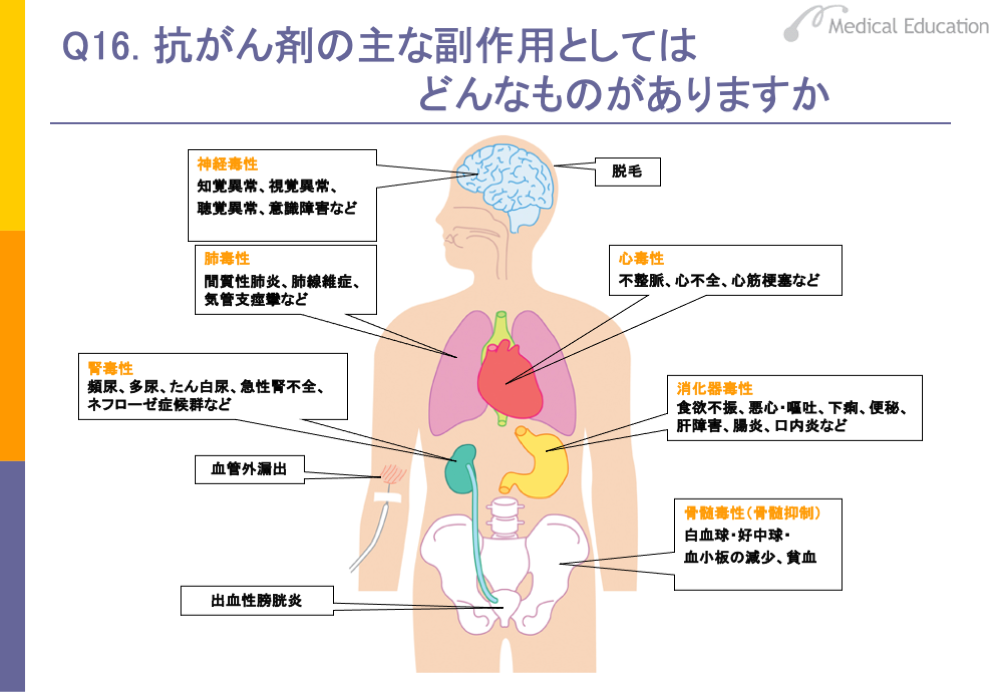
抗がん剤は、基本的に増殖の盛んな細胞に対して、増殖を抑えたり止めたりする作用を持っています。人間の身体の細胞のほとんどは、ゆっくり増殖しているので、通常は抗がん剤は作用しません。しかし、中には増殖の早い細胞があり、抗がん剤は、この増殖の早い正常細胞に作用してしまいます。増殖の早い細胞の1つに、骨髄の細胞があります。たとえば白血球のうち最も多い好中球は、3~4日で入れ替わります。抗がん剤は増殖の盛んな骨髄の細胞に作用し、その結果、骨髄で血液の細胞が作られなくなり、白血球、血小板、赤血球の数が減少するということ、つまり骨髄抑制が起こります。また、消化管の粘膜も増殖が早いため、抗がん剤が作用します。胃粘膜に作用すると悪心・嘔吐、食欲不振が起こり、小腸粘膜に作用すると水分の吸収を阻害して下痢を起こします。それ以外にも、口腔粘膜に作用した場合は、口内炎が起きてきます。また、皮膚や毛根の細胞も増殖が早く、毛根の細胞に抗がん剤が作用すると、毛が抜けて、その後も新しい毛が生えてこないという脱毛症状が起こります。
骨髄抑制、消化器症状、脱毛は、ほとんどの抗がん剤で必ず起こる副作用です。それ以外には、神経毒性、肺毒性、腎毒性、心毒性などが現れることもあります。その他、マイトマイシン、ドキソルビシン等の抗がん性抗生物質の点滴が血管外に漏れた場合は、その周辺が壊死を起こします。

抗がん剤の副作用は自分でわかる自覚症状と、検査でわかる他覚症状に分けられます。自覚症状としては、悪心・嘔吐などがありますが、抗がん剤によっては非常に早期にこのような副作用が出るケースがあります。シスプラチンなどでは、投与初期に現れます。また、投与から少し経ってから食欲不振、悪心・嘔吐、便秘などが出てくるケースもあります。フッ化ピリミジン系薬剤などでは、投与から1週間くらいまでの間にこのような副作用が発現することが多いようです。これを過ぎると、2週間後くらいに口内炎、下痢などの消化器症状が現れ、少し遅れて神経毒性、脱毛などが現れます。
他覚症状の所見では、投薬後約1~2週間で骨髄抑制が発現します。したがって、抗がん剤の投与開始から最初の1~2ヵ月間は、少なくとも2週間おきに1度、血液検査を行う必要があります。骨髄抑制の中で一番初めに出てくるのは白血球減少です。少し遅れて血小板減少が出てきます。白血球は寿命が3~4日なので比較的早めに減少してきますが、血小板の寿命は1ヵ月くらいあるため、血小板減少までには1ヵ月くらいかかります。赤血球の障害としては、貧血が出てきます。赤血球の寿命は約120日であるため、貧血の発現は3~4ヵ月くらい先になります。

抗がん剤の副作用の重篤度判定については、以前は副作用の発生頻度でしか表されていませんでした。しかし、20年ほど前、アメリカを中心に、軽度な副作用はそれほど心配することはなく、治療が必要とされる副作用をマークすべきという考え方が出てきて、米国国立がん研究所(National Cancer Institute)により共通毒性規準(Common Toxicity Criteria)であるNCI-CTCがつくられました。 NCI-CTCは副作用(有害事象)の強さがGradeで分類されるようになっています。このNCI-CTCに基づき、日本癌治療学会が判定規準を作っていますが、現在はNCI-CTCの改訂版である有害事象共通用語規準(CTCAE: Common Terminology Criteria for Adverse Event )を用いるのが一般的です。
CTCAE のGrade 1は軽症、治療を要さない有害事象、2は中等症、最小限の治療が必要な有害事象、3は重症、入院や入院期間の延長が必要な有害事象、4は生命を脅かす有害事象または緊急処置を必要とする有害事象となります。また、Grade 5は有害事象による死亡です。一般的にGrade 3以上が軽微でない副作用として判断されます。抗がん剤の評価を行うときは、通常、Grade 1~4の副作用の頻度と、その中でGrade 3~4の副作用の頻度はどのくらいかをみて、この2つを併記します。また、Grade 5は中毒死(toxic death)として扱われます。
脱毛や皮膚萎縮などのように、生命の危険を伴わない有害事象は、Grade 2までしか分類していない場合もあります。逆に重篤な副作用である発熱性好中球減少症はGrade 1、2はなくGrade 3以上に分類されています。
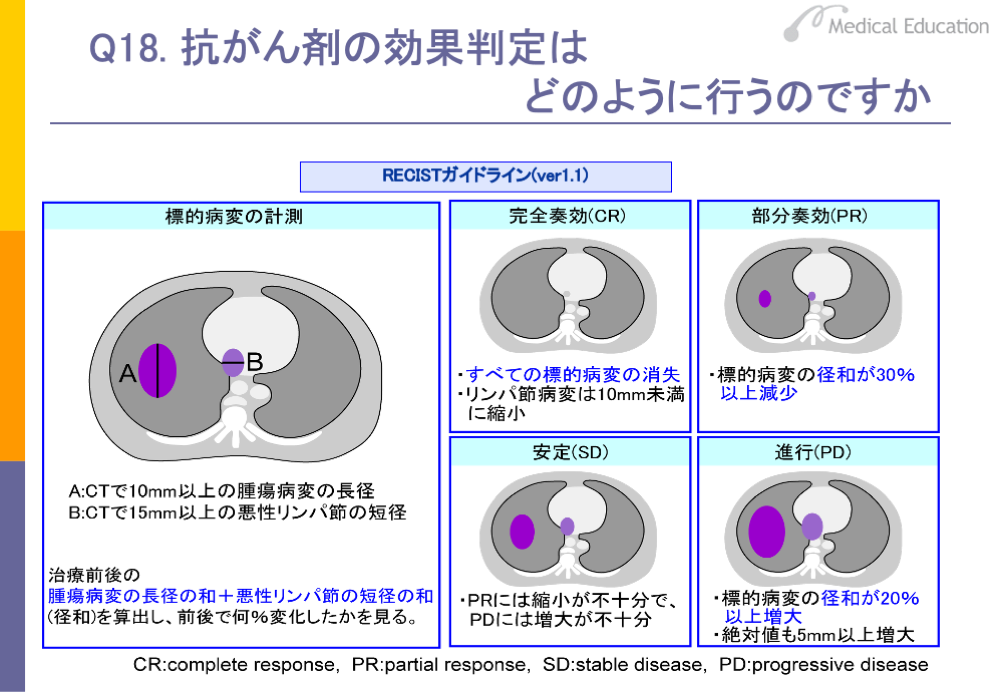
従来、わが国では腫瘍縮小効果に基づく抗がん剤の効果判定として、WHOの基準を参考に日本癌治療学会が定めた「固形がん化学療法直接効果判定基準」が用いられてきました。しかし、WHOの基準では臨床試験ごとに効果判定の方法が一定ではないなどの問題が明らかになり、2000年に、欧米で新しい固形がん治療効果判定のためのガイドラインとしてRECIST(レシスト)「New Guidelines to Evaluate the Response to Treatment in Solid Tumors」が作成されました。 RECISTは、わが国でも2003年より採用され、2009年にはバージョン1.1に改訂されたのを機に変更されています。
RECISTには、腫瘍のサイズ変化を客観的に評価する標準的方法が記載されています。具体的には、治療前に全腫瘍病変をCTなどで測定が可能な標的病変と、測定ができないものは可能な非標的病変に分けて評価します。標的病変では最長径の和と転移が疑われる悪性リンパ節の最短径の和が治療によってどのくらい変化したかを測定し、完全奏効、 部分奏効、安定、進行の4段階に分けて効果判定を行います。さらに標的病変に対する効果に非標的病変に対する効果や新病変出現の有無を組み合わせて総合効果を評価します。
しかし、RECISTをわが国のがん治療に適応すると問題となる場合もあります。たとえば、胃がんは、わが国では内視鏡やX線二重造影法で効果判定しますが、RECISTではこれらの検査法は推奨されておらず胃の病変は非標的病変とされています。また、乳がんの骨転移の場合等、骨病変に対するシンチグラムも再現性のない方法とされ、標的病変から除外されてしまいます。このような場合は、当該領域の専門学会で策定された判定基準に従うこととされています。