がん遺伝子検査入門(4)

遺伝子検査の内容を理解したうえで、改めて分子標的薬との関係を考えるのが、ここからの内容です。どのような薬剤であるか、基本的特徴を把握するとともに、標的分子とどのように対応するのか、その関係性をみていくことにしましょう。
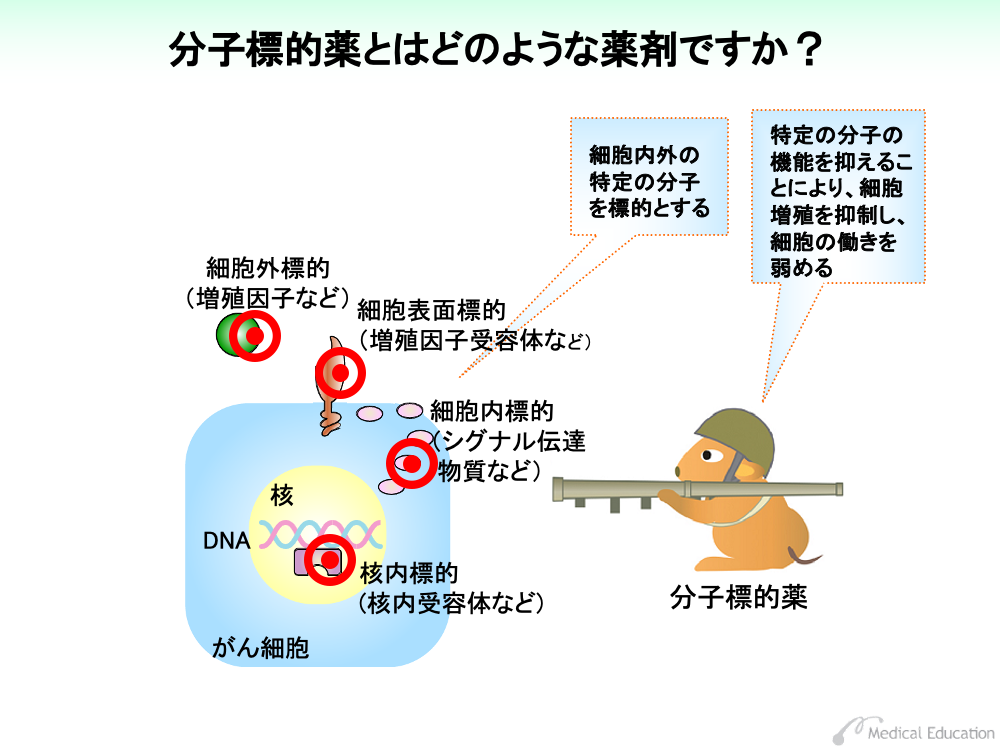
分子標的薬は、その名前通り体内の特定の分子を標的にして、機能を抑えることにより細胞増殖を抑えたり、細胞の働きを弱める薬剤です。
ターゲットとなる分子は細胞外や細胞表面に、あるいは細胞内や核内にも存在しています。
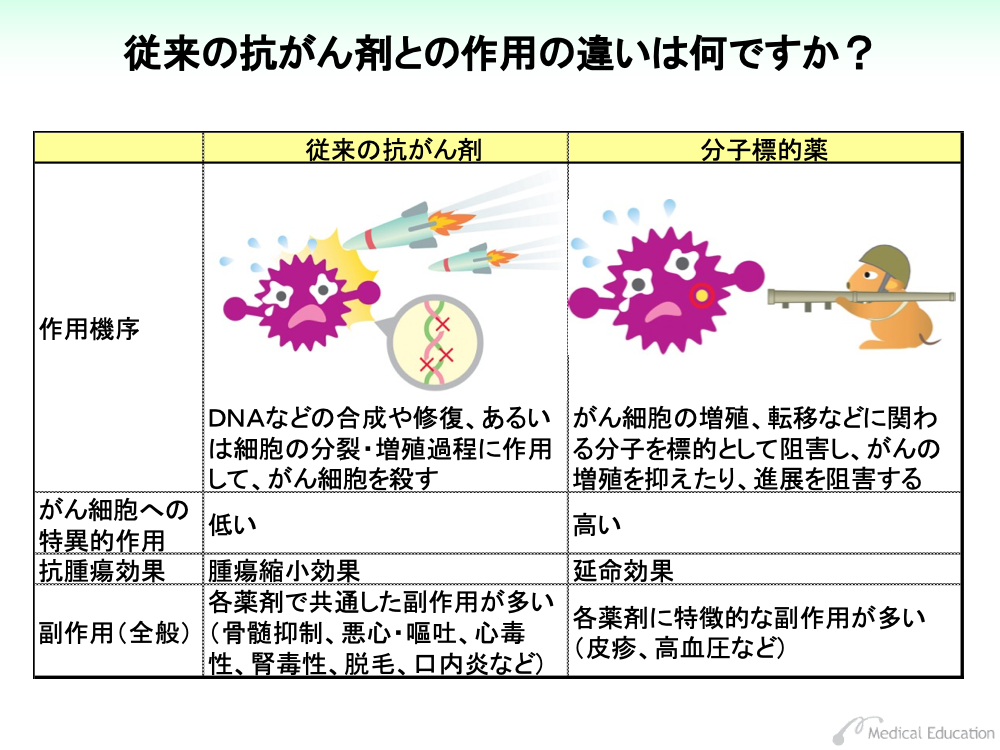
従来の抗がん剤は、DNAなどの合成や修復を阻害したり、あるいは細胞の分裂・増殖過程に作用してがん細胞の傷害を起こす殺細胞性の薬剤が大半でした。
そのため、がん細胞以外の正常細胞に対しても作用するなど特異性が低く、骨髄や消化管粘膜に作用して骨髄抑制や悪心・嘔吐といった副作用が発現してしまいます。
一方、分子標的薬は前述のように特定の分子を標的に、がん細胞の増殖を阻害します。
分子標的薬はがん細胞に特異的に効果を示すため最大耐容量と最小有効量の差が大きく、毒性が従来の薬剤と異なっており、それぞれの薬剤に特徴的な副作用が出現します。
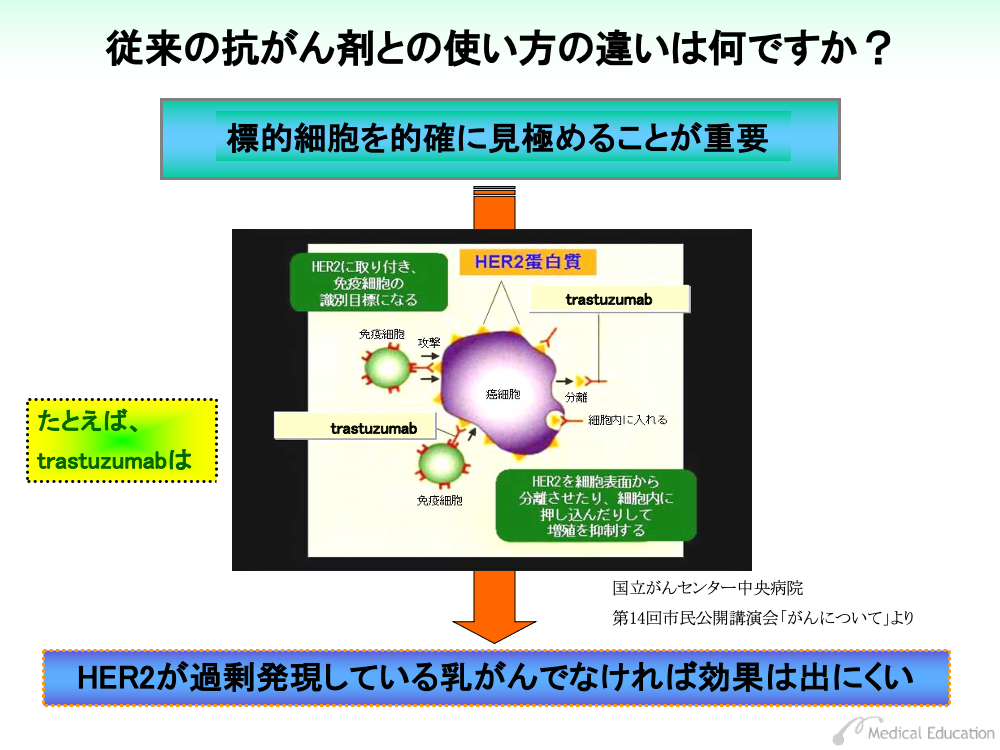
特定の分子を標的とする意味では、それを的確に見極めることが重要になります。
細胞膜を貫通する受容体は、適切に働けば細胞の分化・増殖を調整しますが、HER2と呼ばれる受容体は乳がん患者の約30%で過剰発現し、がん化を促すとされています。
たとえばtrastuzumabというモノクローナル抗体は、このHER2の細胞外領域に結合し、機能を阻害します。同時に、がん細胞を標識として、生体の持つ免疫細胞作用を強化させる働きも持っています。
したがって、この薬剤はHER2の過剰発現が使用の前提条件となります。

たとえば、慢性骨髄性白血病に対し、 JALSG(日本成人白血病治療共同研究グループ) により行われた 2つの研究を比較すると、従来の標準的な薬物療法であるinterferon-αを用いたALL93試験で得られた生存率に比べ、 imatinibを用いたALL202試験で得られた生存率のほうが良好な成績であったことが明らかです(JALSGALL93試験およびALL202試験結果比較)。
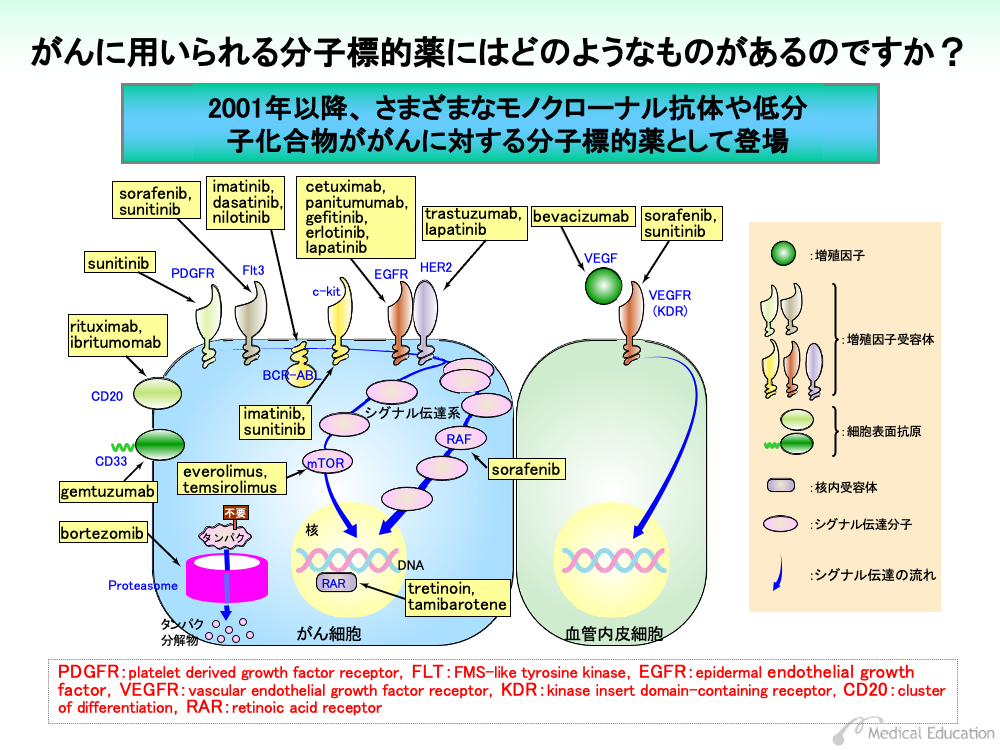
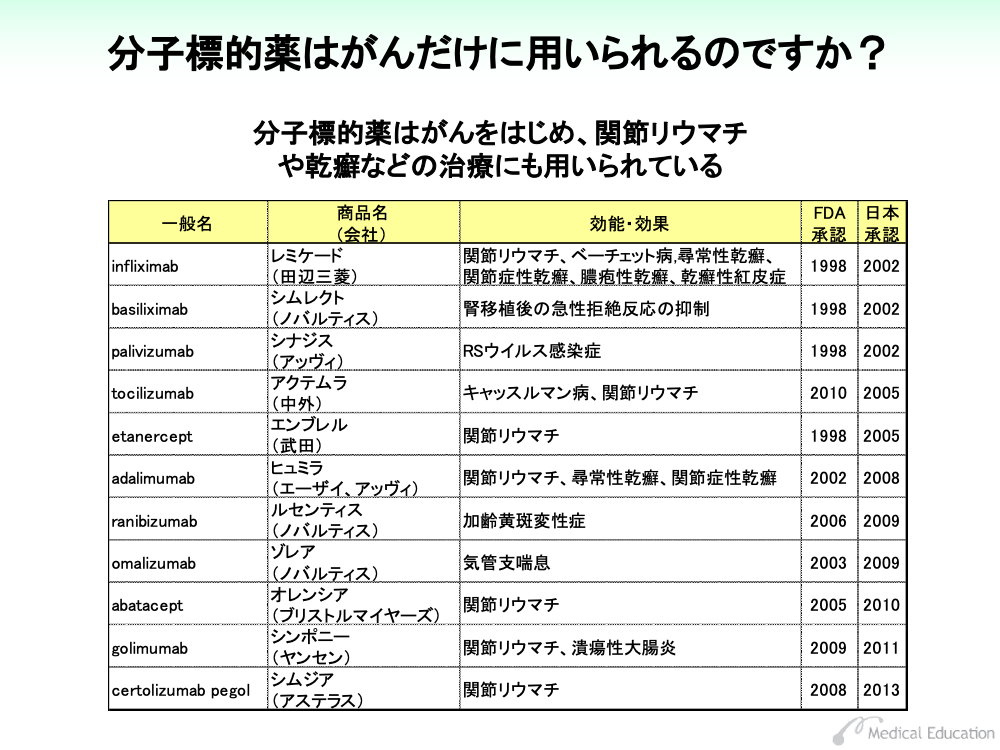
わが国では2001年以降、さまざまな種類のモノクローナル抗体と低分子化合物が分子標的薬として用いられています。
前者は、膜タンパク受容体またはそれに結合する分子(リガンド)に作用します。後者は、細胞内に入り込み、活性分子の機能を阻害することで効果を示します。
これらの多くはがん細胞内あるいはがん細胞表面に標的を有していますが、がんに栄養や酸素を供給する血管の内皮細胞をターゲットにした薬剤もあります。

分子標的薬は、効能・効果に標的となる分子の異常が明記されたものがいくつかあり、検査により異常の有無を確認する必要があります。これらの標的分子の異常は、遺伝子検査のほか、従来からある免疫抗体法や染色体検査などにより判定されます。
cetuximabはEGFR陽性の結腸・直腸がんに、panitumumabはK-ras遺伝子野生型の結腸・直腸がんに効能・効果を認められています。これらの薬剤は、 EGFR陽性のK-ras遺伝子野生型の結腸・直腸がんに有効であることが明らかにされており、EGFRの免疫染色と、K-ras遺伝子検査により薬剤の適応となるかが判断されます。
また、 trastuzumabやlapatinibはHER2過剰発現が確認された乳がんに対して認可されています。HER2が過剰発現しているか否かは乳がん組織のHER2を免疫染色法やFISH法と呼ばれる遺伝子検査で確認を行います。
imatinibやdasatinibは、フィラデルフィア染色体陽性の白血病に用いられますが、フィラデルフィア染色体の検出は顕微鏡による染色体検査のほか、最近では遺伝子検査も用いられています。また、KIT陽性消化管間質腫瘍ではc-kit遺伝子の遺伝子検査が行われます。
rituximabやgemtuzumabでは、白血球表面のCD20やCD33といった細胞表面の抗原を免疫染色により検査を行い、投薬の可否を決めます。
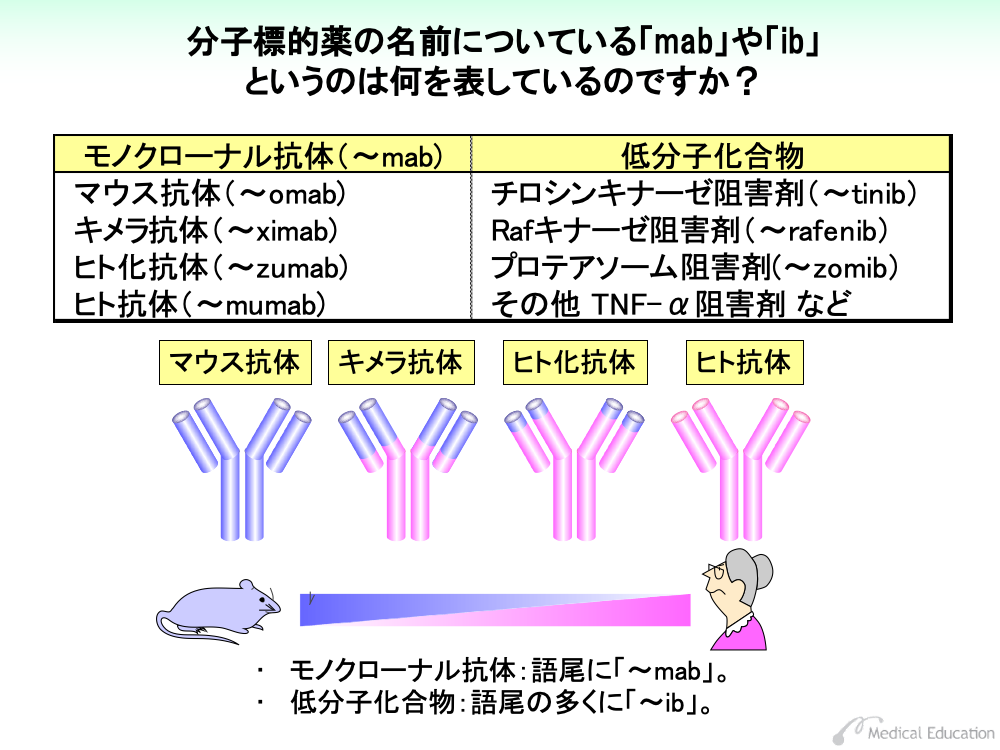
分子標的薬は、モノクローナル抗体と低分子化合物の2種類の製剤に分けられます。このうちモノクローナル抗体(monoclonal antibody)製剤は、由来物により4つに種別されます。それぞれの語尾は次のように変化します。
・マウス抗体は、抗体全体がマウス由来のもので、語尾は「~omab」となります。
・キメラ抗体は、抗原に結合する部分である可変領域をマウス由来の免疫グロブリンに置き換えたもので、語尾は「~ximab」となります。
・ヒト化抗体は、可変領域のうち、相補性決定領域と呼ばれる部分をマウス由来の免疫グロブリンに置き換えたもので、語尾は「~zumab」となります。
・ヒト抗体は、全体がヒトの抗体で出来上がっているもので、語尾は「~mumab」となります。
語尾の前に「tu」(~tuximab、~tuzumab、~tumumabなど)が入っている場合は、腫瘍(tumor)を標的とする薬剤です。
低分子化合物は、阻害剤(inhibitor)が主体で、大半の薬剤名称の語尾に「~ib」がつきます。代表的なものとして、チロシンキナーゼ阻害剤(tyrosine kinase inhibitor)があり、語尾は~tinibとなります。
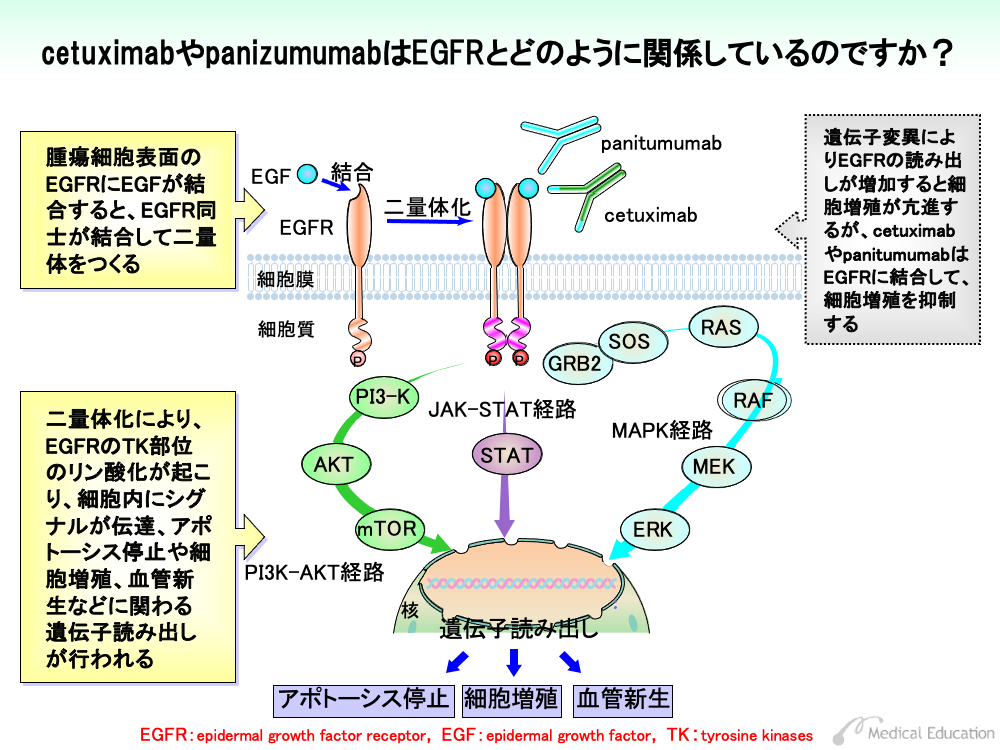
EGFRは、細胞膜を貫通する形で細胞膜表面に存在しており、細胞外領域、細胞膜貫通領域、細胞内領域の3つの部分から成り立っています。細胞外領域には上皮成長因子(EGF)などのリガンドが結合する部分があります。また、細胞内領域にはチロシン部分にリン酸基をつける働きを持つチロシンキナーゼ (TK) 部位が存在しています。TK活性部位が働くためには、リン酸基の供給源となるATPが必要です。
①細胞膜表面のEGFRの細胞外領域にEGFなどのリガンドが結合します。
②リガンドの結合したEGFは、2つの分子が結合した二量体をつくります。
③二量体化によりEGFRのTK活性部位にATPが結合して、それぞれのEGFRのTK活性化部位がリン酸化により活性化されるとともに、近傍のチロシン部分をリン酸化することによりシグナルを伝えます。
④TK活性部位のリン酸化によるシグナルは、いくつかの経路により伝達されます。そのうち主なものはMAPK経路、JAK-STAT経路、PI3K-AKT経路と呼ばれ、これを通したシグナル伝達により、アポトーシス停止や細胞増殖、血管新生などに関わる遺伝子の読み出しが行われます。
これらの経路はいくつかのタンパク質が関与しており、1つのタンパク質がリン酸化により活性化されると、これがその次(下流)のタンパク質をリン酸化するといったメカニズムにより、シグナル伝達が行われます。
EGFRが過剰に発現すると、このようなシグナル伝達が盛んに行われるため細胞が増殖します。cetuximabやpanitumumabなどEGFRをターゲットとした薬剤では、EGFRの過剰発現を免疫染色法などにより検査してから投与する必要があります。

EGFRにおけるシグナル伝達系の一員であるRASタンパクは、シグナルを受け取ると、結合しているGDPがGTPへと変わって活性化され、さらに下流にシグナルを伝えます。シグナルを伝え終わったRASはGTPがGDPに戻り、不活性型となります。
RASをコードする遺伝子はK-ras、H-ras 、N-ras の3つが知られています。
このうちK-ras遺伝子のエキソン2のcode12やcode13と呼ばれる部位に変異が起こると、異常なmutant RASがつくられます。 mutant RASでは、結合しているGTPをGDPに戻すメカニズムが働かず活性型のままになっており、EGFRからのシグナルが来ない状況でも、下流にシグナルを発信してしまい、細胞増殖が起こります。
したがって、EGFRに対する抗体であるcetuximabやpanitumumabは、K-ras遺伝子変異を起こしている腫瘍細胞には無効となります。このため大腸がんでは、K-ras遺伝子の検査を行ってから投与する薬剤の選択が行われています。また、肺がんや膵臓がんでもK-ras遺伝子の検査が保険適応となっています。
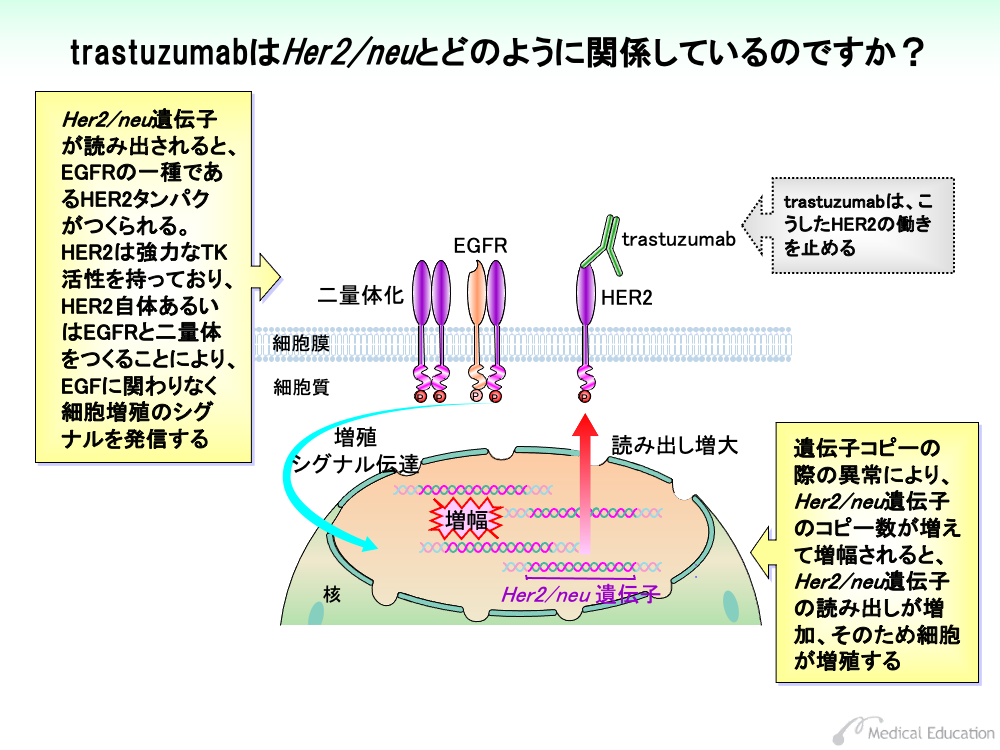
受容体EGFRには、EGFR1、EGFR2、EGFR3、EGFR4の4種類あります。このうちEGFR2はHER2あるいはErbB2と呼ばれており、このタンパクをコードする遺伝子はHer2/neu遺伝子といいます。
Her2/neu遺伝子が読み出されるとHER2がつくられますが、このHER2は強力なTK活性を有しています。
HER2は、EGFが結合しなくてもHER2同士あるいは他のEGFRと結合して二量体を形成します。すなわちHER2はEGFなどのコントロールを受けることなく、TK活性を発現して細胞増殖シグナルを発信してしまうのです。
遺伝子をコピーする際の異常により、Her2/neu遺伝子のコピー数が増幅されると、Her2/neu遺伝子の読み出しが増加し、そのため細胞が増殖します。
HER2の過剰発現はIHC染色法により検査が行われますが、 Her2/neu遺伝子のコピー数増加はFISH法により検出が行われます。
IHC法では、染色結果を0、1+、2+、3+と4段階で判定し、0、1+ を陰性、2+ を境界域 、3+ を陽性と評価することになっています。IHC法で2+ と判定された場合は、FISH法により Her2/neu遺伝子の過剰な読み出しが起こっているか否かを検査します。FISH法では、陰性、境界域(equivocal)、陽性の3区分に分けて判断が行われます。
trastuzumabはHER2に対する抗体であり、HER2に結合してその働きを止めるほか、抗体依存性細胞障害作用(ADCC)による乳がん細胞破壊を促進します。
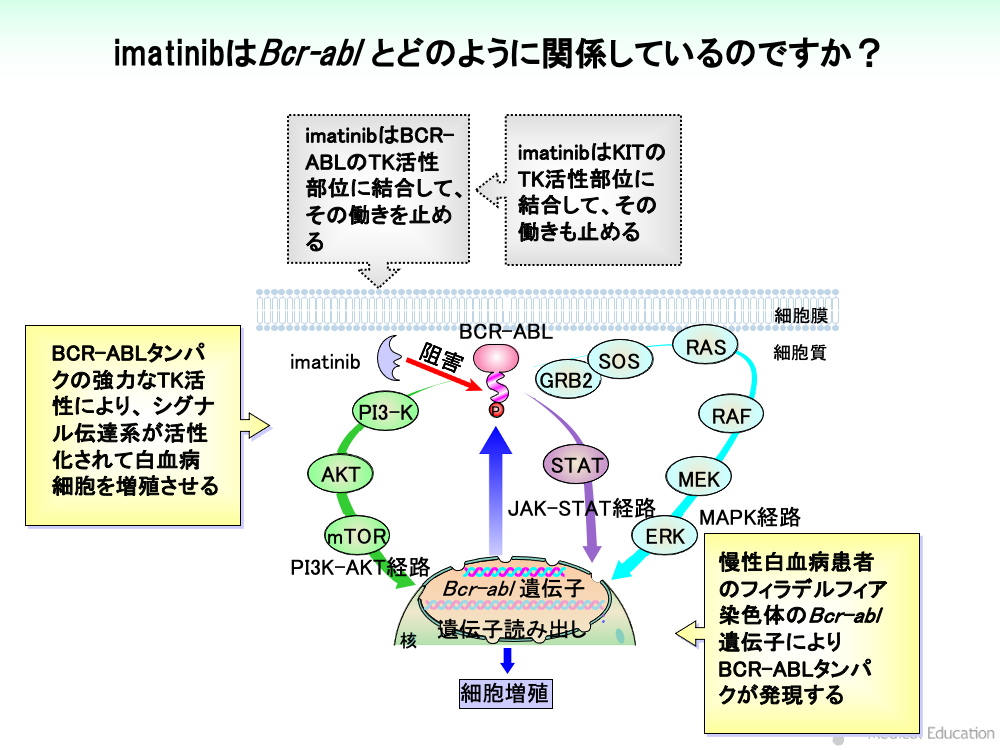
多数の慢性白血病患者ではフィラデルフィア染色体が見出されます。
フィラデルフィア染色体のBcr-abl遺伝子により発現されたBCR-ABLタンパクは強力なTK活性を有しており、EGFRの場合と同様に MAPK経路、JAK-STAT経路、PI3K-AKT経路を活性化させて白血病細胞を増殖させます。
imatinibは、BCR-ABLのTK活性部位に結合して、その働きを止めます。
BCR-ABLはEGFRと異なり、細胞外領域や細胞膜貫通領域を持たず、TK活性部位の活性化に増殖因子の結合を必要としません。
消化管間質腫瘍(GIST:gastrointestinal stromal tumor)の大半は、c-kit遺伝子の変異により、 KIT(CD117)と呼ばれる受容体が細胞表面に発現しています。 KITは幹細胞因子(stem cell factor:scf)の結合により二量体化が起こり、TK活性部位が活性化され、細胞増殖シグナルが下流に伝わります。
imatinibは、KITのTK活性部位に結合して、その働きを止めます。

imatinibのターゲットとなるBCR-ABLタンパクのTK活性部位に対応するコードはAbl遺伝子の5~10番目のエキソンに存在しています。
この領域に点変異が生じると、imatinibのTK活性部位に対する結合が低下し、耐性が生じます。
このようなTK活性部位の点変異によるimatinib耐性に対しては、dasatinib、nilotinib、bosutinibといった第二世代の薬剤が開発されています。
なお、 GIST(消化管間質腫瘍) 症例においてはc-kit遺伝子のエキソン11の変異がimatinibの耐性をもたらすことが知られています。
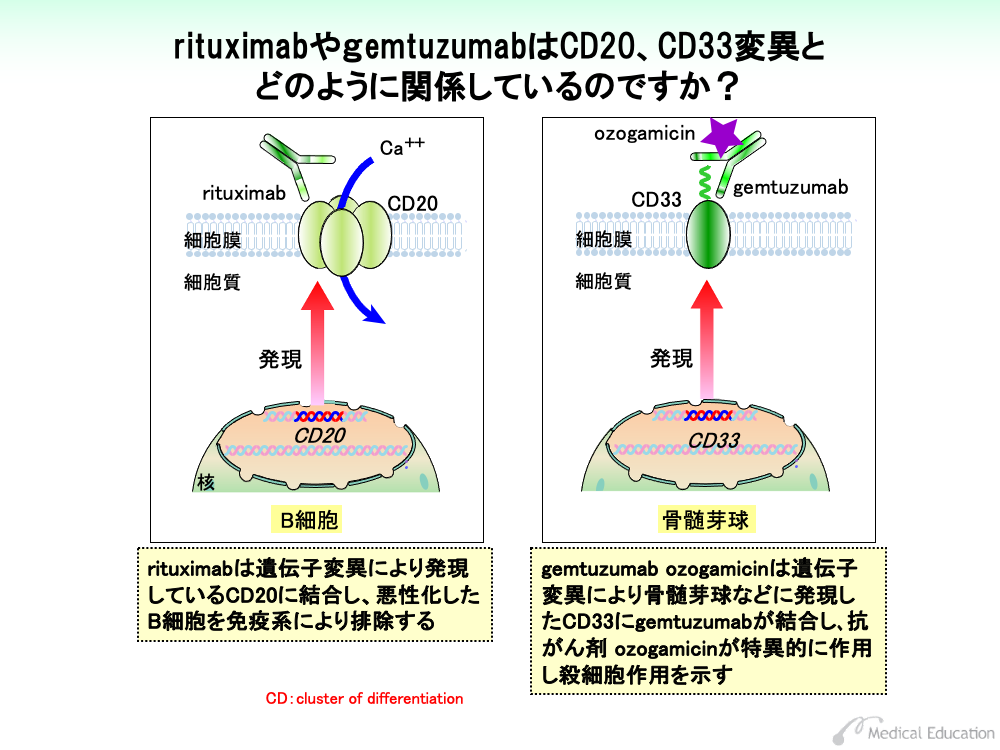
非ホジキンリンパ腫は、B細胞が悪性化したタイプのものと、T細胞が悪性化したタイプのものに分けられます。このうちB細胞性の非ホジキンリンパ腫では遺伝子変異により、CD20というタンパク質が細胞膜に発現してきます。
CD20は、いくつか集まってカルシウムチャネルを形成し、細胞内カルシウム濃度を上げることにより細胞周期を増殖させる方向に向かわせます。
rituximabはCD20に対する抗体で、CD20の発現しているB細胞系の非ホジキンリンパ腫細胞に結合して、マクロファージによる細胞破壊を行わせます。
CD33は、他の細胞との接着をするときに働く糖タンパクで、正常の造血幹細胞には存在しません。骨髄性白血病や一部のリンパ性白血病、リンパ腫では遺伝子変異によりCD33が発現しており、gemtuzumabはこのCD33に結合します。