がん化学療法入門(1)
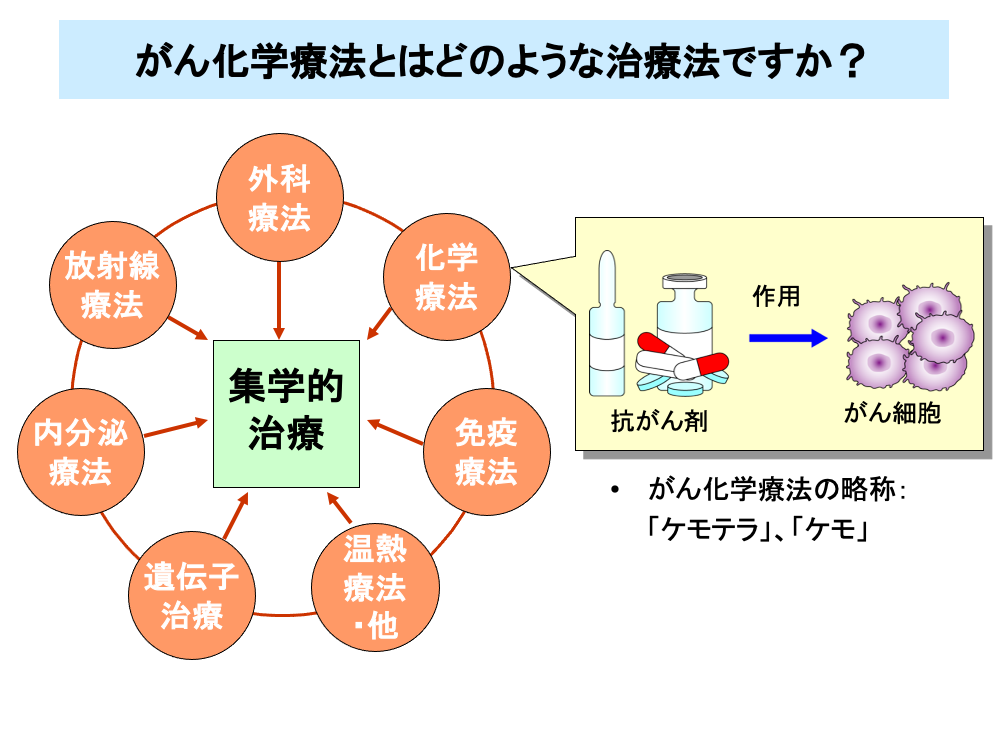
「ケモテラ」あるいは「ケモ」と略して呼ばれるがん化学療法は、外科療法や放射線療法とともに、がんの総合的な治療(がん集学的治療)の一角を占める重要な治療法です。
化学療法は、医薬品を用いた治療を指しますが、もともとは化学薬品による感染症の治療を意味していました。
この考え方を拡大して、がんに対する化学薬品による治療を「がん化学療法」と呼ぶようになりました。
感染症における化学療法は病原微生物に対する薬剤である抗菌剤を用いますが、「がん化学療法」はがん細胞に対する薬剤、すなわち抗がん剤を用います。
抗菌剤、抗がん剤ともに、増殖の盛んな細胞に作用する特徴を有しています。また、耐性が生じやすい点も両者に共通の問題点としてあげられます。
このようなことから、がん化学療法の理論は抗菌剤における理論を応用してつくられています。
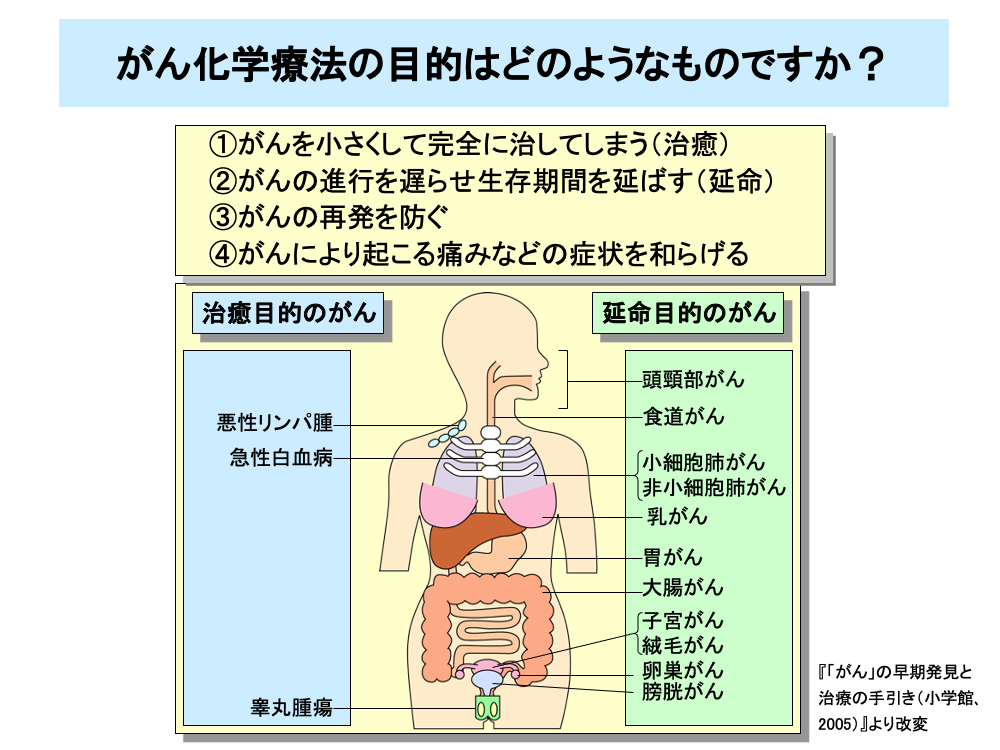
がん化学療法の目的は、がんの種類や進行度によって異なります。
一般的には、
①がんを小さくして完全に治してしまう、すなわち治癒を目的とするもの
②がんの進行を遅らせ生存期間を延ばす、すなわち延命を目的とするもの
③がんの再発を防ぎ、延命をはかるもの
④がんにより起こる痛みなどの症状を和らげ、患者のQOL向上をはかるもの
などが目的としてあげられます。
また、がんの種類により化学療法の目的が異なります。
治癒を目的とするがんには、ホジキンリンパ腫や非ホジキンリンパ腫などの悪性リンパ腫、骨髄性およびリンパ性の急性白血病といった血液系のがんや睾丸の胚細胞性腫瘍など一部の固形がんがあげられます。
一方、肺がん、胃がん、大腸がん、乳がんなど、ほとんどの固形がんは、延命あるいは症状緩和を目的として行われます。
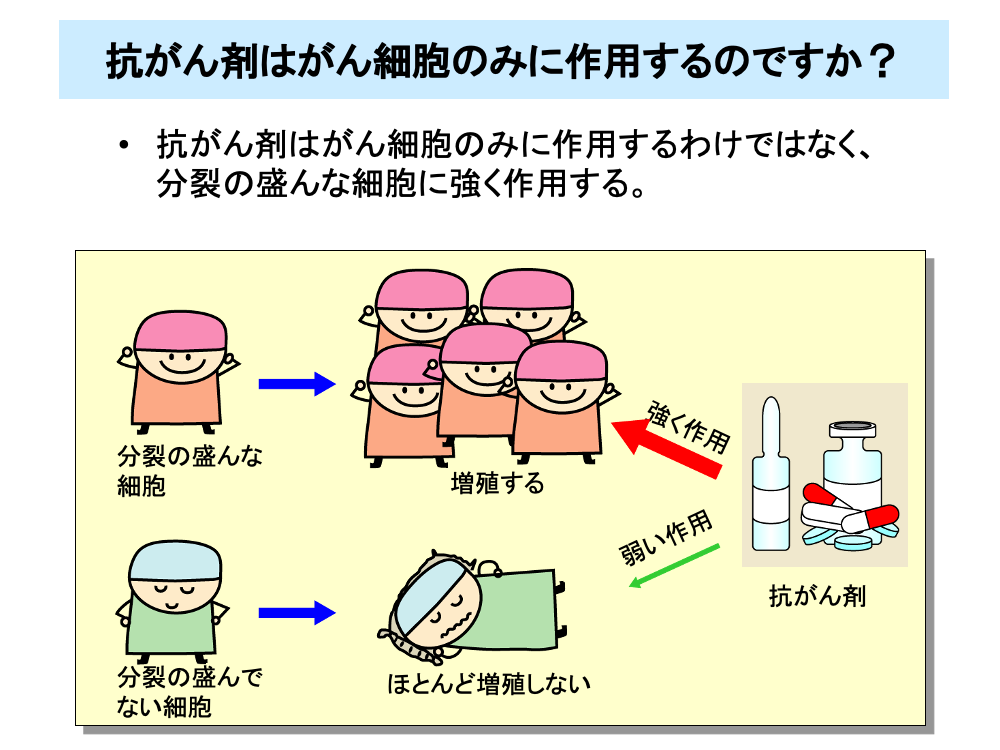
現在、使われている抗がん剤は、分裂・増殖の盛んな細胞に強く作用する薬剤です。
そのため、分裂・増殖の盛んながん細胞のみに作用するのではなく、分裂・増殖の盛んな正常細胞にも作用します。
分裂がほとんど起こらない細胞に対しては、抗がん剤はあまり作用しません。
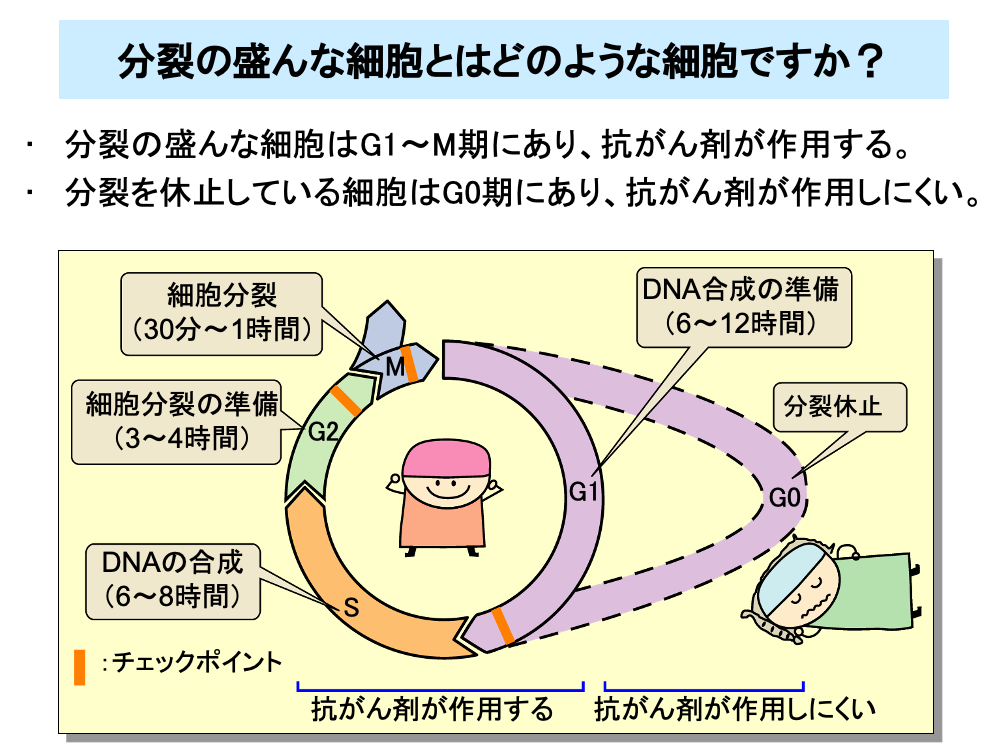
細胞はG1期、S期、G2期、M期という4つの期を経て分裂が行われます。これらの4つの期をcell cycle(セル・サイクル)と呼んでいます。
G1期はDNA合成の準備を行う期間です。この期の後半ではチェックポイント機構が働き、DNA合成のためのタンパクがうまく合成されているかどうかなどがチェックされます。これらが整っていない場合は細胞がアポトーシスを起こして死んでしまいます。
S期はDNAを合成する期です。
G2期は細胞分裂の準備を行う期です。この期にもチェックポイントがあり、DNAの複製がきちんと行われているかどうかなどが調べられます。DNAの合成がうまくいっていなかった場合は、細胞がアポトーシスを起こします。
M期は細胞分裂が行われる期です。この期のチェックポイントでは、分裂に使われる紡錘体がうまくできているかなどがチェックされ、これらがうまくできていない細胞はアポトーシスにより死滅します。
これらの4つの期のうち、非常に長いG1期を持つ細胞があります。この非常に長いG1期はG0期と呼ばれていて、G0期にある細胞は分裂休止状態にあり、ほとんど増殖しません。
抗がん剤は一般に、cell cycleに入っている細胞が多い(分裂の盛んな)組織には作用するものの、G0期の細胞が多い組織には作用しません。白血病細胞などでは大部分の細胞がcell cycleに入っているのに対し、固形がんではG0期の細胞の割合が白血病細胞などより多くなっています。

抗がん剤は分裂の盛んな腫瘍組織だけでなく、骨髄や消化管の粘膜など分裂の盛んな正常組織にも作用します。
腫瘍組織など分裂の盛んな組織ではcell cycleに入っている細胞が多いため抗がん剤が作用します。一方、分裂の盛んでない通常の正常組織はG0期の細胞が多いため抗がん剤がほとんど作用しません。
しかしながら、骨髄や消化管粘膜、あるいは皮膚、卵巣・精巣、リンパ組織といった細胞分裂の盛んな正常組織は、G0期の細胞がそれほど多くないため腫瘍組織と同様に抗がん剤が作用します。
すなわち、これらの臓器は抗がん剤の副作用が発現しやすい臓器といえます。
骨髄への副作用としては白血球減少、血小板減少、赤血球減少(貧血)などの骨髄抑制が、消化管粘膜への副作用としては口内炎、悪心・嘔吐、下痢などが、皮膚への副作用としては脱毛や皮疹、皮膚炎、手足皮膚反応などがあります。このほか卵巣・精巣への副作用として、不妊やホルモン環境の変化が起こります。また、抗がん剤はリンパ組織のリンパ球に作用してその働きを抑えるため免疫機能低下が起こります。

抗がん剤は一般的に、他の薬剤と異なり、副作用を最小限に抑えるため休薬期間を設けて投与されます。この投薬と休薬の組み合わせをコースと呼んだり、ドイツ語でクールと呼んだりします。最近ではサイクルという呼び方もされています。
抗がん剤は、通常、コース単位に繰り返して治療が進められます。
各コースの投薬では、がん細胞だけでなく骨髄など正常組織の細胞も死にますが、正常組織ではG0期の細胞が多いため、腫瘍組織よりも死滅する細胞の数が少なくて済みます。また、適当な期間、休薬することによりG0期にある細胞がcell cycleに入って増殖し、元の状態に戻します。すなわち、正常細胞が元の数に戻るまでの期間を休薬期間として設定することにより、副作用は最小限に抑えられます。
一方、休薬している間に生き残ったがん細胞のいくつかが増殖します。この増殖によってがん細胞が元の数に戻る前に次のコースの投薬を行うと、がん細胞の数は減少し、腫瘍が縮小してゆきます。このように投薬と休薬をうまく組み合わせることにより、少ない副作用で高い効果が得られます。
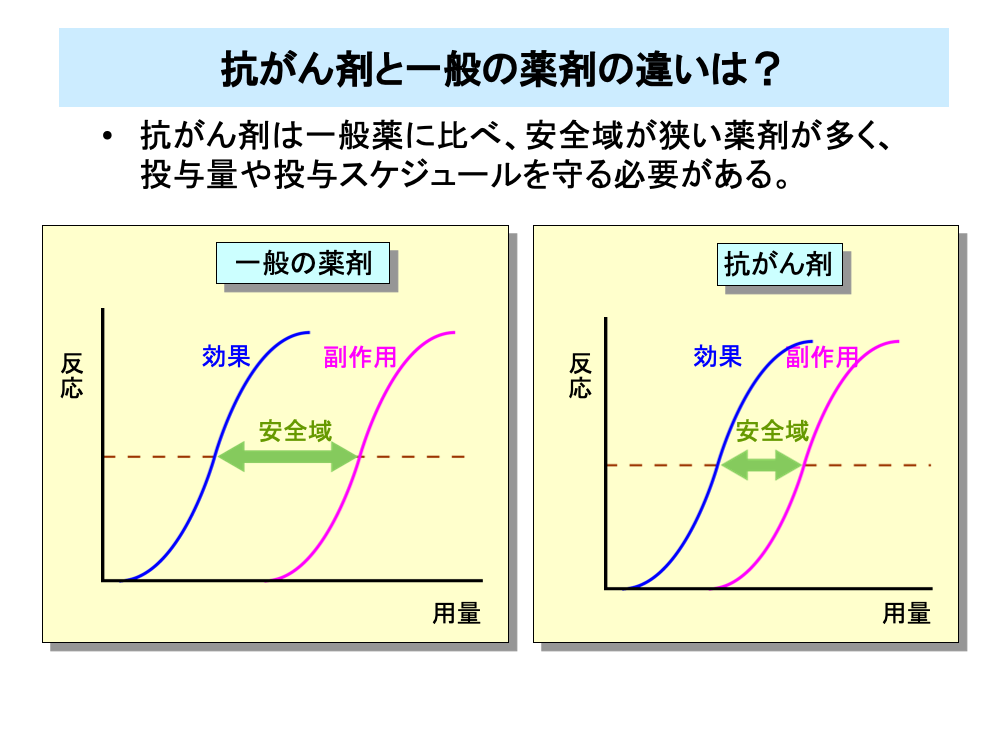
一般の薬剤と比べ、抗がん剤では効果が現れる用量と副作用が現れる用量が接近しており、安全域が狭くなっています。
これは、抗がん剤ががん細胞だけでなく、増殖の盛んな正常組織の細胞にも作用するためです。
そのため、抗がん剤では投与量や投与スケジュールを厳密に守る必要があります。
抗がん剤の投与量は一般の薬剤と異なり体重あたりの量(/kg)や、体表面積あたりの量(/㎡)で表されます。
投与スケジュールは各コースの何日目に投薬を行い、何日間(あるいは何週間)休薬を行うかが決められています。
なお、ここまで述べてきた抗がん剤の作用などの話は、次の章で述べる殺細胞性抗がん剤と呼ばれる種類の抗がん剤にあてはまるもので、分子標的薬やホルモン剤、免疫賦活剤には必ずしもあてはまりません。

抗がん剤の分類の仕方はさまざまで、一般的にはアルキル化剤、白金製剤、抗がん性抗生物質、代謝拮抗剤、植物由来製剤という殺細胞性抗がん剤および分子標的薬、ホルモン剤、免疫賦活剤、その他の製剤に分けられます。
このうち、殺細胞性抗がん剤はDNAやRNA、あるいは紡錐体をターゲットとして抗腫瘍効果を発揮します。
アルキル化剤や白金製剤は主にDNA鎖への架橋により効果を表します。
抗がん性抗生物質はDNAやRNAの合成を阻害して効果を表します。
代謝拮抗剤は主にDNAやRNAの原料の合成を阻害して効果を表します。
植物由来製剤のうち、微小管作用抗がん剤は紡錐体の合成や再構築を阻害して効果を表しますが、トポイソメラーゼ阻害剤はトポイソメラーゼという酵素の働きを止めることにより効果を表します。
分子標的薬は、正常細胞に比べ腫瘍細胞に高発現している細胞表面の分子や細胞内の増殖シグナル伝達路のさまざまな分子、あるいは腫瘍細胞内の遺伝子異常により生じた蛋白質分子をターゲットとして、細胞増殖シグナルの伝達を止めたり、腫瘍細胞への栄養の供給となる血管新生を阻害することにより効果を表します。
ホルモン剤は乳がんや前立腺がんなどホルモンにより増殖するがんに用いられ、ホルモンの働きを抑えることにより効果を表します。
免疫賦活剤はバイオロジカル・レスポンス・モディファイアー(Biological Response Modifier:BRM)と呼ばれ、がん細胞には直接作用せず免疫力を高めることにより効果を表す薬剤です。
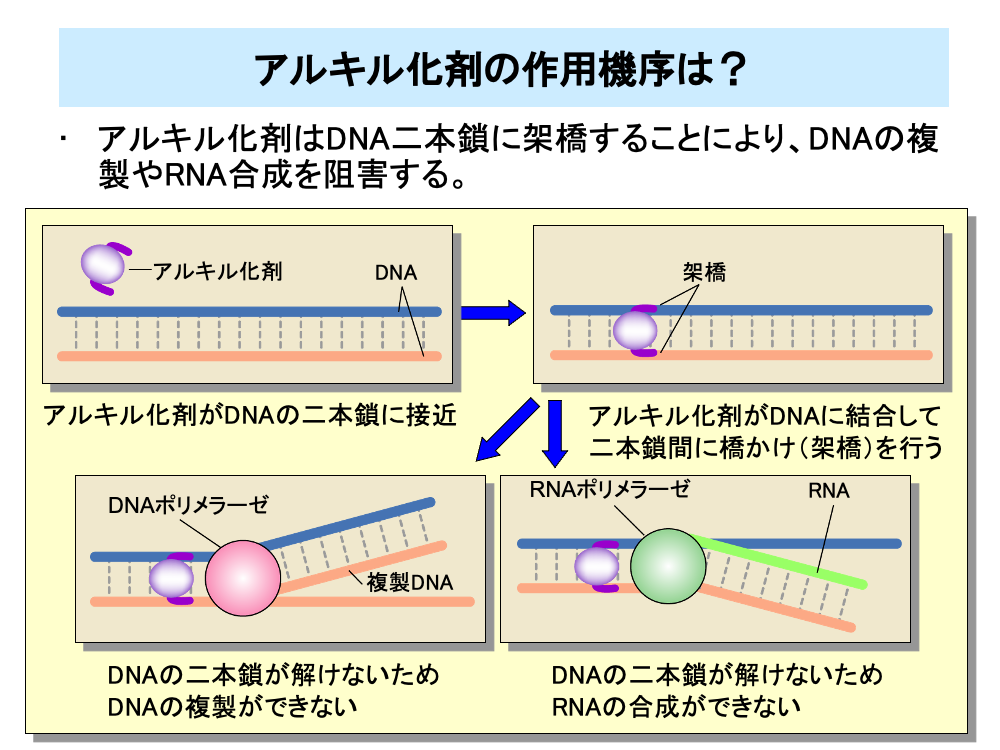
アルキル化剤は、DNAの二本鎖に結合して橋かけ構造をつくります。このことをDNA架橋と呼んでいます。
架橋されたDNAは二本鎖が解けなくなり、DNAポリメラーゼがDNA鎖を複製することを妨げたり、RNAポリメラーゼⅡがメッセンジャーRNAを合成することを妨げます。これらのことにより細胞は増殖できなくなります。

アルキル化剤のうちマスタード薬は、もともと毒ガスの研究から開発されたものです。アルキル化剤にはそのほかにヒドラジン薬と呼ばれる薬剤など多くのものがあります。
アルキル化剤は各種の固形がんや血液がんに用いられますが、副作用としては白血球減少などの骨髄抑制や悪心・嘔吐といった消化器障害が見られます。
このうち、シクロホスファミドは、乳がんに対して他の抗がん剤との併用で用いられるほか、肺がん、急性白血病、悪性リンパ腫、喉頭がん、子宮頸がん、子宮体がん、卵巣がんなどに対しても、他の抗がん剤と併用で使われています。また、注射剤だけでなく、経口剤も用いられています。
イホスファミドは、肺小細胞がんのほか前立腺がんや子宮頸がん、卵巣がん、骨肉腫などにも用いられています。
メルファランは、錠剤では多発性骨髄腫の効能のみが認められているのに対し、注射剤では白血病、悪性リンパ腫、多発性骨髄腫などの効能が認められています。
ダカルバジンは骨髄抑制は軽度ですが、悪心・嘔吐など消化器症状に注意する必要があります。
テモゾロミドはカプセル剤ですが、骨髄抑制が用量規制因子(DLT)となっています。
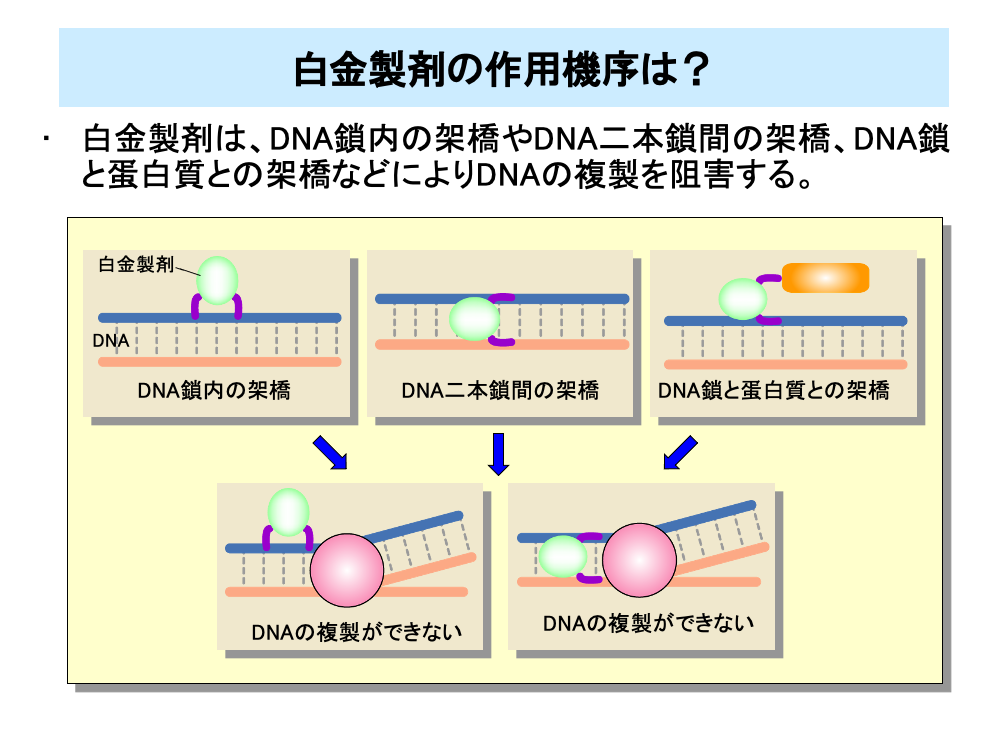
白金製剤は、DNAの鎖のどちらか一方に架橋したり(DNA鎖内架橋)、DNA二本鎖に架橋する(DNA鎖間架橋)、あるいはDNA鎖と蛋白質の間に架橋を行うなどさまざまな作用が知られています。
これらの作用により白金製剤はDNA鎖の複製を妨げ、細胞の増殖を阻害しますが、これにはDNA鎖内架橋およびDNA鎖間架橋ないしはそのいずれかが重要と考えられています。
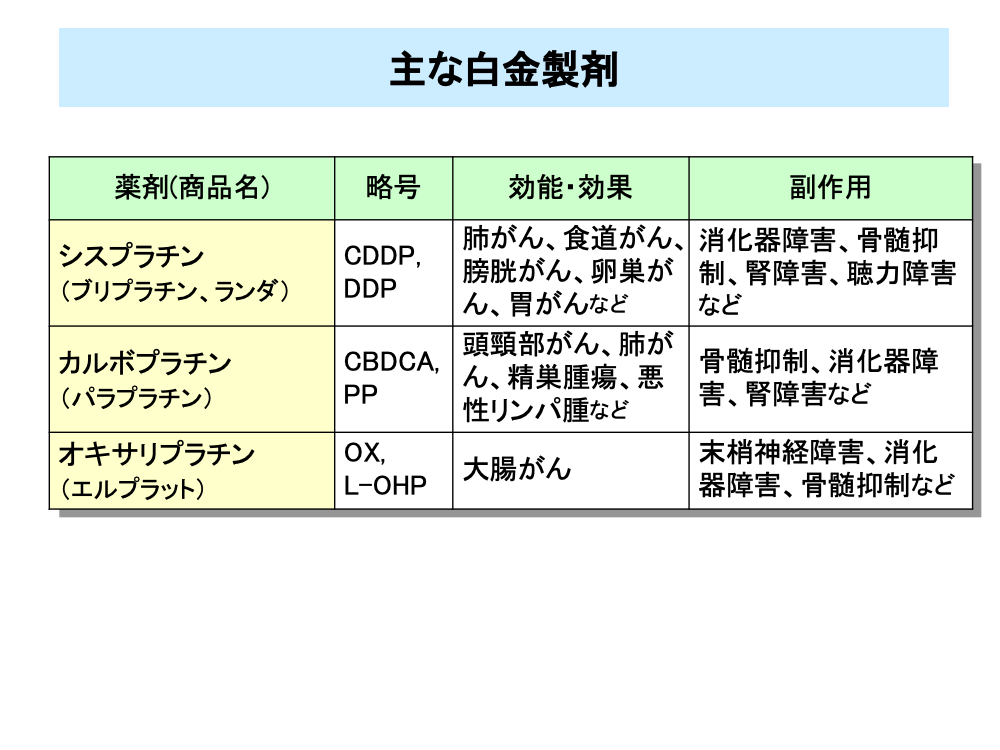
白金製剤は、電流を流した際に大腸菌がどのように遊走するかを調べる実験をする際に、塩化アンモニウムを含む溶液を培地にして白金電極を用いて電気を流すと大腸菌の増殖が止まることをヒントにして開発されたものです。白金製剤に分類される主な薬剤には、シスプラチンやカルボプラチンなどがあります。
白金製剤で最も広く使われているのはシスプラチンで、肺がんをはじめ多くのがんに用いられ、食道がんや頭頸部がんなど扁平上皮がんなどに高い効果を示します。また、精巣がんなどの泌尿器系のがんのほか、子宮頸がんなど婦人科がんにも有用性の高い薬剤です。しかしながら、腎毒性が強い、聴力障害を起こす、嘔気・嘔吐が強い、といった副作用があります。
シスプラチンの誘導体はいくつか開発が行われ、カルボプラチンはそのひとつです。カルボプラチンも頭頸部がんや肺がんのほか精巣腫瘍、卵巣がん、子宮頸がんに有効で、悪性リンパ腫にも用いられます。カルボプラチンの腎毒性はシスプラチンより軽いものの、血小板減少の頻度が高くなっています。カルボプラチンの投与量は通常の抗がん剤とは異なり、AUC(area under the concentration curve)により表記されています。
オキサリプラチンは日本で開発された薬剤ですが、臨床評価されたのはフランスで、日本に逆輸入されたものです。オキサリプラチンは他の白金製剤と異なった構造を有しているため、大腸がんに有効性が高い、腎毒性が少なく末梢神経毒性が多い、といった特徴を有しています。ただし、単剤では大腸がんに対して有効性があまり高くないため、多剤併用療法の一員として用いられています。
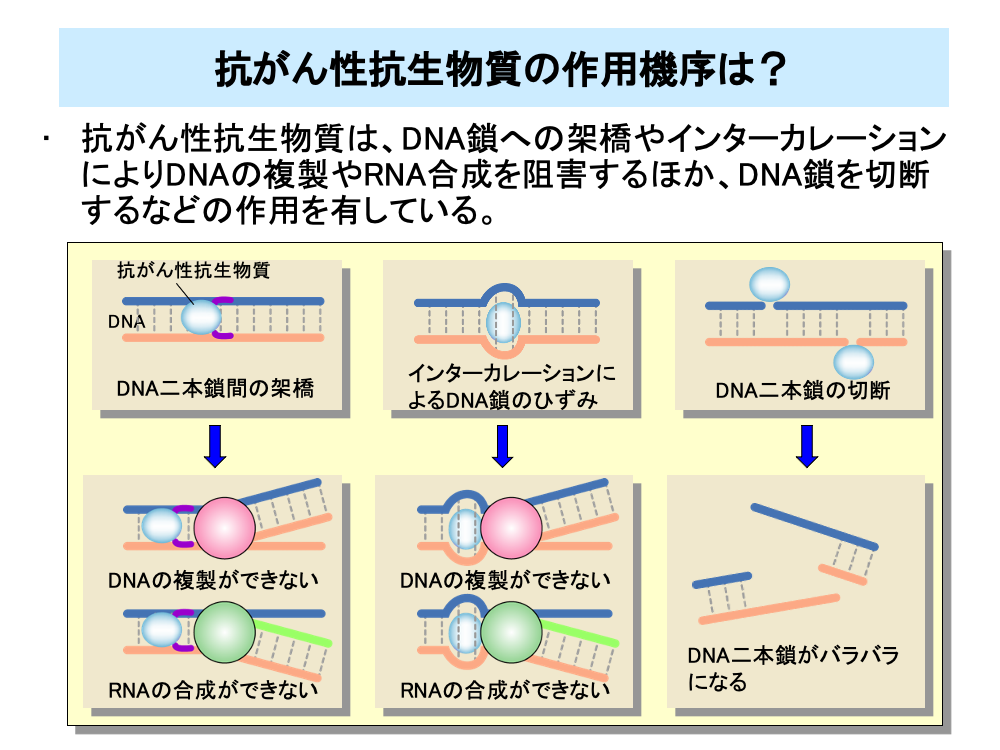
抗がん性抗生物質は、DNA鎖への架橋やDNA鎖切断のほかDNA二本鎖の塩基対の間に入り込むなどさまざまな作用を有しています。
DNA二本鎖への架橋は、アルキル化剤と同様、DNAポリメラーゼやRNAポリメラーゼⅡの作用を妨げることにより、DNA複製やRNA合成を阻害します。
ドキソルビシンなどのアントラサイクリン系と呼ばれる抗がん性抗生物質は、DNA二本鎖の塩基対の間に入り込みます。このことはインターカレーションと呼ばれますが、インターカレーションはDNA二本鎖にひずみをもたらします。このひずみのため、DNAポリメラーゼやRNAポリメラーゼⅡの作用が妨げられ、DNA複製やRNA合成が阻害されます。
このほか、ブレオマイシンなどの抗がん性抗生物質はDNA鎖を切断します。DNA鎖の切断が2ヵ所に起こるとDNA二本鎖がバラバラになり、細胞が死滅します。
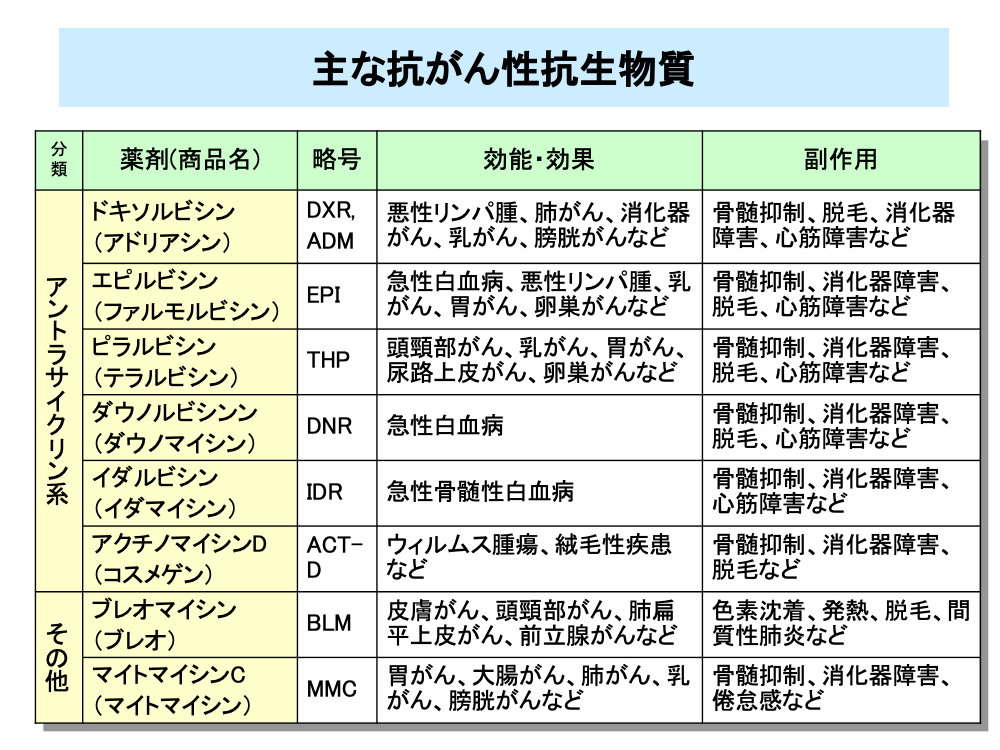
抗がん性抗生物質には、多くの薬剤がありますがメインはアントラサイクリン系と呼ばれるものです。アントラサイクリン系の薬剤は、トポイソメラーゼという酵素を阻害する作用を有するため、トポイソメラーゼ阻害剤に分類されることもあります。
抗がん性抗生物質は各種固形がんのほか血液のがんに用いられています。副作用としては骨髄抑制や消化器障害があります。アントラサイクリン系の薬剤では脱毛が多く発生します。また、心筋障害などの心毒性もアントラサイクリン系の薬剤の特徴的な副作用です。
ドキソルビシンとエピルビシンは、シクロホスファミドとの併用で乳がんによく用いられていますが、総投与量が増えると心筋障害の出現頻度が増加するため、総投与量に規制があります。また、脱毛も他の抗がん剤より高頻度に起こります。ドキソルビシンは海外の商品名であるアドリアマイシンの名称で一般的に呼ばれています。
ピラルビシンは、尿路上皮がんである膀胱がんの膀胱内注入などに用いられます。ダウノルビシンンとイダルビシンは、白血病に用いられています。アクチノマイシンDはメトトレキサートとともに絨毛上皮腫(絨毛性疾患の一つ)に用いられています。
ブレオマイシンとマイトマイシンCは、わが国で開発された薬剤です。ブレオマイシンは扁平上皮がんに有効性が高く、また、海外では精巣腫瘍に用いられています。ブレオマイシンの特徴的な副作用としては間質性肺炎が挙げられます。マイトマイシンCは、以前は胃がんなどに広く用いられていましたが、最近では用いられなくなってきています。
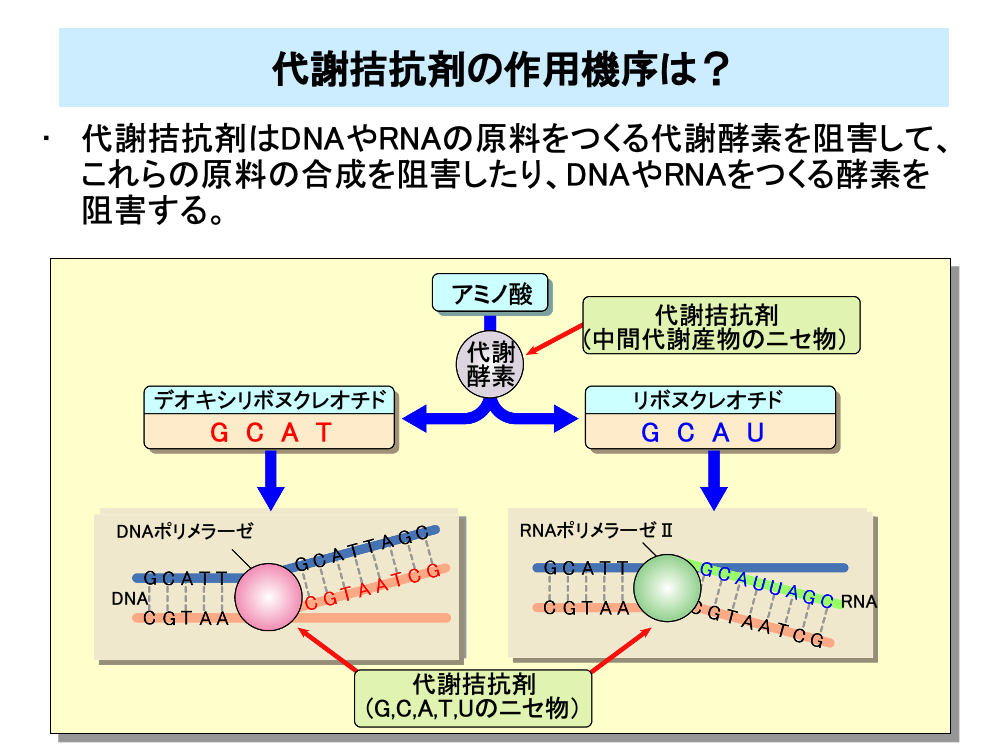
DNAの合成には原料として4種類のデオキシリボヌクレオチドが必要となります。
また、RNAの合成にも、やはり4種類のリボヌクレオチドが必要となります。
これらのデオキシリボヌクレオチドやリボヌクレオチドは、複雑な代謝過程を経てアミノ酸からつくられます。この代謝過程にはさまざまな代謝酵素が関与しており、代謝拮抗剤はこれらの代謝酵素を阻害することにより、DNAやRNAの原料の合成を止めます。これは代謝拮抗剤の多くは中途の代謝産物と似た構造をしているため、代謝酵素が正常代謝物と間違えて取り込み、正常な代謝が行われなくなるためです。
また、デオキシリボヌクレオチドやリボヌクレオチドと似た構造を持つ代謝拮抗剤はDNA合成酵素であるDNAポリメラーゼやRNA合成酵素であるRNAポリメラーゼⅡに作用して、DNAやRNAの合成を阻害するほか、DNAやRNAに取り込まれて異常なDNAあるいは異常なRNAをつくり出し、細胞増殖を止めたり細胞の機能を止めたりします。

代謝拮抗剤はフッ化ピリミジン系、シトシン系、プリン系、葉酸系、その他に分けられます。
日本で最も良く使われているのはフッ化ピリミジン系の抗がん剤で、フルオロウラシル、テガフール・ウラシル、テガフール・ギメラシル・オテラシル、カペシタビンなどがあります。
フルオロウラシルは、適応疾患が最も多い抗がん剤の1つで、主に腺がんに有効性を示します。一般的な副作用としては、骨髄抑制のほか食欲不振などの消化器症状、全身倦怠感などがあり、重い副作用としては、激しい下痢や出血性腸炎があります。フルオロウラシルは注射剤のほか、経口剤や坐剤、軟膏が開発されています。
一方、フルオロウラシルには、体内で分解されやすく、効果の持続時間が短いといった面があります。それを改善することを目的に開発されたのが、テガフールやカペシタビンなどのフルオロウラシル誘導体の経口剤で、テガフールはウラシルやギメラシル・オテラシルを配合した製剤であるUFT、S-1(エスワン)としてわが国では用いられています。一方、日本で開発されたカペシタビンは、海外でよく用いられています。
テガフール・ウラシルとテガフール・ギメラシル・オテラシルは、消化器がんをはじめとする固形がんに幅広く用いられていますが、テガフール・ウラシルは他の抗がん剤に比べ、副作用が軽微な薬剤の一つです。
カペシタビンは、大腸がんや乳がんに用いられていますが、特徴的な副作用として手のひらや足の裏に色素沈着などを起こす手足症候群が知られています。
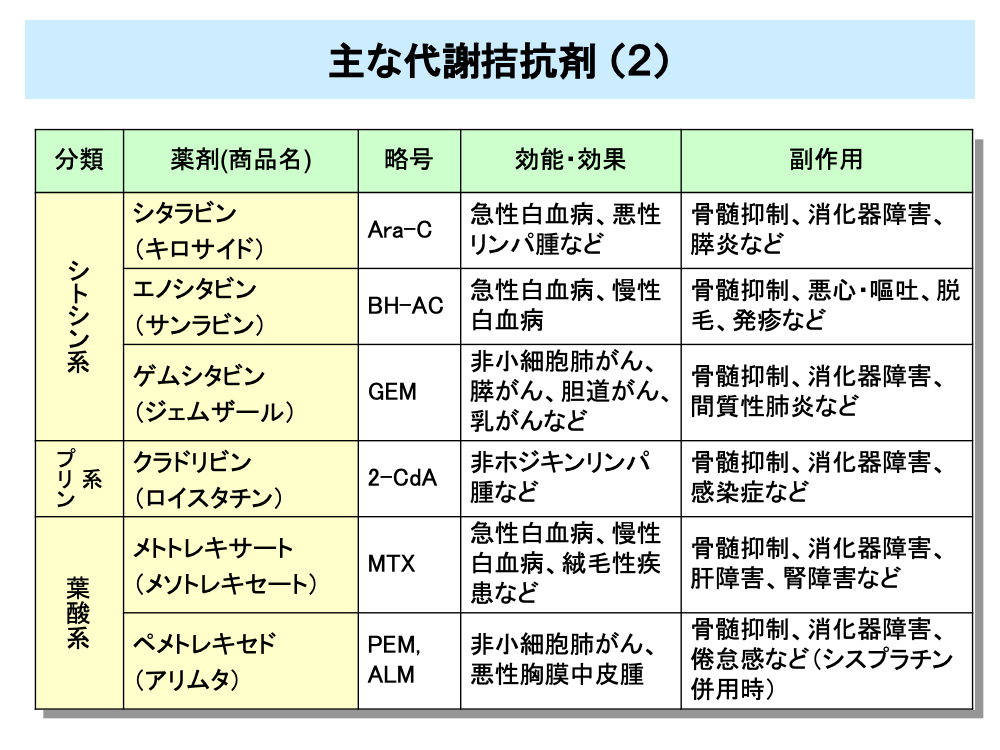
シトシン系の薬剤としてはシタラビン、エノシタビンやゲムシタビンがあります。
シタラビンは、急性白血病などの治療に用いられるほか、消化器がんなどに対して、他の薬剤との併用で用いられることもあります。エノシタビンは、日本で開発された薬剤で急性白血病などの治療に用いられます。
ゲムシタビンは、1990年代に開発された第三世代抗がん剤と呼ばれる薬剤の一つで、膵がんや胆道がんにおける標準的な薬剤として用いられています。
シトシン系の薬剤の副作用としては、骨髄抑制や消化器症状が挙げられます。
プリン系の薬剤であるクラドリビンは、ヘアリーセル白血病と呼ばれる白血病に高い効果を示すほか、悪性リンパ腫にも用いられます。クラドリビンも骨髄抑制や消化器障害が副作用として現れます。
葉酸系の代謝拮抗剤にはメトトレキサートやペメトレキセドがあります。
メトトレキサートは古い薬剤の一つで、がん治療のみならず関節リウマチの治療にも用いられています。メトトレキサートは、血液がんに用いられるほか、絨毛がんなどの絨毛性疾患に対し、アクチノマイシンDとともに標準的な薬剤として用いられています。また、他の抗がん剤との併用で、乳がんに対するCMF療法や膀胱がんに対するM-VAC療法の一員として用いられています。なお、メトトレキサートを大量に投与するときは、毒性軽減を目的にホリナート(商品名:ロイコボリン)の投与が行われます。
ペメトレキセドは新しい薬剤の一つで、複数の葉酸代謝酵素を同時に阻害する特徴を有しています。ペメトレキセドは非小細胞肺がんに対し、白金製剤との併用で用いられるほか、アスベスト吸引が原因となって引き起こされる、悪性胸膜中皮腫に対しても、シスプラチンとの併用で用いられています。
これらの薬剤はいずれも骨髄抑制や消化器障害が副作用として現れます。
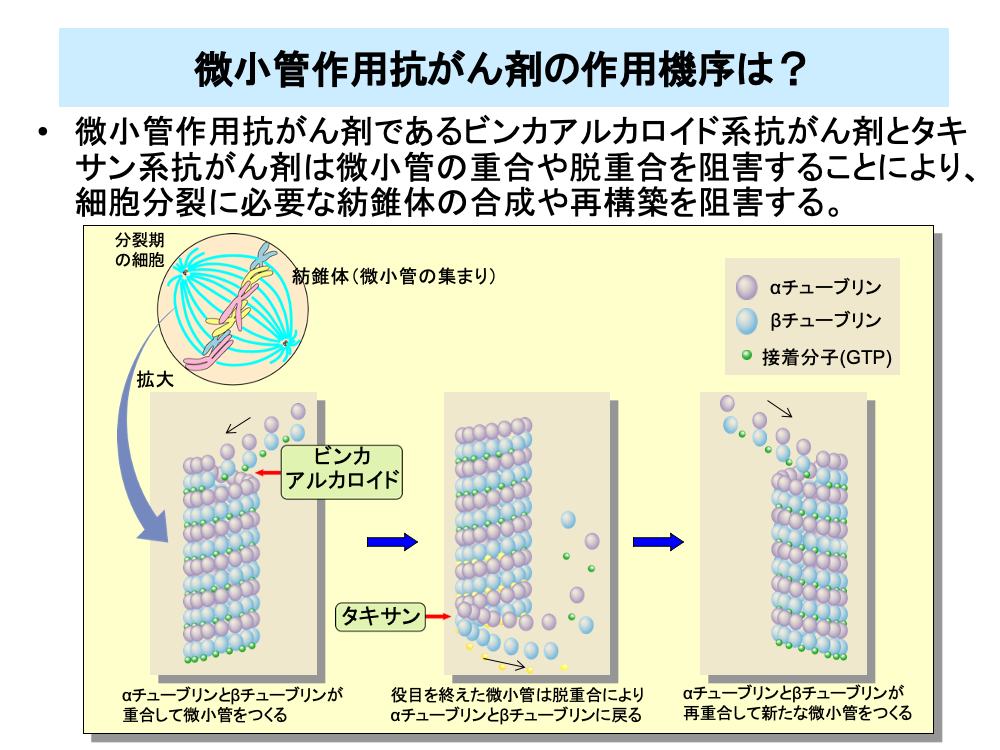
植物由来製剤のうち、微小管作用抗がん剤であるビンカアルカロイド系抗がん剤とタキサン系抗がん剤は、微小管の重合や脱重合を阻害することにより、細胞分裂に必要な紡錐体の合成や再構築を阻害します。
紡錐体は、微小管が集まったもので、微小管はαチューブリンという蛋白質とβチューブリンという蛋白質が集まる(重合する)ことによりつくられます。ビンカアルカロイド系抗がん剤はチューブリンが重合する過程を阻害し、微小管の合成を止めます。
細胞分裂が終わるなど紡錐体が不要となったときは、αチューブリンとβチューブリンの集合が解け(脱重合)、次の細胞分裂時にはこれらが再び重合して微小管を形成します。タキサン系抗がん剤はこの脱重合の過程を阻害することにより、微小管の再構築が行えなくなるようにします。
紡錘体の合成や再構築ができなくなったがん細胞は分裂することができなくなり、死滅します。
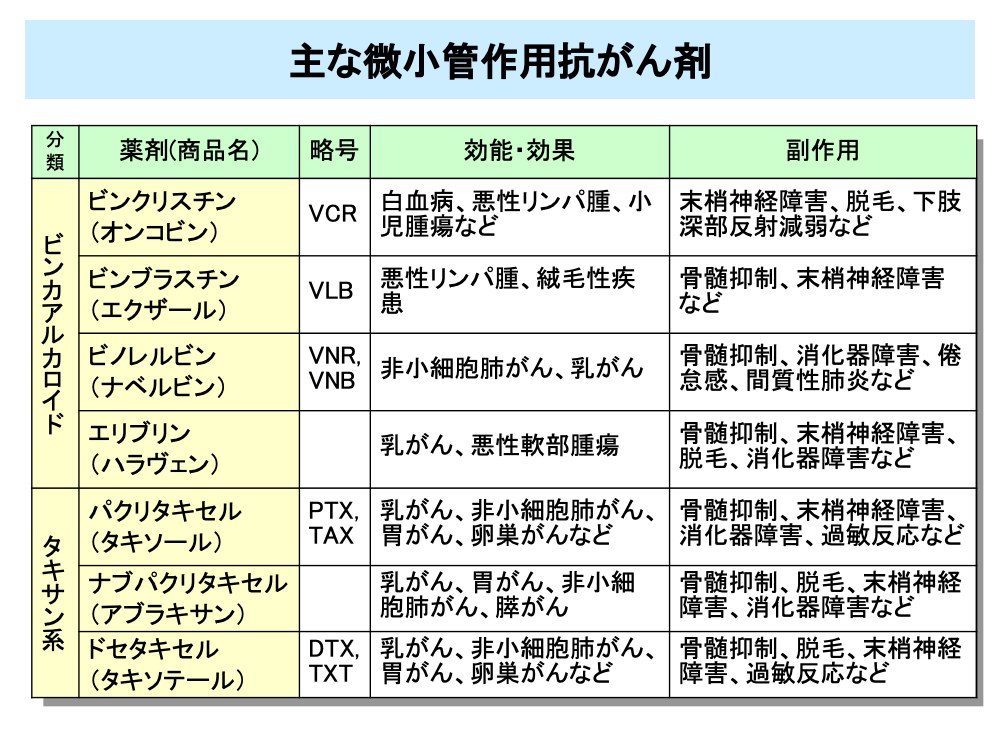
微小管作用抗がん剤は、ビンカアルカロイド系とタキサン系に分けられます。いずれも副作用として手足のしびれなど末梢神経障害が問題となります。
ビンカアルカロイドは比較的古い薬剤であるビンクリスチン、ビンブラスチンのほかビノレルビンなどがあります。
ビンクリスチンは、血液のがんのほか、他の薬剤との併用で多発性骨髄腫などに用いられており、骨髄抑制は少ないとされています。ビンブラスチンも、他剤との併用で、膀胱がんに用いられています。
ビノレルビンは、比較的最近の薬剤であり、非小細胞肺がんや手術不能・再発乳がんに有効な薬剤で、神経毒性は低いとされています。
微小管作用抗がん剤のうち、タキサン系の薬剤はビンカアルカロイドよりもよく使われており、パクリタキセルとドセタキセルが代表的な薬剤です。
パクリタキセルは、他の抗がん剤との併用療法で、さまざまながんに有用であるとされています。特に乳がんで有効性が認められており、術後の標準的な治療薬の1つとなっています。パクリタキセルの特異的な副作用としては、過敏反応(アナフィラキシーショック)があり、これを予防するため治療前に抗ヒスタミン剤やステロイドホルモンを前投与するなどの処置がとられています。
ナブパクリタキセルは、人血清アルブミンにパクリタキセルを結合させナノ粒子化した薬剤で、パクリタキセルと異なり抗ヒスタミン剤やステロイドホルモンの前投与が不要な薬剤です。パクリタキセルと同様に乳がんなどで用いられます。副作用もパクリタキセルと同様ですが、過敏反応は少なくなっています。
ドセタキセルは、パクリタキセルと同様、乳がんの術後の標準的な治療薬の1つです。副作用はパクリタキセルと同様ですが過敏反応はパクリタキセルより少なくなっています。
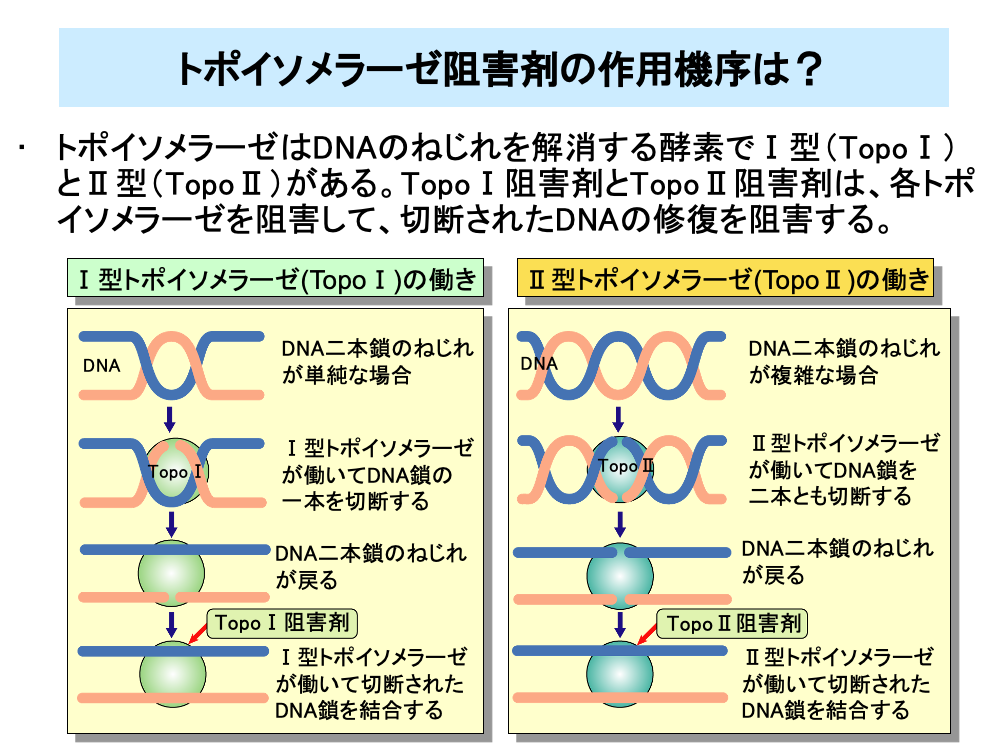
植物由来製剤のうちトポイソメラーゼ阻害剤は、DNAのねじれを解消する酵素であるトポイソメラーゼを阻害します。
DNAは複製を行う過程で二本鎖がほどける(開裂する)必要があり、このためねじれが生じる場合があります。
DNA鎖のねじれがそれほど複雑でない場合は、Ⅰ型トポイソメラーゼ(TopoⅠ、トポワン)が働いてDNA鎖の一本を切断し、DNAのねじれを解消します。ねじれ解消後にTopoⅠは切断されたDNA鎖をつなぎ直してDNAを修復します。イリノテカンなどのTopoⅠ阻害剤は、TopoⅠのDNA鎖をつなぎ直す過程を阻害して、DNA鎖が切断されたままにします。
一方、DNA鎖が複雑にねじれて、DNA鎖の一本を切断しただけではねじれが解消しないようなことも起こります。このような場合はⅡ型トポイソメラーゼ(TopoⅡ、トポツー)が働いてDNA鎖を二本とも切断し、DNAのねじれを解消します。その後、TopoⅡは切断されたDNA鎖を二本ともつなぎ直しDNAを元に戻します。エトポシドなどのTopoⅡ阻害剤は、TopoⅡのDNA二本鎖をつなぎ直す過程を阻害して、DNA鎖が切断されたままにします。
いずれの場合もDNA鎖が切断されたままの状態でいると、DNA鎖はバラバラになり、細胞が死滅します。
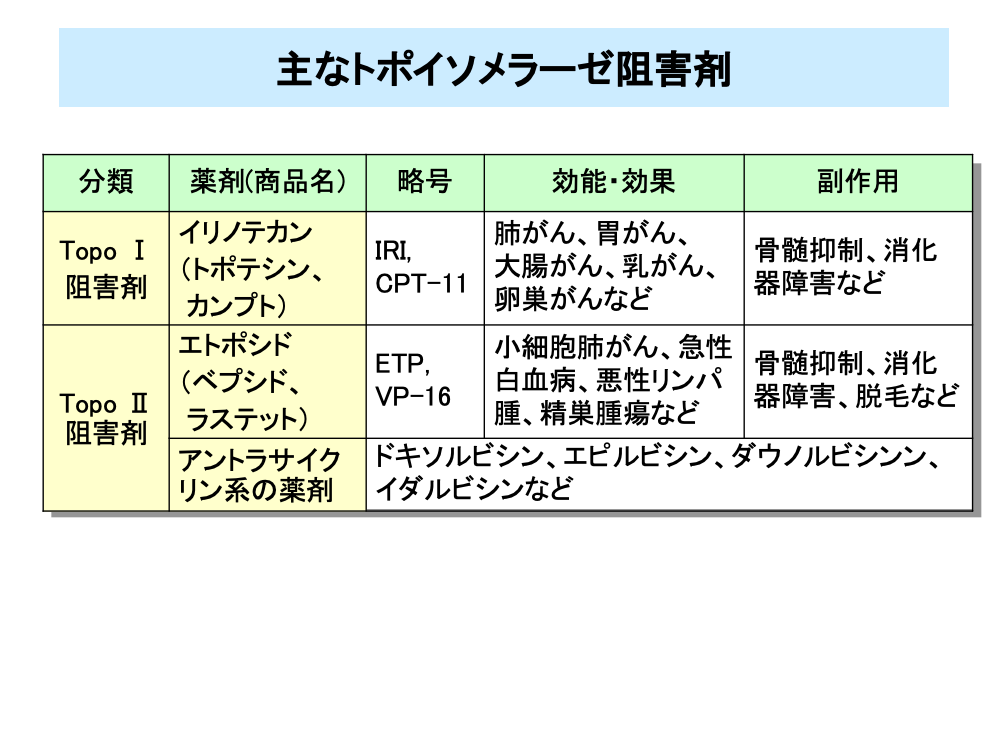
トポイソメラーゼ阻害剤には、Topo Ⅰ(トポワン)阻害剤とTopo Ⅱ(トポツー)阻害剤の2種類があります。
Topo Ⅰ阻害剤の代表的な薬剤はイリノテカンです。イリノテカンは、わが国で開発された薬剤で、世界中で使われています。幅広い効能を持ち、大腸がんや肺がんの併用療法において重要な役割を果たしています。副作用としては骨髄抑制と下痢などの消化器障害が知られており、投与時には下痢対策がなされています。
Topo Ⅱ阻害剤の代表的な薬剤には、エトポシドがあります。エトポシドは、小細胞肺がん、悪性リンパ腫、急性白血病などに用いられています。副作用としては骨髄抑制などが知られています。
抗がん性抗生物質のアントラサイクリン系の薬剤も、Topo Ⅱ阻害剤に分類されることがあります。

分子標的薬はモノクローナル抗体と低分子化合物に大別されます。両薬剤とも細胞増殖や細胞生存のシグナル伝達に関わる分子をターゲットとするものが多くを占めます。
モノクローナル抗体の多くは、がん細胞表面のEGFR、HER2(ハーツー)などの上皮成長因子受容体に結合して、その働きを止めたり、免疫系の助けによりがん細胞を死滅させます。そのほかCCR4などのがん細胞表面の受容体も標的となります。血液系のがんに対しては、がん細胞表面に発現するCD20、30、33、52などのCD抗原をターゲットとする薬剤も用いられます。
また、がん細胞以外も標的となります。血管新生に関わるVEGFR2に対するモノクローナル抗体は、血管新生を阻害することにより、がんの浸潤や転移を抑えます。そのほか、免疫系細胞表面の受容体やVEGFやRANKL(ランクル)などのリガンド*1もモノクローナル抗体の標的となっています。
低分子化合物は、がん細胞内における標的に結合してその働きを抑えます。
多くの低分子化合物は、増殖シグナル伝達系因子である蛋白質のキナーゼ活性部位と呼ばれる部位を阻害することにより、がんの増殖シグナル伝達を止めます。このうち、EGFR、MEK、Bcr-Abl(ビーシーアールエイブル)、ALK、JAK(ジャック)などはシグナル伝達にチロシンキナーゼ活性部位が関与しており、BRAF(ビーラフ)はセリン・スレオニンチロシンキナーゼ活性部位が関与しています。また、生存シグナル伝達系因子の一員であるmTOR(エムトール)もセリン・スレオニンチロシンキナーゼ活性部位がシグナル伝達に関わっており、この活性部位を阻害することによりがん細胞のアポトーシスが誘導されます。
多くの低分子化合物は、1つか2つのプロテインキナーゼ活性部位を阻害しますが、3つ以上の標的を持つ薬剤もあり、これらはマルチキナーゼ阻害剤と呼ばれています。
このほかに、不要となった蛋白質を分解する細胞内小器官であるプロテアソームをターゲットとする薬剤も用いられています。増殖シグナル伝達系の蛋白質の中には刺激を受けるとプロテアソームにより活性化されて、細胞増殖にかかわる遺伝子の読み出しを行うものもあります。プロテアソーム阻害剤はこのような働きを抑えます。
これらの低分子化合物は遺伝子の異常に起因する遺伝子産物の異常を標的としていますが、最近ではDNMTやHDAC(エイチダック)など遺伝子発現調節にかかわる因子を標的とする薬剤であるエピジェネティクな薬剤(エピジェネティク薬)も認可されています。
*1:特定の受容体などに結合する性質を持つ物質をいう。
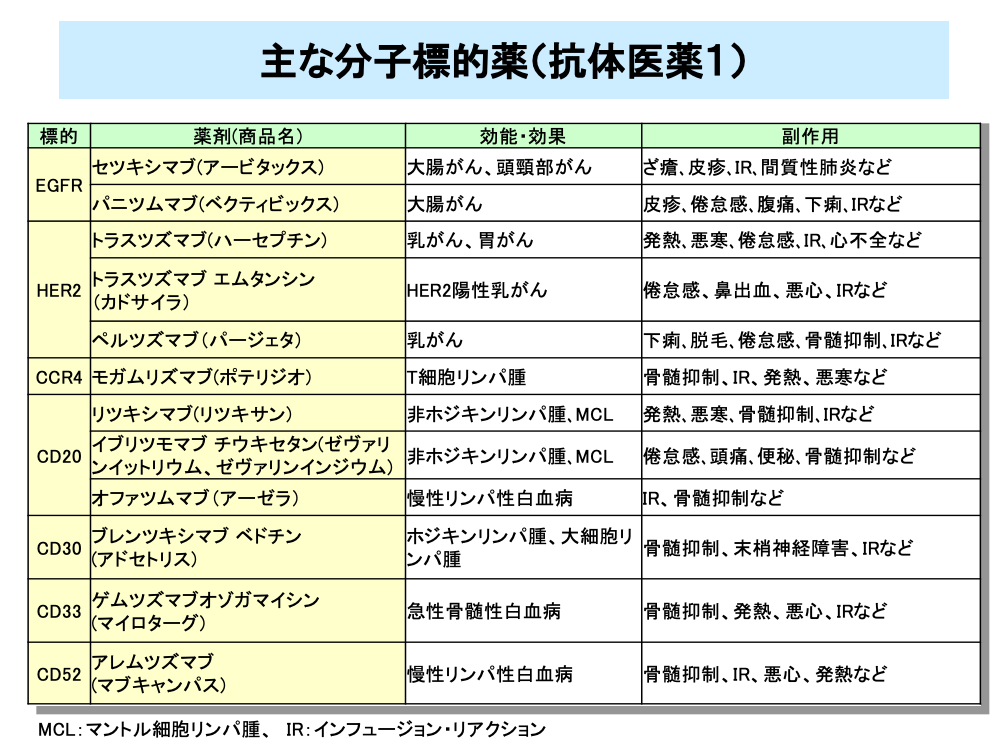
モノクローナル抗体の分子標的薬は、マウス抗体(薬剤名の語尾が~omab)、キメラ抗体(~ximab)、ヒト化抗体(~zumab)、ヒト抗体(~mumab)に分類されます。
セツキシマブ、パニツムマブは大腸がんなどの細胞表面に発現している上皮増殖因子受容体(EGFR)をターゲットとしてがん細胞を攻撃します。副作用としては皮疹や下痢などがあります。
トラスツズマブ、トラスツズマブ エムタンシン、ペルツズマブは乳がんなどの細胞表面など発現している2型の上皮増殖因子受容体であるHER2に結合してがん細胞を攻撃します。トラスツズマブは心不全の副作用があるため、アントラサイクリン系薬剤との併用には注意が必要です。
モガムリズマブは、Tリンパ球系のがんに発現するCCR4と呼ばれる受容体をターゲットとしています。副作用としては骨髄抑制があります。
また、血液系がん細胞の表面にはCDと呼ばれる各種の抗原が発現します。これらのCD抗原に対し、リツキシマブ、イブリツモマブ チウキセタン、オファツムマブはCD20に、ブレンツキシマブ ベドチンはCD30に、ゲムツズマブオゾガマイシンはCD33に、モガムリズマブはCCR4にそれぞれ結合して、がん細胞を直接攻撃するとともに、免疫系による作用を増強します。これらの薬剤では骨髄抑制が副作用として発現します。
モノクローナル抗体の分子標的薬に共通する副作用として、静注時に発熱、悪寒、悪心・嘔吐、発疹などのアレルギー症状が発現するインフュージョン・リアクション(infusion reaction)があります。インフュージョン・リアクションは初回投与時に起こりやすいため、初回投与時には投与速度を半減するなどの注意がはらわれています。

イピリムマブのターゲットはがん細胞ではなく、細胞傷害性Tリンパ球に発現している抗原-4(CTLA-4)です。細胞傷害性Tリンパ球のCTLA-4は抗原提示細胞のCD80などと結合すると抑制的調節が生じ、がん細胞に対する攻撃が抑制されます。イピリムマブはCTLA-4とCD80などとの結合を遮断して、細胞傷害性Tリンパ球のがん細胞に対する細胞傷害活性を高めます。イピリムマブの副作用としては発疹などですが、過度の免疫反応による副作用の発現に注意が必要です。
がん細胞は細胞表面にPD-L1と呼ばれるリガンドを発現して細胞傷害性Tリンパ球のPD-1と結合することにより、抑制的調節機構を働かせて細胞傷害性Tリンパ球の攻撃を逃れます。ニボルマブ、ペムブロリズマブはPD-1受容体を、またアベルマブ、アテゾリズマブはPD-L1受容体を標的としています。これらの阻害により、細胞傷害性Tリンパ球を働かせ、がん細胞を攻撃するのです。主な副作用としてそう痒のほか間質性肺炎や甲状腺機能障害などがあります。
ラムシルマブのターゲットは、がん細胞へ伸びてくる血管です。ラムシルマブは、血管を作るのに必要な血管内皮増殖因子の2型受容体(VEGF2)に結合して、がん細胞へ血管が伸びないようにします。その結果、がんに十分な栄養が供給されなくなり、がんが死滅します。ラムシルマブでは高血圧のほか腹痛などの副作用が出現します。
リガンドをターゲットとするモノクローナル抗体もあります。
ベバシズマブは、ラムシルマブと異なり受容体ではなくリガンドである血管内皮増殖因子(VEGF)に結合して、がん細胞へ血管が伸びないようにします。ベバシズマブは、各種の固形がんに対して幅広く用いられていますが、高血圧や胃腸出血といった特異的な副作用があります。
デノスマブは、破骨細胞の表面の受容体であるRANKに結合するリガンドであるRANKLを阻害して、骨吸収を抑制することにより各種がんの骨転移に効果を発揮します。副作用として低カルシウム血症などが出現します。
これらのモノクローナル抗体でもインフュージョン・リアクションが発現します。

低分子化合物の分子標的薬はERK-MAPK経路(細胞増殖シグナル伝達経路)や、PI3K-Akt経路(細胞生存シグナル伝達経路)のプロテインキナーゼ活性を阻害することで効果を現します。なかでもチロシンキナーゼ活性を阻害するチロシンキナーゼ阻害薬(tyrosine kinase inhibitor, TKI)は、多くのものが開発されています。TKIは薬剤名の語尾が~チニブ(~tinib)となります。
EGFRに対するTKIは、ゲフィチニブ、エルロチニブ、ラパチニブ、アファチニブ、オシメルチニブがあり、非小細胞肺がんなどに用いられています。これらの薬剤の副作用としては、下痢のほかニキビのような皮疹が発現します。
ERK-MAPK経路の制御に働くBRAF(ビーラフ)の遺伝子に変異が起こると、細胞増殖シグナルが制御できなくなります。ベムラフェニブとダブラフェニブはBRAFを標的とする薬剤で、BRAF遺伝子変異を起こしている悪性黒色腫に用いられています。ベムラフェニブでは関節痛や発疹などの副作用があります。MEKは、ERK-MAPK経路の一員で、トラメチニブはBRAFによるMEKの活性化とそのキナーゼ活性双方を選択的に阻害し、ダブラフェニブとの併用でBRAF遺伝子変異を起こしている悪性黒色腫に用いられます。併用時の副作用時は発熱、肝機能障害、末梢性浮腫などがあります。
慢性骨髄性白血病(CML)などで認められるフィラデルフィア染色体中の遺伝子変異の遺伝子産物であるBcr-Abl(ビーシーアールエイブル)蛋白質は、EGFRなどとは無関係にチロシンキナーゼが働き、細胞増殖シグナルを発生させます。Bcr-Ablのチロシンキナーゼ活性を阻害する薬剤には、ニロチニブ、イマチニブ、ダサチニブ、ボスチニブがあり、慢性骨髄性白血病に用いられています。副作用としては、骨髄抑制や悪心・嘔吐、下痢などがあります。これらのうちイマチニブは消化管間質腫瘍(GIST)に発現するc-kit(シーキット)の、ダサチニブもc-kitの、ボスチニブはSrc(サーク)のチロシンキナーゼ活性も阻害します。
ALK融合遺伝子産物も、チロシンキナーゼの働きにより細胞増殖シグナルを発生させます。クリゾチニブやアレクチニブは、チロシンキナーゼ活性を阻害することにより、非小細胞肺がんに効果を表します。副作用としては消化器症状や肝障害などがあります。
JAK-STAT(ジャックスタット)経路はサイトカイン調節の情報伝達を行っており、構成因子であるJAKのチロシンキナーゼ活性を阻害する薬剤であるルキソリチニブは、血液のがんである骨髄線維症などに用いられています。副作用としては骨髄抑制や感染症があります。
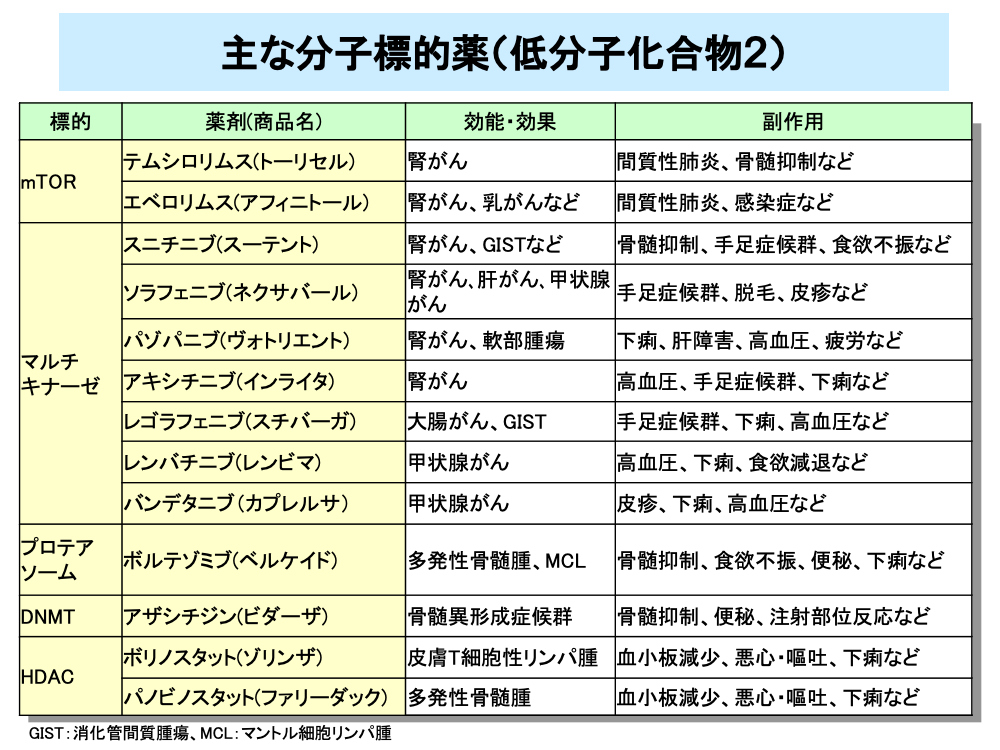
細胞生存シグナル伝達経路(PI3K-Akt経路)の一員であるmTORは、セリン・スレオニンキナーゼ活性を持つ蛋白質で、細胞の分裂や生存などの調節に中心的な役割を果たしています。テムシロリムスやエベロリムスは、mTORをターゲットとする薬剤で腎がんなどに用いられています。副作用としては間質性肺炎などがあります。
3つ以上のターゲットを持つ薬剤であるマルチキナーゼ阻害剤は腎がんなどに用いられ、副作用として高血圧や手足症候群が現れる薬剤が多くなっております。
スニチニブは、c-kitやVEGFR、PDGFR(血小板由来増殖因子受容体)などのプロテインキナーゼ活性を阻害して、イマチニブ抵抗性の消化管間質腫瘍や腎がんに効果を表しますが副作用として骨髄抑制や手足症候群などがあります。ソラフェニブは、c-kitやBRAF、CRAFなどのキナーゼ活性を標的とする薬剤で、腎がんや肝がんなどに用いられ、副作用には手足症候群、脱毛などがあります。パゾパニブは、c-kitやVEGFR、PDGFRなどのキナーゼ活性を阻害して、腎がんや軟部腫瘍に用いられ、副作用には下痢や肝障害などがあります。アキシチニブは、各種のVEGFRを阻害して腎がんに効果を表します。副作用は高血圧や手足症候群などです。
レゴラフェニブは、c-kitやBRAF、VEGFRなどを標的とする薬剤で、大腸がんや消化管間質腫瘍に用いられます。副作用には手足症候群や下痢などが挙げられます。
レンバチニブは、c-kitやVEGFR、PDGFRなどを阻害して、甲状腺がんに効果を表します。副作用としては高血圧や下痢などがあります。バンデタニブは、VEGFR-2、EGFRなどを阻害して、甲状腺がんに効果を表します。副作用には発疹などの皮膚症状や下痢、高血圧などがあります。
ボルテゾミブは、プロテアソームを阻害する薬剤で、多発性骨髄腫などに用いられます。副作用に骨髄抑制や食欲不振などの消化器症状があります。
アザシチジンは、DNAに取り込まれることによりDNAのメチル化を阻害して、がん抑制遺伝子発現を増加させてアポトーシスを誘導する薬剤で、骨髄異形成症候群に効果を表します。副作用には骨髄抑制や注射部位に紅斑、発疹、そう痒感、硬結などが起こります。
ボリノスタットとパノビノスタットは、ヒストン脱アセチル化酵素(HDAC)を阻害することによりクロマチン構造を弛緩させ、がん抑制遺伝子発現を増加させる薬剤です。ボリノスタットは、皮膚T細胞性リンパ腫に用いられ、副作用には血小板減少や消化器症状などがあります。パノビノスタットは、多発性骨髄腫に用いられ、副作用に血小板減少などの骨髄抑制や消化器症状などがあります。
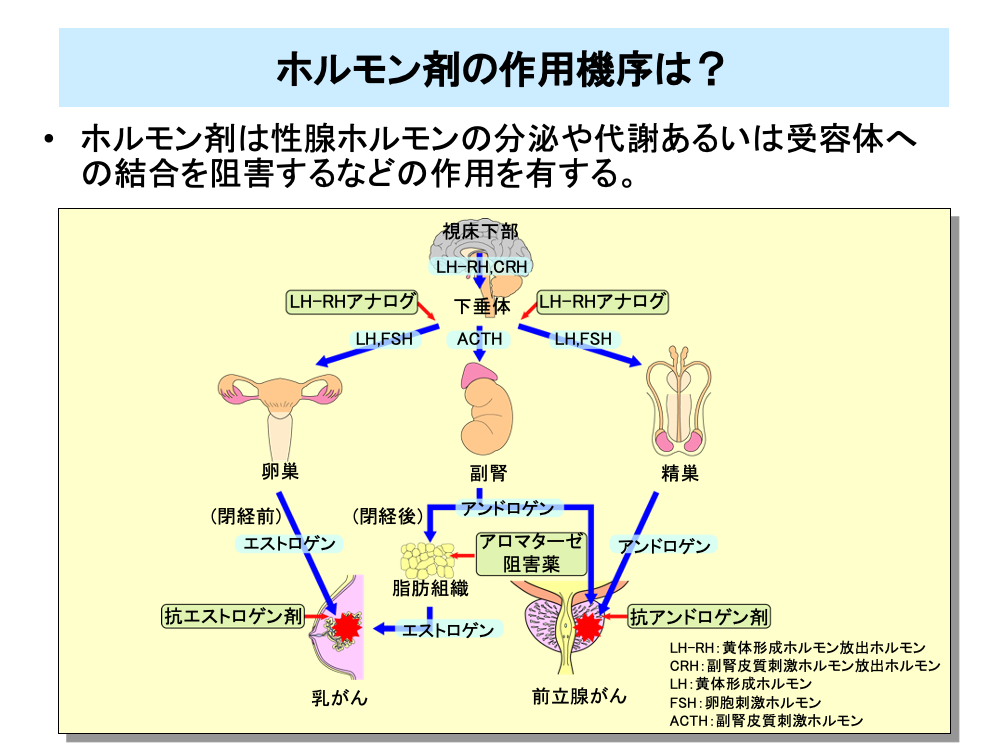
乳がんや前立腺がんなどに用いられるホルモン剤は、性腺ホルモンの分泌や代謝を阻害したり、性腺ホルモンががん細胞内の受容体に結合することを阻害することによりこれらのがんの増殖を止めます。
閉経前女性では視床下部からの黄体形成ホルモン放出ホルモン(LH-RH)の作用により下垂体から黄体形成ホルモン(LH)と卵胞刺激ホルモン(FSH)が放出され、これらは卵巣に働いてエストロゲンをつくらせます。エストロゲンが乳腺組織の上皮細胞のエストロゲン受容体(Estrogen Receptor、ER)と結合し、細胞増殖に関わる遺伝子を発現させ、細胞を増殖させます。
乳がん組織でERが大量発現している場合(ER(+)、イーアールプラスと表されます)、このようなメカニズムにより増殖していると考えられ、下垂体からのLHとFSHの放出を止めるLH-RHアナログや、エストロゲンのERへの結合を阻害する抗エストロゲン剤が用いられます。
閉経後は卵巣の機能が低下し、エストロゲンの産生は行われなくなりますが、副腎でつくられたアンドロゲンが脂肪組織のアロマターゼと呼ばれる酵素の働きでエストロゲンに代謝されます。閉経後の乳がん組織でER(+)の場合には、このようなメカニズムでつくられたエストロゲンの働きによりがんが増殖していると考えられ、抗エストロゲン剤のほかにアロマターゼ阻害薬を用いてエストロゲンの産生を抑えることが行われます。
男性の場合は、アンドロゲンがアンドロゲン受容体に結合することにより前立腺がんが増殖します。この場合、副腎ではなくほとんどはLH-RHにより下垂体から放出されたLHとFSHが、精巣に働くことにより作られたアンドロゲンががんを増殖させます。このため前立腺がんでは、下垂体からのLHとFSHの放出を止めるLH-RHアナログや、アンドロゲンの受容体への結合を阻害する抗アンドロゲン剤が用いられます。
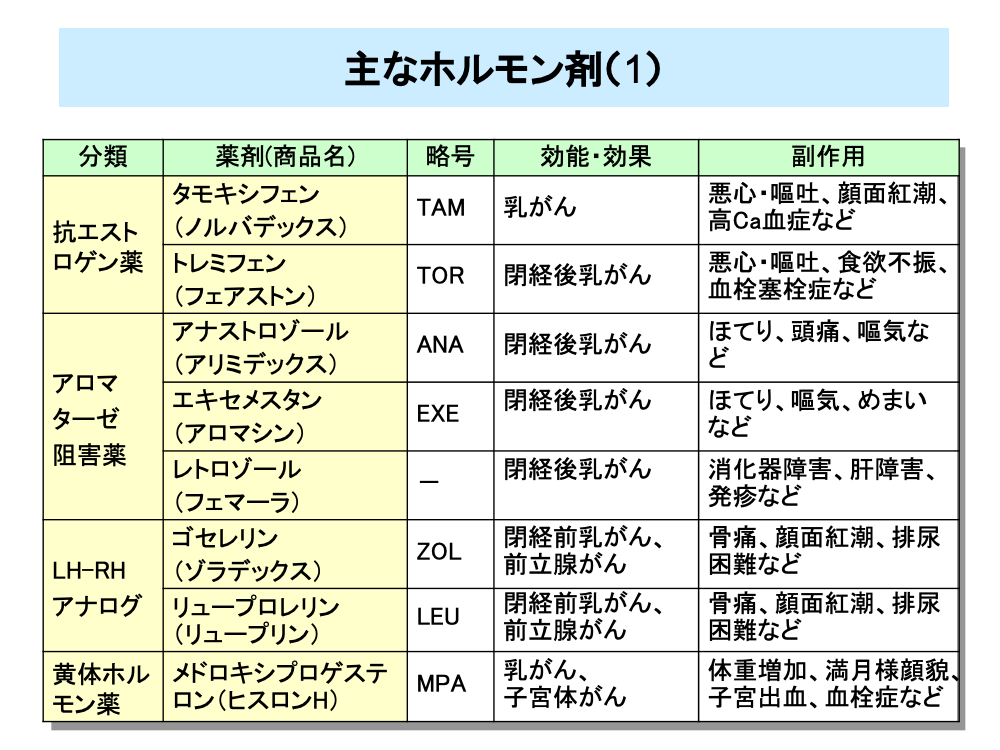
ホルモン剤には、抗エストロゲン薬、アロマターゼ阻害薬、LH-RHアナログ、黄体ホルモン薬、抗アンドロゲン薬があります。これらは、乳がんや前立腺がんなどホルモン依存性のがんの治療に用いられています。これらのホルモン剤は副作用が軽微であり、主な薬剤は経口剤であることから長期投与が行われています。
乳がんは、エストロゲンが刺激となってがん細胞が増殖するため、これを止めるために抗エストロゲン薬が用いられます。抗エストロゲン薬の代表的なものに、タモキシフェンやトレミフェンがあります。抗エストロゲン薬は、SERM(サーム、Selective Estrogen Receptor Modulater、選択的エストロゲン受容体調整薬)とも呼ばれています。
また、エストロゲンは閉経前は卵巣で作られますが、閉経後は脂肪組織でアンドロゲンから転換されて作られます。そのときにアロマターゼという酵素が関与しています。このアロマターゼを阻害して、体内のエストロゲン量を少なくする働きをするのが、アロマターゼ阻害薬(Aromatase Inhibitor:AI)です。アロマターゼ阻害薬にはアナストロゾールやエキセメスタン、レトロゾールなどがあり、いずれも閉経後の乳がんが適応となります。
LH-RHアナログは、乳がんと前立腺がんの両方に用いられる薬剤です。アナログとは類似品という意味です。性腺刺激ホルモン放出ホルモンであるLH-RHに似た作用を持つ薬剤を投与することで、脳下垂体から性腺刺激ホルモンである黄体形成ホルモン(LH)と卵胞刺激ホルモン(FSH)の分泌を低下させ、結果としてエストロゲンの分泌を抑制するほか、男性ホルモンであるテストステロンの分泌も抑制します。LH-RHアナログにはゴセレリンとリュープロレリンがあります。閉経後は卵巣からのエストロゲン放出は起こらないため、LH-RHアナログの効果は期待できず、そのためLH-RHアナログの適応は閉経前乳がんに限られます。
なお、乳がん、子宮体がんには黄体ホルモン薬も用いられています。黄体ホルモン薬の作用としてさまざまなものが報告されていますが、はっきりとしたことはわかっていません。
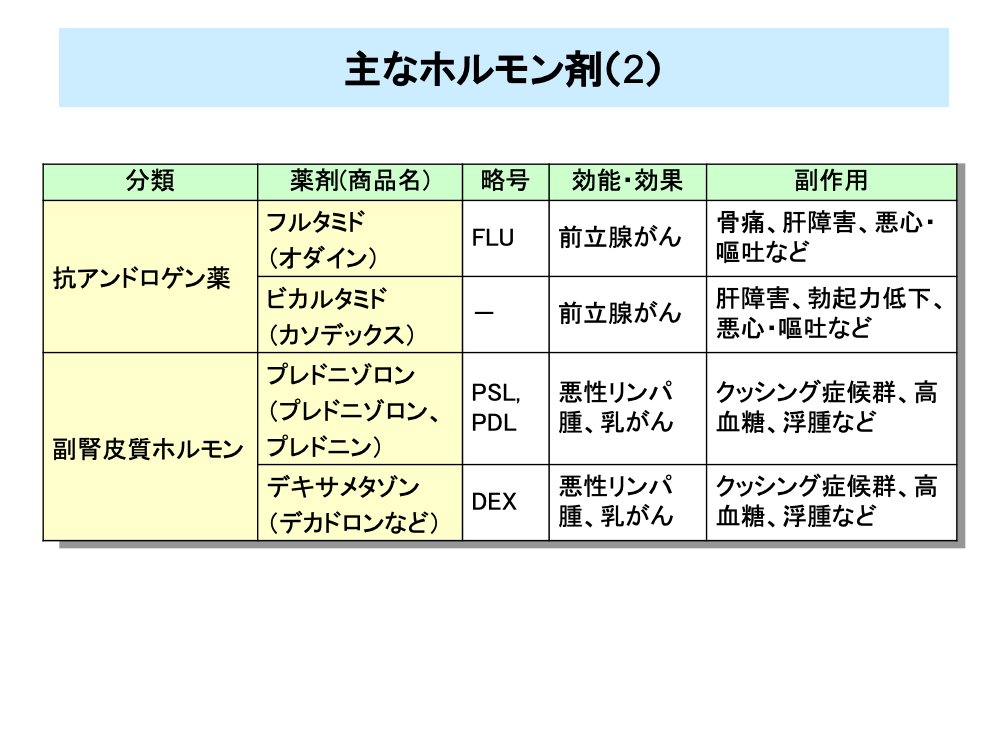
前立腺がんは、男性ホルモンの一種であるテストステロンの刺激でがん細胞が増殖します。これを止めるためにLH-RHアナログや抗アンドロゲン薬が用いられます。抗アンドロゲン薬は前立腺がん細胞にある男性ホルモン受容体をブロックして、テストステロンが結合できないようにします。抗アンドロゲン薬にはフルタミドやビカルタミドがあります。
この他、悪性リンパ腫などの血液のがんには、副腎皮質ホルモン(糖質コルチコイド)がリンパ球の分裂を抑制することから、プレドニゾロンやデキサメタゾンが用いられています。副腎皮質ホルモン製剤は他のホルモン剤と異なり、クッシング症候群などの副作用があることから、投与時には注意が必要となります。
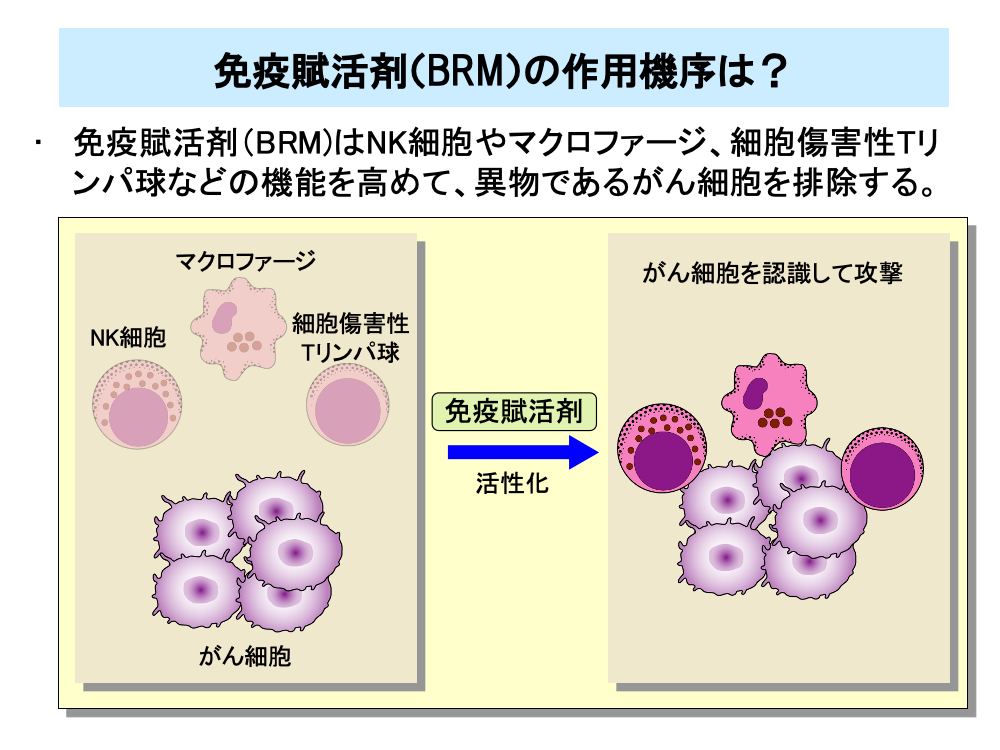
免疫賦活剤は、一般にはBRM(Biological Response Modifier)と呼ばれています。
BRMは、がん細胞に直接働くのではなく、免疫系の働きを高めて、がん細胞を排除する薬剤です。
がん細胞は元は患者自身の細胞なので、免疫系で異物として認識されにくく、特にがんが進行すると免疫機能が低下するため、がんを排除しにくくなります。
がんに対する免疫機構で重要な働きをするのは、NK細胞、マクロファージ、細胞傷害性Tリンパ球(CTL)などですが、BRMはこれらの免疫細胞を活性化することにより、がん細胞を異物として認識させ攻撃するように仕向けます。

BRMの代表的な薬剤としてはインターフェロンがあります。インターフェロンにはアルファ型、ベータ型、ガンマ型がありますが、腎がんや慢性骨髄性白血病にはインターフェロンアルファが用いられています。インターフェロンアルファの特徴的な副作用としては、間質性肺炎や抑うつがあります。
以上、述べてきた分類に入らない薬剤としてサリドマイドがあります。サリドマイドは妊婦が睡眠薬として用いた際にいわゆるアザラシ児と呼ばれる奇形児の出産が頻発したため、販売中止となった薬剤です。しかし、その後の研究により多発性骨髄腫などに有効であることがわかったため、抗がん剤として再発売されました。
直接的な抗腫瘍効果を持たない薬剤にホリナートがあります。ホリナートは葉酸化合物の一つで、メトトレキサート投与による正常細胞における葉酸欠乏を救うことによりメトトレキサートの毒性を軽減する(メトトレキサート救援療法)ために当初は用いられていました。その後、ホリナートにはフルオロウラシルの効果を増強する作用があることが明らかになり、フッ化ピリミジン系抗がん剤の効果増強に用いられるようになりました。
ホリナートにはロイコボリンという商品名の低用量の注射剤と経口剤があり、これらはメトトレキサートの毒性軽減に用いられています。ホリナートにはd体とl体の光学異性体があり、l体のみが活性を示しますが、ロイコボリンはd体とl体の混合物です。
また、中等用量のロイコボリンとユーゼルは、テガフール・ウラシルとの併用で大腸がんに用いられています。
アイソボリンは高用量のd体からなる注射剤ですが、フルオロウラシルとの併用で大腸がんに対し標準的な治療法として、広く用いられています。

抗がん剤にはcell cycleの特定の期に作用する細胞周期特異的な薬剤と、G1~M期の全ての期に作用する細胞周期非特異的な薬剤があります。
アルキル化剤や白金製剤は全ての期に作用する細胞周期非特異的薬剤です。
抗がん性抗生物質は、薬剤により作用点が異なり、ドキソルビシンは全ての期に作用するのに対し、ブレオマイシンはG2期に作用します。
代謝拮抗剤は、ほとんどがS期に作用しますが、ゲムシタビンはG1期に作用します。
植物由来製剤も薬剤により作用点が異なります。紡錐体の合成・再構築を阻害するビンカアルカロイドやタキサンはM期に作用しますが、トポイソメラーゼ阻害剤はS期とG2期に作用します。
分子標的薬やホルモン剤、免疫賦活剤はcell cycleと無関係に作用します。