がん化学療法入門(3)
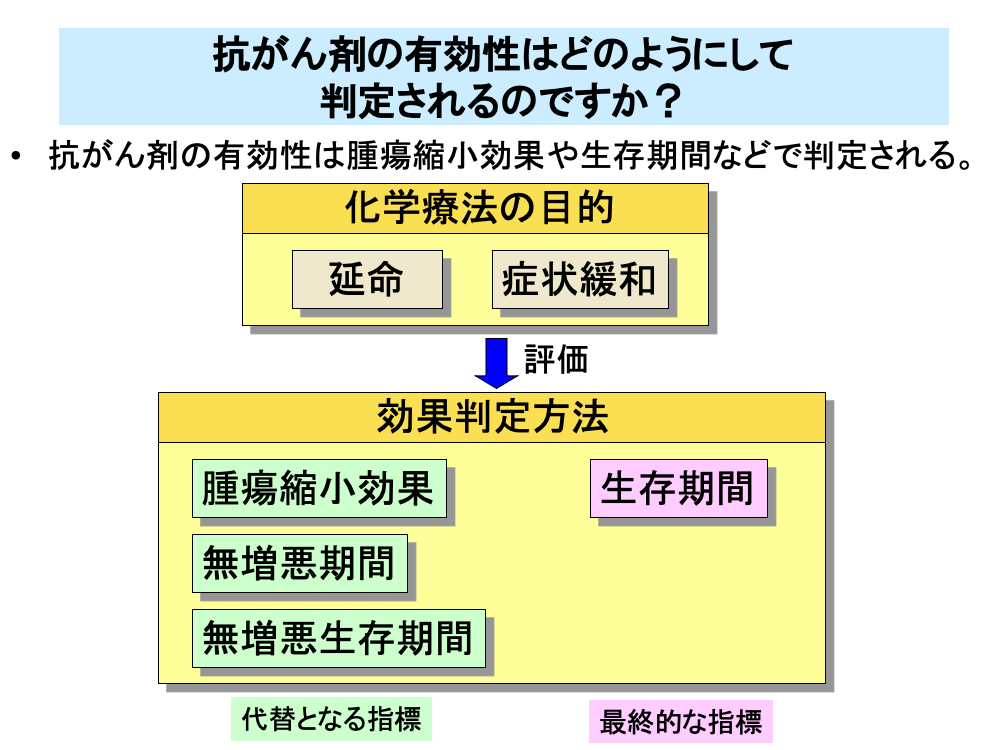
一般的な固形がんの化学療法の目的は、延命と症状緩和です。
治療効果や治療継続の適否を簡便に、早期に判断するため、効果判定として、CTなど画像診断による腫瘍縮小効果や増悪までの期間(無増悪期間)、増悪あるいは死亡の早い方までの期間(無増悪生存期間)などが代替となる指標(サロゲートマーカー)として、用いられます。
腫瘍縮小効果は腫瘍がどれくらい小さくなったか、その効果がどのくらいの期間保たれたか、といったことから抗がん剤の効果を評価する方法です。
延命効果は患者さんがどれくらい長生きできたか(生存期間)を評価するもので、化学療法の最終的な目標として、評価されます。また、生存期間を調べるには長期間かかることになりますから、化学療法の効果をもう少し短期間に評価するため、再発・悪化せずに長生きできたかどうか(無増悪生存期間)ということを評価する方法もあります。多くの場合、無増悪生存期間と生存期間は相関が認められます。
腫瘍縮小効果は比較的短期間で判定ができ、また効果判定に必要な症例数が少なくて済むため、第Ⅱ相臨床試験などで用いられています。
延命はがん化学療法の本来の目的ですが、延命効果を確かめるためには時間がかかり、また多くの症例数を必要とします。そのため、小規模の試験では腫瘍縮小効果や増悪までの期間、あるいは無増悪期間が効果判定にしばしば用いられます。
原則として、抗がん剤の承認にあたっては延命効果を確認する大規模な比較試験が要求されます。

腫瘍縮小効果の判定には、2009年に改訂されたRECIST(レシスト、Response Evaluation Criteria in Solid Tumors)ガイドライン1.1が用いられています。
RECISTでは、評価対象を「標的病変」と「非標的病変」に分けて評価を行います。
「標的病変」というのは、治療目標とされる腫瘍のことで主に画像診断により評価を行います。「非標的病変」というのは胸水や腹水のような、治療目標以外の病変のことで、腫瘍マーカーなどにより評価を行います。
「標的病変」に対する効果判定は、完全奏効(Complete Response:CR)、部分奏効(Partial Response:PR)、安定(Stable Disease:SD)、進行(Progressive Disease:PD)の4段階に分けて判定を行います。
一方、「非標的病変」に対する効果判定は、完全奏効(Complete Response:CR)、不完全奏効(Imcomplete Response:IR)、安定(Stable Disease:SD)、進行(Progressive Disease:PD)の4段階に分けて判定を行います。すなわち不完全奏効(IR)以外は「標的病変」に対する効果判定の表現と同じものが用いられます。
RECISTでは、標的病変のほかに非標的病変や新病変も加えて最終的にCR、PR、SD、PDとして評価します。また、何らかの理由により評価ができなかった場合は評価不能(Not Evaluable:NE)とします。

標的病変に対しては、主にCTを用いて標的病変の径和(腫瘍性病変の長径の和+リンパ節病変の短径の和)の治療前における値(ベースライン)と治療中の値の変化を測定し、次のように4段階評価を行います。
完全奏効(Complete Response:CR)は、すべての標的病変が消失し、リンパ節病変は10mm未満に縮小したものです。
部分奏効(Partial Response:PR)は、標的病変の径和がベースラインの径和より30%以上減少したものです。
進行(Progressive Disease:PD)は、経過中の最小の径和に比べて、標的病変の径和が20%以上増加、かつ径和が絶対値でも5mm以上増加したものです。
安定(Stable Disease:SD)は、CRやPRには腫瘍縮小が不十分で、PDには増大が不十分なものです。大まかには標的病変の径和が30%未満の縮小あるいは20%未満の増大ということになります。
なお、比較試験などでCRやPRの確定が必要な場合は、「プロトコールで定められた次の評価時点(通常は4週後)においても、それぞれの規準が満たされた場合にのみ判定することができる」とされています。
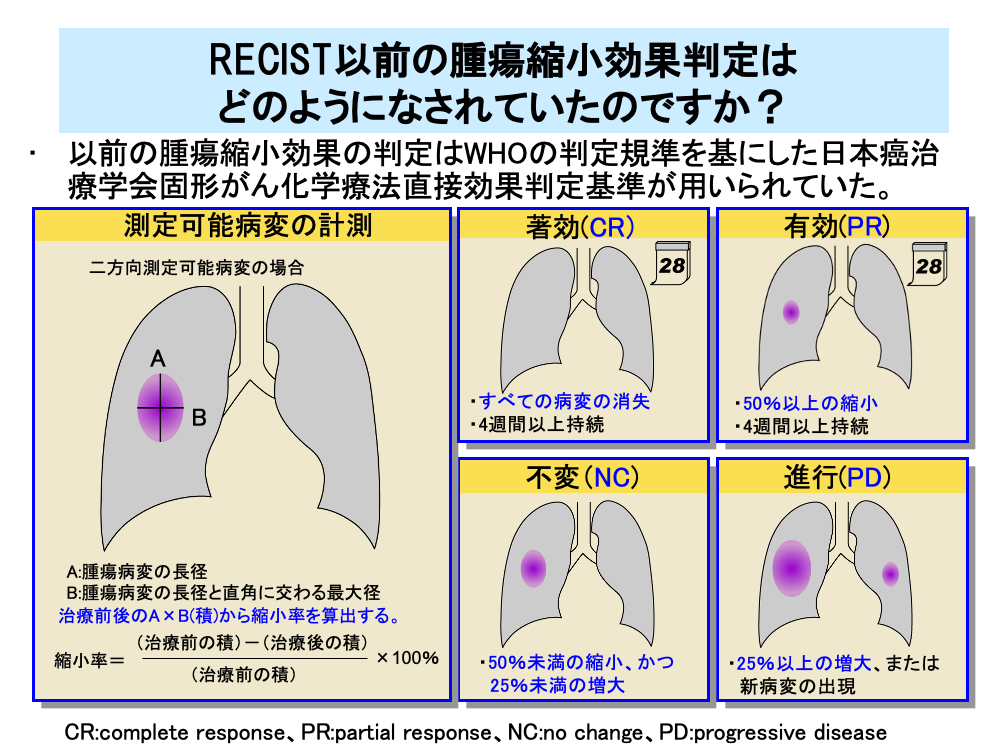
RECISTが出現する前の腫瘍縮小効果の判定には、1986年にWHOの判定規準を基にして定められた「日本癌治療学会固形がん化学療法直接効果判定基準」が用いられていました。この基準は「直接効果判定基準」と略されたり、基準を作る基となった厚生省班研究の班長を務めた医師の名前をとって「斉藤・小山班基準」と呼ばれていました。
「直接効果判定基準」ではRECISTと同様に評価を行う病変である標的病変を測定可能病変と測定不能ではあるが評価は可能な病変(評価可能病変)に分けて評価します。
測定可能病変に対しては標的病変の長径とこれに直角に交わる最大径の2つの方向を測定し、その積を算出して治療前後の縮小率を調べます。
著効(Complete Response:CR)は、すべての標的病変が消失し、その状態が4週間以上持続したものです。
有効(Partial Response:PR)は、50%以上の縮小が4週間以上持続したものです。
不変(No Change:NC)は、腫瘍縮小が50%未満あるいは腫瘍増大が25%未満の場合です。
進行(Progressive Disease:PD)は、25%以上腫瘍が増大した場合です。
なお、縦隔腫瘍など1方向のみしか測定できない場合は、30%以上縮小を有効(PR)、25%以上の増大を進行(PD)としています。
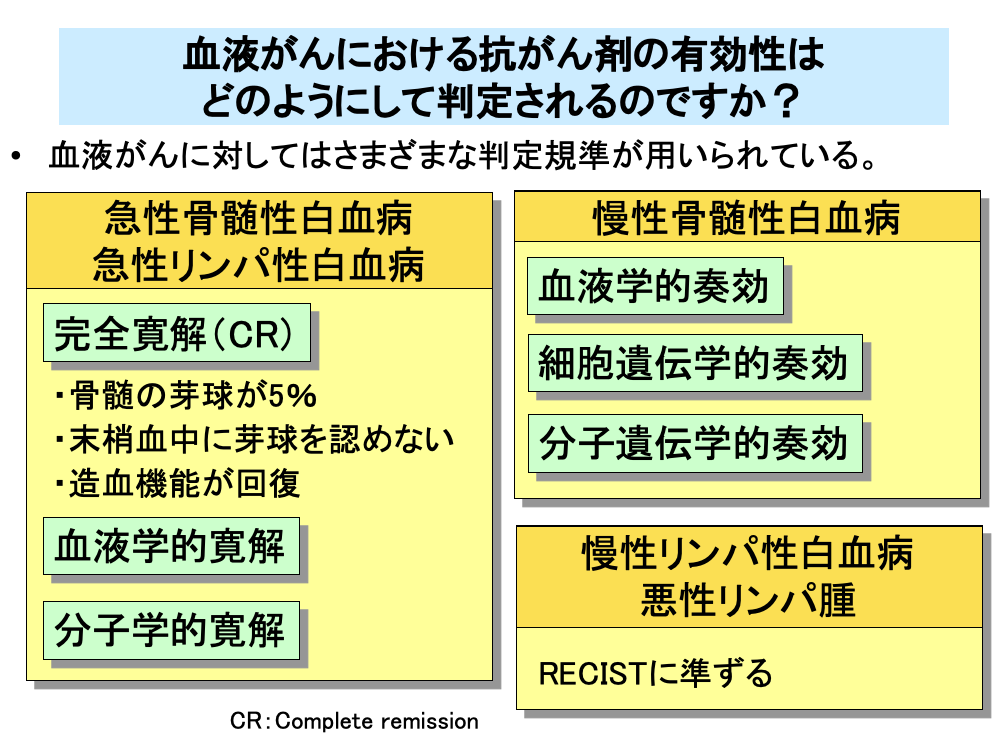
血液がんに対する抗がん剤の効果判定では、生存期間以外にさまざまな判定規準が用いられています。
急性白血病は固形がんのように固まりを作らないので、RECISTの判定規準は適用できません。そのため、血液細胞数やその形態をもとに判定を行います。
急性白血病では、最初にがん細胞を大幅に減少させる寛解導入療法を行いますが、その時に完全寛解(Complete remission:CR)が得られたかどうかで効果判定を行います。完全寛解は骨髄中の芽球が骨髄全体の5%未満、つまり顕微鏡で見てほとんど分からなくなる程度に減少し、末梢血中にも芽球が認められなくなるとともに、正常好中球と血小板が回復するなど造血機能が回復する状態が4週間以上持続することを指します。また、急性白血病ではこのほかに、血液学的完全寛解や分子学的完全寛解といった判定規準も用いられます。
一方、慢性骨髄性白血病では、血液学的奏効、細胞遺伝学的奏効、分子遺伝学的奏効などのさまざまな判定規準が用いられており、それぞれ細かい規定が定められています。
慢性リンパ性白血病では、悪性リンパ腫に準じた判定規準が用いられています。悪性リンパ腫ではリンパ節の腫脹が認められますので、RECISTに準じたCR、PR、SD、PDの4つに分けて効果判定を行います。
なお、慢性骨髄性白血病では奏効(Response)というRECISTと同じ語句を用いているのに対し、急性白血病では寛解(Remission)という語句を用いているので注意が必要です。
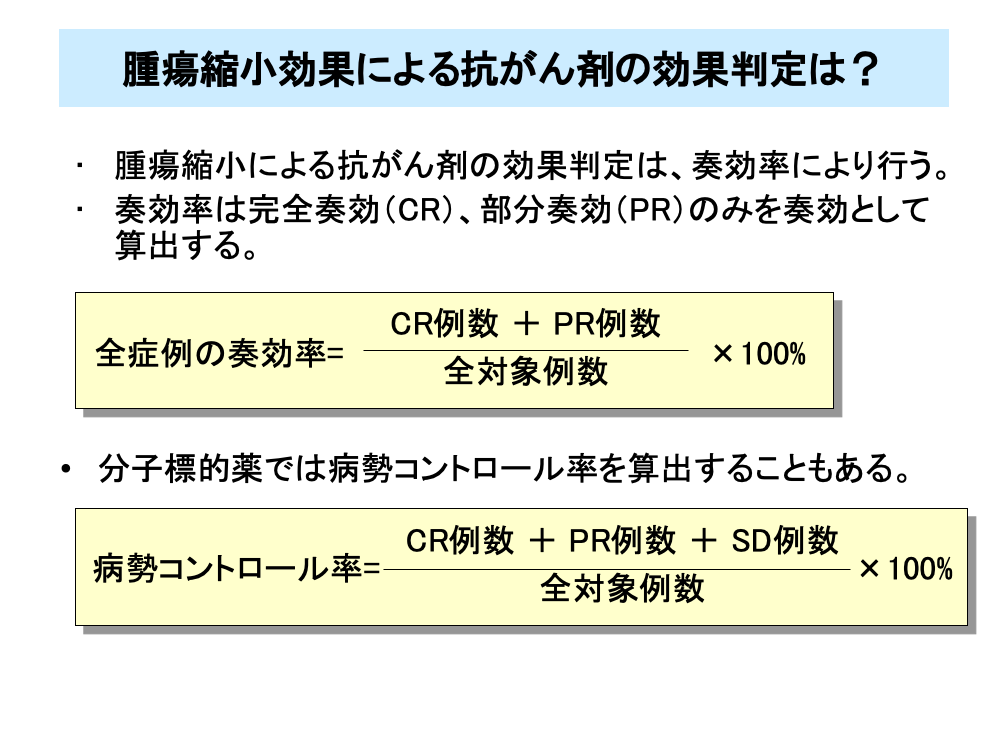
腫瘍縮小による効果判定では、CR例とPR例を効果があった症例(奏効例)としてその割合(奏効率)を求め判定を行います。
奏効率は、CR例数とPR例数の和を全対象例数で割り、パーセント表示したものです。
また、増悪しなければ腫瘍の増殖を抑えており有効と判断されることもあり、CR例とPR例およびSD例の全対象例数に対する割合である病勢コントロール率を求めることがあります。特に、分子標的薬では、腫瘍の増殖抑制が特徴的な薬剤も多く、しばしば病勢コントロール率が評価されます。
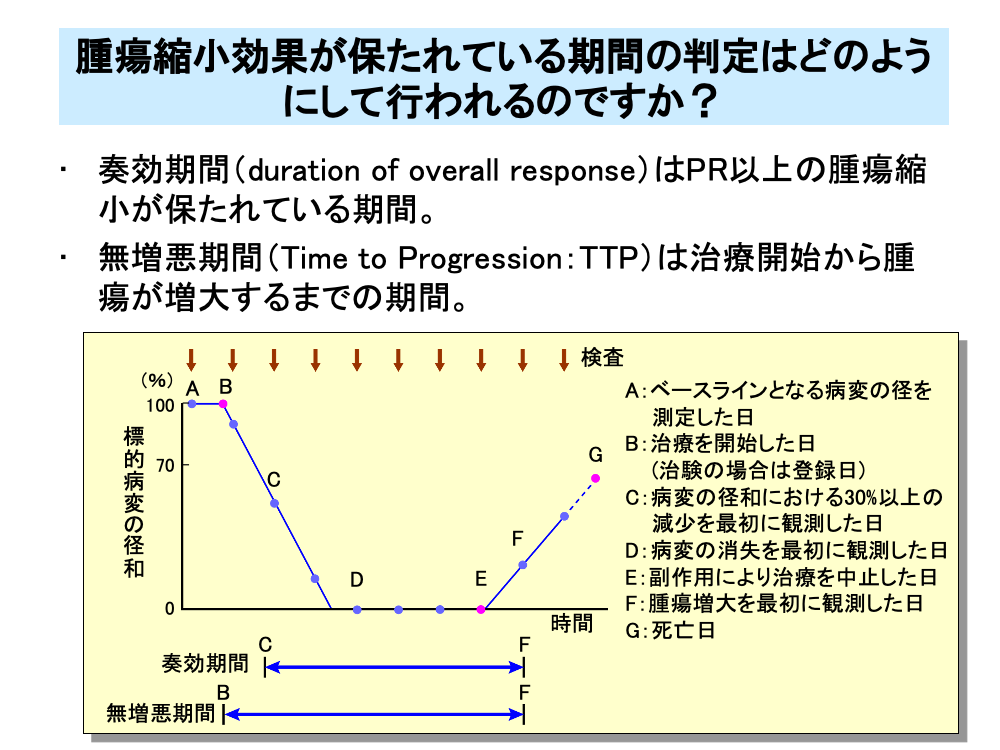
治療開始あるいは登録日から病勢増悪までの期間を無増悪期間(Time to Progression:TTP)といい、図のA(またはB)-F間の期間にあたります。
また、それと似たものとして奏効期間(duration of response)があり、「初めて奏効と判断されてから、初めて増悪と判断されたかもしくは死亡のうちの早い方までの時間」と定義されます。つまり、奏効期間はPR以上の腫瘍縮小が得られている期間で、図のC-F間の時間になります。
CRが得られた場合は、図のD-F間の時間を完全奏効期間と呼びます。
無増悪期間は治療開始(治験の場合は登録日)から腫瘍増大を認めた日までで、図のB-F間の時間となります。
効果がSDに留まった場合は図のB-F間に相当する時間を安定期間(duration of stable disease)と呼びますが、この場合は無増悪期間と同じ意味となります。
副作用などで治療中断が生じた場合、治療開始から治療中断までの期間と無増悪期間または死亡するまでの期間を比べて、より時間の短いものを治療成功期間(Time to Treatment Failure:TTF)と呼びます。
図ではB-F間やB-G間よりB-E間のほうが短いのでB-E間が治療成功期間(TTF)となります。
なお、腫瘍縮小の度合いはCT等の検査により判明するので、PRやCRを認めた日時は実際にPRやCRとなった日時とズレが生じます。一般に検査間隔が長いほどこのズレは大きくなります。

全生存期間や無増悪生存期間などは、起算日からイベント(事象)が起こるまでの時間により計算します。
臨床試験の場合は症例登録を行った日や治療を開始した日(化学療法を開始した日や手術日)が起算日となります。臨床試験以外では診断確定日を起算日として用いることがあります。
全生存期間(OS)では、すべての死亡がイベントとなります。すなわち症例登録日から死亡までの期間ということになります。この場合、がんによる死亡だけでなく、他病死や交通事故死など死亡理由の如何を問いません。
無増悪生存期間(PFS)は、死亡または増悪のいずれか早くに起こったものをイベントとし、起算日からの日数を求めます。通常は増悪が先です。
このほか、治療成功期間、無再発生存期間、無病生存期間も起算日からイベントが起こるまでの時間により計算します。
治療成功期間(TTF)は、死亡、増悪、治療中止のうち一番早くに起こったものをイベントとして日数を求めます。すなわち、副作用などにより治療中止に追い込まれたような場合もイベントとして扱います。
無再発生存期間(RFS)は、術後補助化学療法における効果判定に用いられ、死亡または再発のいずれか早くに起こったものをイベントとします。通常は死亡より再発が先に起こります。
無病生存期間(DFS)も術後補助化学療法における効果判定に用いられ、死亡、再発と二次発がんのうち一番早くに起こったものをイベントとして扱います。
一般的に、OSが延命効果の代表的な指標となりますが、がんによってはOSのみでは効果がはっきりわからなくなることがあるため、PFSやRFSも同時に求められます。
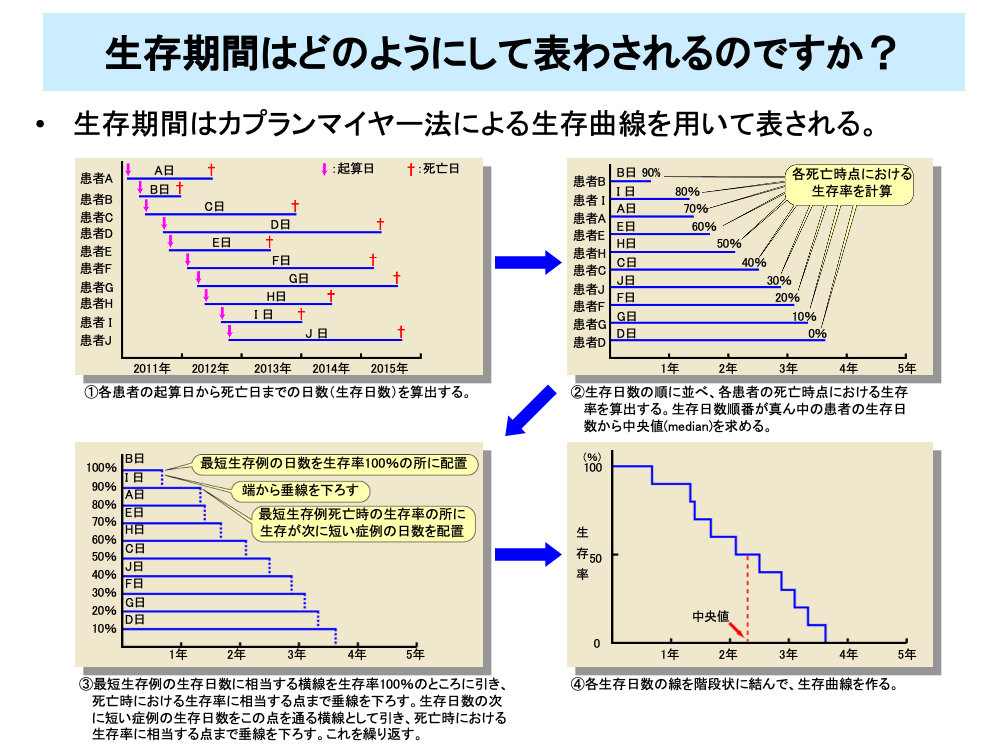
全生存期間など延命効果を評価するためには、Kaplan-Meier(カプランマイヤー)法による生存曲線を用いて生存分析を行います。
カプランマイヤー法は、
①各患者の起算日(症例登録日や治療開始日)から死亡日までの日数(生存日数)を算出する
②生存日数の順に並べ、各患者の死亡時点における生存率を算出する。生存日数順番が真ん中の患者の生存日数から中央値(median)を求める
③最短生存例の生存日数に相当する横線を生存率100%のところに引き、死亡時における生存率に相当する点まで垂線を下ろす。生存日数の次に短い症例の生存日数をこの点を通る横線として引き、死亡時における生存率に相当する点まで垂線を下ろす。これを繰り返す
④各生存日数の線を階段状に結んで、生存曲線をつくる
という手順により生存曲線を作成し、分析を行います。
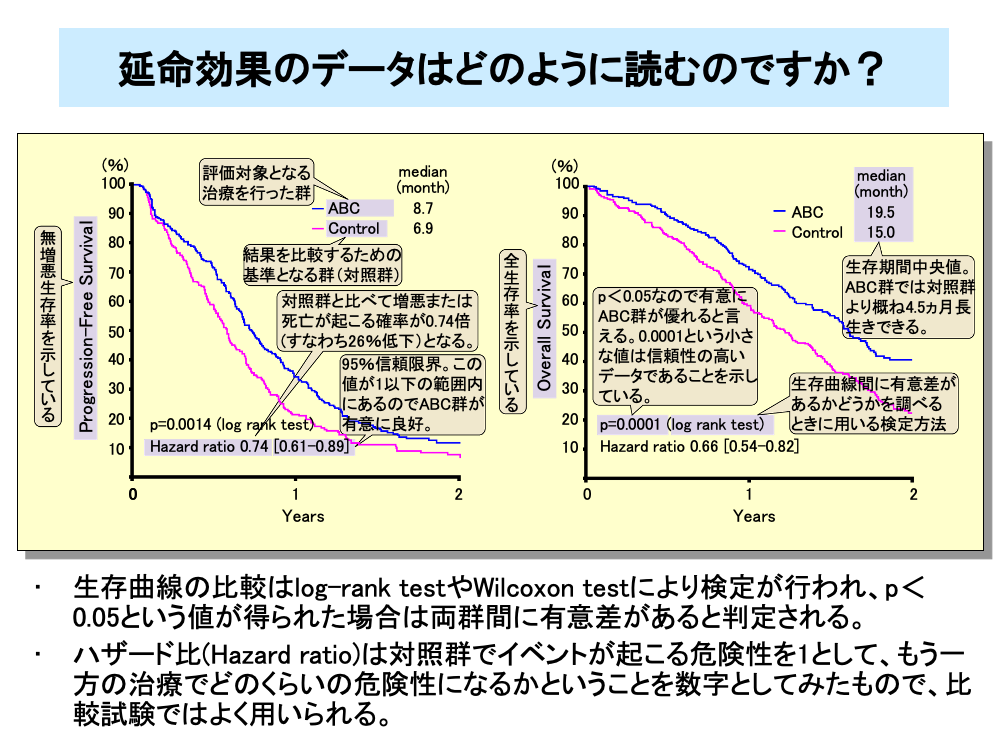
第Ⅲ相試験などで延命効果を比較する際には、生存曲線に差があるか否かを比較します。また、全生存率(OS)の比較だけでなく、無増悪生存率(PFS)などの比較も同様に行います。この比較の有意差検定には通常、log-rank test(ログランクテスト)が用いられますが、Wilcoxon test(ウィルコクソンテスト)が用いられることもあります。
スライドは、ABCという化学療法を対照群(コントロール群)と比較した例です。PFSとOSは、ログランクテストでp=0.0014および0.0001という値が得られています。p値が0.05未満(p<0.05)の場合は両群間に有意差を認めると判断されますが、この場合は0.05よりはるかに小さいp値なので、両治療法の延命に対する違いは明白で、信頼性の高いデータであるといえます。
さらに、両群間の比較を行う手段として、ハザード比(Hazard ratio:HR)を求めることが行われています。ハザード比は対照群でイベントが起こる危険性を1とした場合、試験治療群(試している治療)での治療でどのくらいの危険性になるかということを数字としてみたものです。スライドの例の場合、PFSでのハザード比は0.74ですから、対照群に比べてABC群では増悪あるいは死亡の早い方のイベントが起こる危険性が0.26(26%)減少すると判断されます。同様にOSのハザード比0.66より、対照群に比べてABC群では死亡が起こる危険性が34%減少すると判断されます。
HRの横の数字は95%信頼限界を表します。これが1を超えない場合有意に(p<0.05)ハザード比の減少が得られていると判断されます。生存期間のデータにはメジアン値(中央値)が記載されることがあります。ここではPFSのメジアン値が1.8ヵ月違うので、増悪までの期間はABC群が真ん中の患者で約1.8ヵ月長く、またOSでのメジアン値から概ね4.5ヵ月長生きできると判断されます。
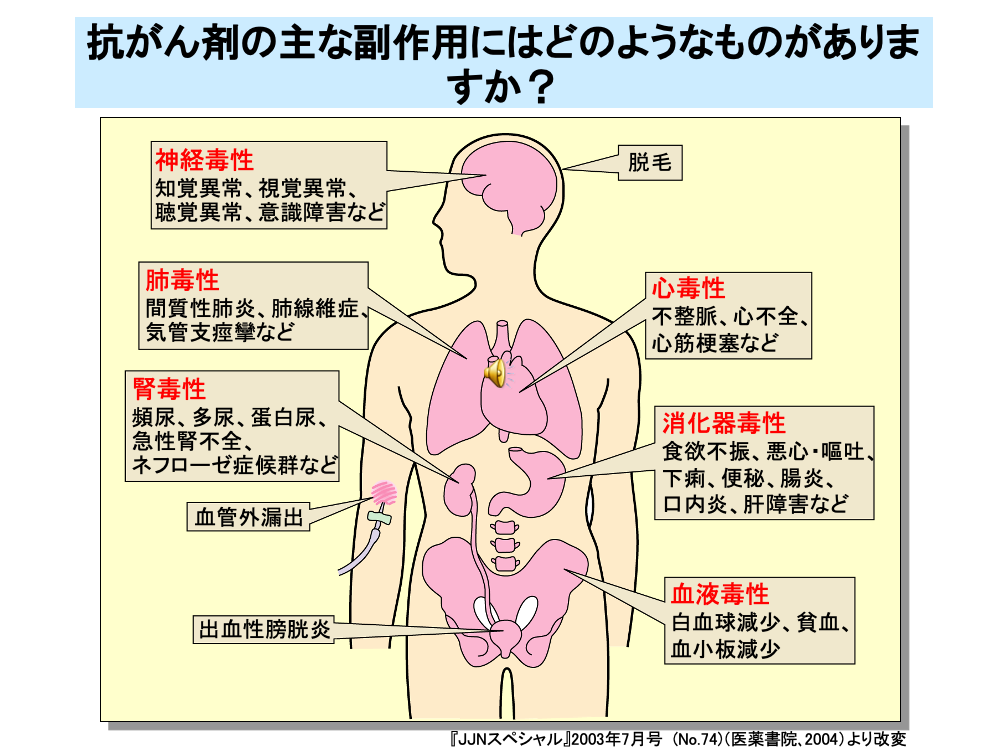
殺細胞性抗がん剤は、分裂の盛んな腫瘍組織だけでなく、骨髄や消化管の粘膜などに作用します。このため、白血球減少、貧血(赤血球減少)、血小板減少といった血液毒性や、食欲不振、悪心・嘔吐、下痢、便秘、腸炎、口内炎などの消化器毒性が発現します。このほかにも、知覚異常、視覚異常、聴覚異常、意識障害などの神経毒性、間質性肺炎、肺線維症、気管支痙攣などの肺毒性、頻尿、多尿、蛋白尿、急性腎不全、ネフローゼ症候群などの腎毒性、不整脈、心不全、心筋梗塞などの心毒性が出現します。また、皮膚に対する毒性として脱毛が現れます。静注時に血管外に漏出することによる皮膚の壊死も起こります。このほかに、出血性膀胱炎などさまざまな毒性が抗がん剤では発現します。
分子標的薬では、それぞれ特異的な毒性が現れます。
モノクローナル抗体では、初回投与時に発熱、悪寒、嘔気、嘔吐、疼痛、頭痛、咳、めまい、発疹、無力症などのinfusion reaction(インフュージョン・リアクション)と呼ばれる副作用が出現します。また、EGFRに作用する薬剤ではにきびに似た発疹(ざ瘡様発疹)が発現します。
このほかに、手足皮膚反応、高血圧、動静脈内血栓症、間質性肺炎、消化管穿孔、心毒性などが問題となる分子標的薬もあります。
ホルモン療法剤の副作用としては、発汗や顔のほてりなどホットフラッシュと呼ばれる副作用が出現します。また、骨粗鬆症や体重増加なども出現します。

一口に副作用といっても、治療の必要のないものから死に至るものまでさまざまな程度のものがあります。
副作用(有害事象)の重篤度の判定は、現在は有害事象共通用語規準(CTCAE)を用いて行われています。CTCAEは数年に1度改訂され、現在使われているのはバージョン5.0です。
CTCAEは、有害事象の程度をGrade 1~Grade 5に区分し、Grade 3以上を重篤な有害事象として扱っています。
Grade 1~Grade 4では、各Gradeの項目のうち、いずれか1つがあてはまる場合で判定します。
Grade 1:①軽症 ②症状がない、または軽度の症状がある ③臨床所見または検査所見のみ ④治療を要さない
Grade 2:①中等症 ②最小限/局所的/非侵襲的治療を要する③年齢相応の身の回り以外の日常生活動作の制限
Grade 3:①重症または医学的に重大であるが、ただちに生命を脅かすものではない②入院または入院期間の延長を要する③活動不能/動作不能 ④身の回りの日常生活動作の制限
Grade 4:①生命を脅かす②緊急処置を要する
Grade 5:有害事象による死亡
となっています。
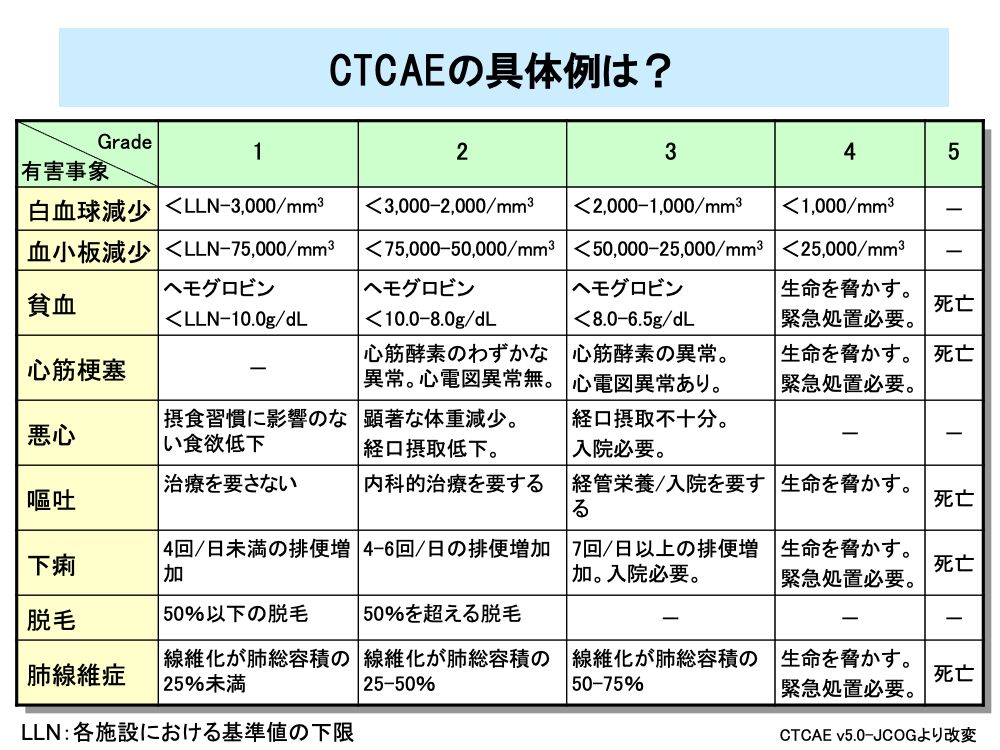
CTCAEでは白血球減少や血小板減少は「臨床検査」の項目に分類され、Grade 1からGrade 4に分類されていてGrade 5はありません。一方、赤血球減少である貧血は「血液およびリンパ系障害」として分類され、Grade 1からGrade 5に分類されています。
このほかに、表には掲載してありませんが、白血球減少の大半を占める好中球減少の結果生じる発熱性好中球減少症では重症で時には死亡に至るためGrade 3からGrade 5に分類されていて、Grade 1、2はありません。
同様に心筋梗塞などの有害事象では治療が必要となるため、Grade 1はありません。
一方、悪心は生命を脅かしたり死亡に至ったりすることはないためGrade 4、5はありませんが、嘔吐は死亡に至る場合があるためGrade 4、5があります。
また、脱毛のように入院治療などが不要な有害事象ではGrade 3以上がありません。
このようにCTCAEは、有害事象が全てGrade 1からGrade 5に分類されているわけではなく、同じような項目の有害事象でも、Gradeの範囲が異なることがあります。
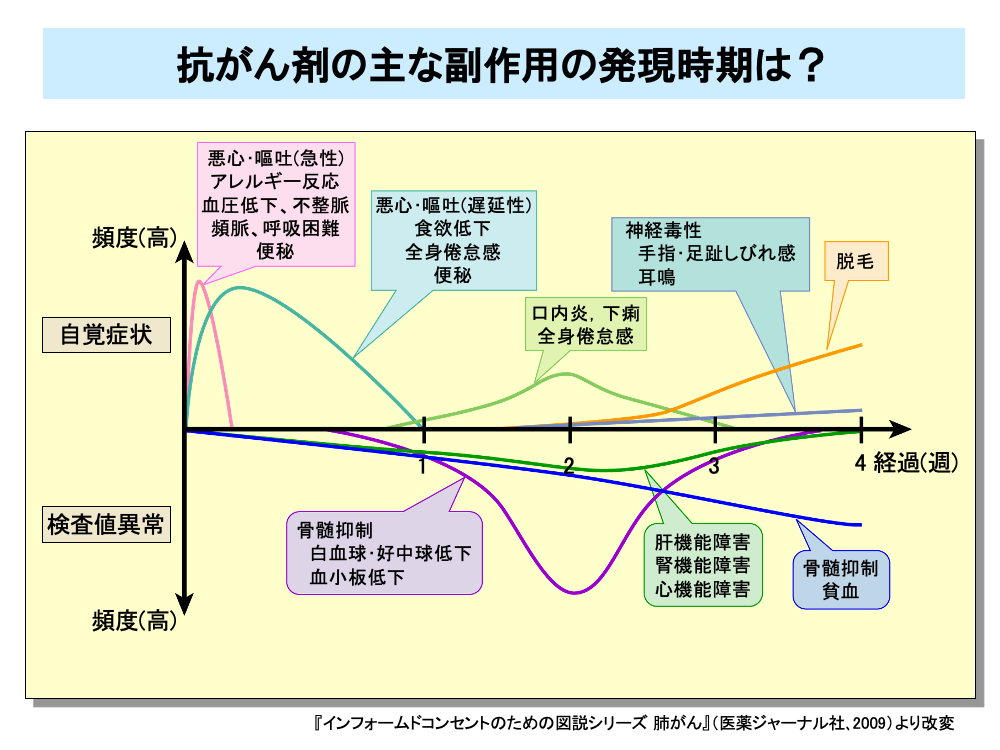
抗がん剤による副作用には、早く現れるものと遅れて現れるものがあります。
たとえば悪心・嘔吐は、抗がん剤投与中に現れる急性のものと、投与後数日経過してから現れる遅延性のものがあります。
便秘も投与直後に出るものと、数日後に現れるものがあります。
また、血液検査により明らかになる骨髄抑制も、白血球・好中球減少は早めに出現し、ついで血小板減少がやや遅れて出現しますが、貧血はさらに遅れて出現します。
このほか、投与中あるいは投与直後に現れる自覚症状にはアレルギー反応、血圧低下、不整脈、頻脈、呼吸困難などがあります。
また、数日後に現れる副作用としては食欲低下、全身倦怠感があり、口内炎、下痢はその後に出現します。
投与数週間後から出現する副作用としては脱毛や手指・足趾しびれ感や耳鳴といった神経症状があります。
このほか、肝機能障害、腎機能障害、心機能障害といった検査値異常も投与数週間後から出現してきます。
このようなことから、がん化学療法を行うにあたっては、きめ細かい検査と問診を行う必要があります。

がん化学療法における副作用に対しては、対策が確立しているものがいくつかあります。
白血球減少にはG-CSF投与が行われるほか、血小板減少には血小板輸血、貧血には赤血球濃厚液輸血といった成分輸血が行われます。
悪心・嘔吐には5-HT3受容体拮抗剤やデキサメタゾンが用いられるほか、最近ではNK1受容体拮抗剤の投与も行われています。
下痢に対してはロペラミドのほか対症療法としてタンニン酸アルブミンや乳酸菌製剤の投与が行われます。
しびれなどの神経障害には決め手になる対策が見つかっていませんが、ビタミンB6やビタミンB12の投与が有効な場合があります。
このほか、個別の抗がん剤における副作用対策として、シスプラチンの腎障害予防として投与前後の大量の輸液(ハイドレーション)と利尿剤の投与や、パクリタキセルによるアレルギー反応予防ではデキサメタゾンと抗ヒスタミン剤を用いたプレメディケーションなどが用いられています。
またこのほかに、モノクローナル抗体ではinfusion reactionを防ぐために、抗ヒスタミン剤などの投与が行われています。

大部分の抗がん剤は毒性が強いため、副作用の危険性が大きい症例や合併症を抱える症例のほか、全身状態が悪い患者は投与禁忌あるいは慎重投与となっています。肝障害や腎障害のある患者では副作用発現の危険性が増します。また、抗がん剤は催奇形性を有することから妊婦または妊娠している可能性のある婦人は投与禁忌となります。小児も副作用発現リスクが高い一方、小児がんに用いられる抗がん剤はそう多くはありません。
70~75歳以上では、肝・腎機能が低下しているため副作用発現の危険性が高く、個人差も大きく、何歳以上が高齢者かという明確な線引きはできません。また、わが国では高齢化が進んでおり、今後さらに高齢者のがん患者が多くなることが予想されます。高齢者での安全な化学療法の実施についての評価基準など確立していく必要があり、高齢者を対象とした臨床試験も行われています。
CTCAEのGrade 3、4に相当するような重篤な骨髄抑制がある患者や重篤な消化器症状がある患者は、投与禁忌または慎重投与となります。また、感染症を合併している患者では、抗がん剤による免疫力の低下や骨髄抑制のため感染症の増悪のリスクも高くなることから、基本的に投与は禁忌です。
全身状態が悪く、その指標となるPerformance Statusが4、すなわち「身の回りのこともできず、常に介助が要り、終日就床を必要としている」患者の場合は、がん化学療法の効果が期待できないため投与禁忌となります。
また、PS3の「身の回りのある程度のことはできるが、しばしば介助が要り、日中の50%以上は就床している」場合でも、化学療法の副作用が強く出ることが多く、得られる利益が少ないため、十分考慮したうえで慎重に適応することが必要です。