がん化学療法の副作用対策入門(3)
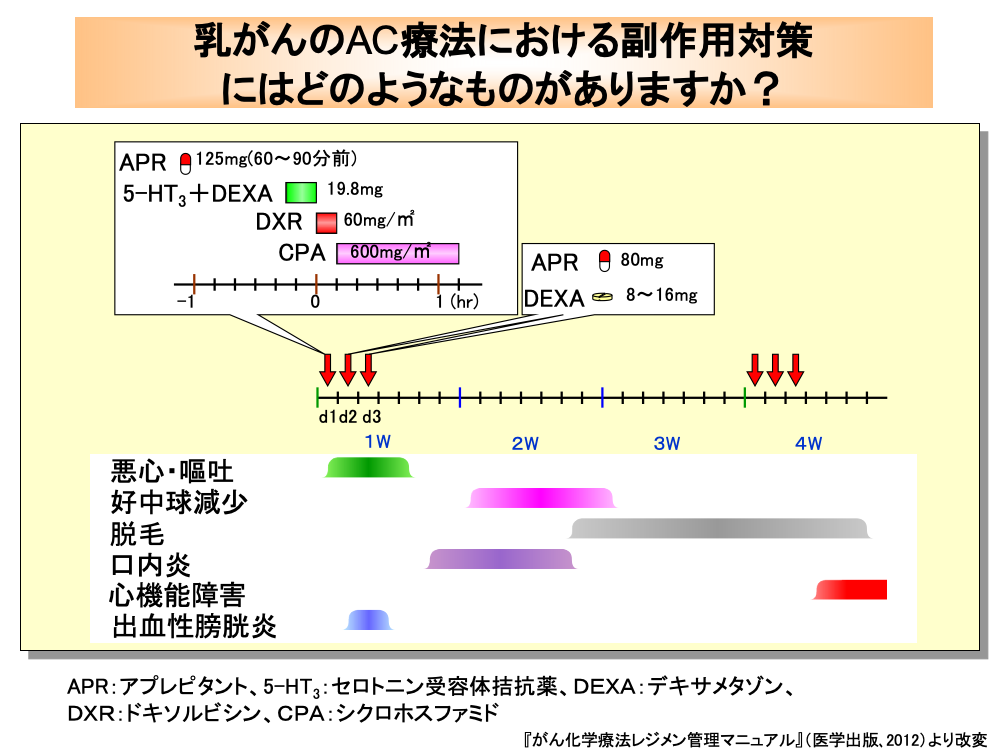
ホルモン受容体陰性かつHER2陰性の転移・再発乳がんに対しては、アントラサイクリン系またはタキサン系抗がん剤を含む化学療法が推奨されており、その代表的なレジメンのひとつにAC療法があります。
AC療法は、高度催吐性リスクの抗がん剤に分類されるため、投与前からの制吐薬投与が必要です。
各コースの初日には、アプレピタントを抗がん剤投与60~90分前に経口投与し、さらにセロトニン受容体拮抗薬とデキサメタゾンを50mLの生食に混ぜて抗がん剤投与15分前から点滴静注します。
続いて生食50mL+ドキソルビシン60mg/㎡を10分で点滴静注し、5%ブドウ糖液+シクロホスファミド600mg/㎡を60分で点滴静注します。
抗がん剤投与終了後は50mLの生食を点滴静注します。
また、遅発性悪心・嘔吐の予防のため2日目と3日目にアプレピタントとデキサメタゾンを経口投与します。
ドキソルビシンは、血管外漏出を起こすと皮膚壊死や潰瘍を生じるため、投与中に漏出が起きていないかどうか注意が必要です。
また、シクロホスファミドはこの量では出血性膀胱炎の発生頻度は低いものの、その予防策としてメスナの投与を行う場合もあります。
AC療法による好中球減少は8日目頃から出現しますが、口内炎は好中球減少の前触れとなることがあるので、予防のためのうがいを行い、口内炎出現時には外用液剤による含嗽や口腔用ステロイド塗布などの治療を行うとともに、発熱などにも注意を払う必要があります。
ドキソルビシン投与に伴う副作用として脱毛や心機能障害が発現しますが、脱毛は2週間前後から始まり、心機能障害は2コース目以降に発現してきます。
したがって、2コース目以降は動悸や息切れ、疲れやすい、足の浮腫(むくみ)などの自覚症状に注意を払う必要があります。
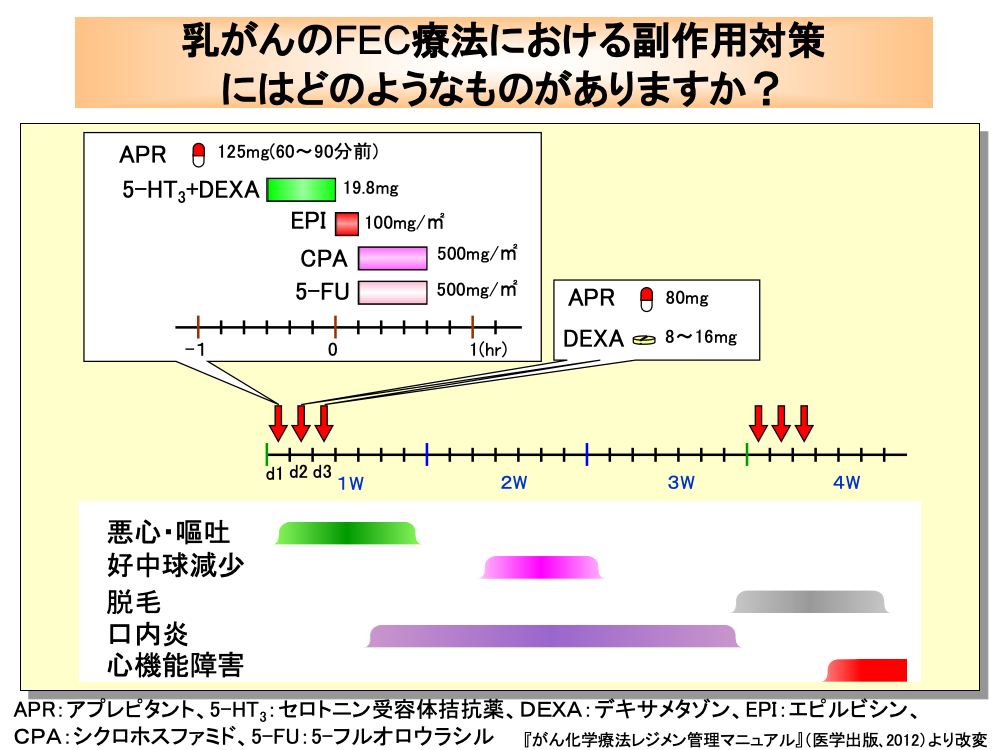
FEC(フェック)療法もホルモン受容体陰性かつHER2陰性の転移・再発乳がんに対して推奨されているレジメンです。
FEC療法に含まれるエピルビシン+シクロホスファミドの併用(EC療法)は、高度催吐性リスクの抗がん剤に分類されるため、制吐薬投与が必要となります。
AC療法と同様に、各コースの初日にはアプレピタントを抗がん剤投与60~90分前に経口投与し、さらにセロトニン受容体拮抗薬とデキサメタゾンを50mLの生食に混ぜて抗がん剤投与30分前から点滴静注します。
続いて、生食50mL+エピルビシン100mg/㎡を点滴静注し、シクロホスファミド500mg/㎡+5-フルオロウラシル500mg/㎡を250mLの生食に混ぜ、30分で点滴静注します。
抗がん剤投与終了後は50mLの生食を点滴静注します。
また、2日目と3日目にアプレピタントとデキサメタゾンを経口投与します。
好中球減少は11日目頃よりみられますが、口内炎は5日目ごろから現れるため、早い時期からうがいなどの口腔ケアが必要となります。
脱毛は2コース目前後から始まり、心機能障害は2コース目以降に発現してきます。
なお、AC療法やFEC療法などで制吐剤を用いるときは、副作用として便秘が現れることがあるので注意が必要です。
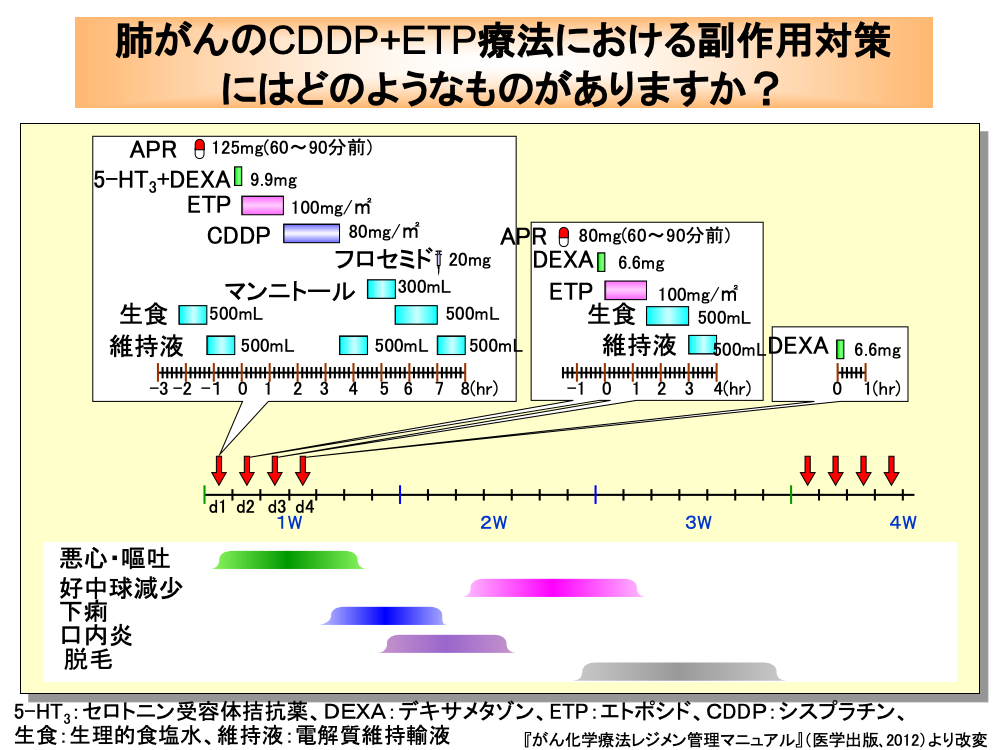
進展型の小細胞肺がんでは、シスプラチンとエトポシドの併用療法であるPE療法や、シスプラチンとイリノテカンの併用療法であるIP療法が推奨されています。
特に、イリノテカンで下痢や間質性肺炎が懸念される患者には、PE療法が適応となります。
PE療法では、シスプラチンの腎毒性軽減のため抗がん剤投与前から生食(生理食塩水)と維持液(電解質維持輸液)による水分負荷を行い、さらに悪心・嘔吐防止のため、アプレピタントとセロトニン受容体拮抗薬およびデキサメタゾンの投与を抗がん剤投与前に行います。
エトポシドは100mg/㎡を5%ブドウ糖液500mLに混ぜて投与し、シスプラチンは80mg/㎡を500mLの生食に混ぜてゆっくり投与します。
その後、維持液500mL、マンニトール300mL、生食500mL、フロセミド20mg、維持液500mLといった具合に水分負荷と利尿薬の投与を行います。
2日目と3日目にはエトポシドの投与と抗がん剤投与前のアプレピタントとデキサメタゾン投与、および抗がん剤投与後の生食と維持液による水分負荷を行います。
さらに、遅発性悪心・嘔吐の防止のため、4日目にデキサメタゾンの投与を行います。
抗がん剤投与中は便秘が出現することがあり、その後下痢が発現するため便秘・下痢の管理に気を配る必要があります。
口内炎は7日目頃から、好中球減少は10日目頃から認められます。
脱毛は3週目に入る頃から出現します。
また、蓄積毒性による末梢神経障害が2コース目以降に発現してくるため、注意が必要です。

EGFR 変異のない扁平上皮がん以外の非小細胞肺がんでは、カルボプラチン+パクリタキセル+ベバシズマブの3剤併用療法(CBDCA+PTX+BV療法)が標準的治療のひとつとなっています。
この3剤併用療法では、パクリタキセルによる過敏症反応および悪心・嘔吐を予防するため、抗がん剤投与前にセロトニン受容体拮抗薬、ヒスタミンH2受容体拮抗薬およびデキサメタゾンによる前投与を行います。
パクリタキセルは、200mg/㎡を500mLの生食に溶かして3時間以上かけてゆっくり投与します。
続いて、カルボプラチン(AUC=6)を250mLの生食に溶かして1時間点滴静注します。
ベバシズマブは、インフュージョン・リアクションを避けるため、15mg/kgを100mLの生食と混合して、初回は90分以上かけて点滴静注しますが、2回目は60分、3回目は30分に短縮が可能です。
便秘は初日から発現し、続いて好中球減少が8日目頃から出現します。
また、関節痛や筋肉痛も早期に出現します。
末梢神経障害や脱毛は3週目に入る頃から出現しますが、末梢神経障害はコース数の増加に伴い発現頻度が増加します。
また、ベバシズマブによる高血圧、タンパク尿、出血もコース数の増加とともに発現頻度が高くなります。
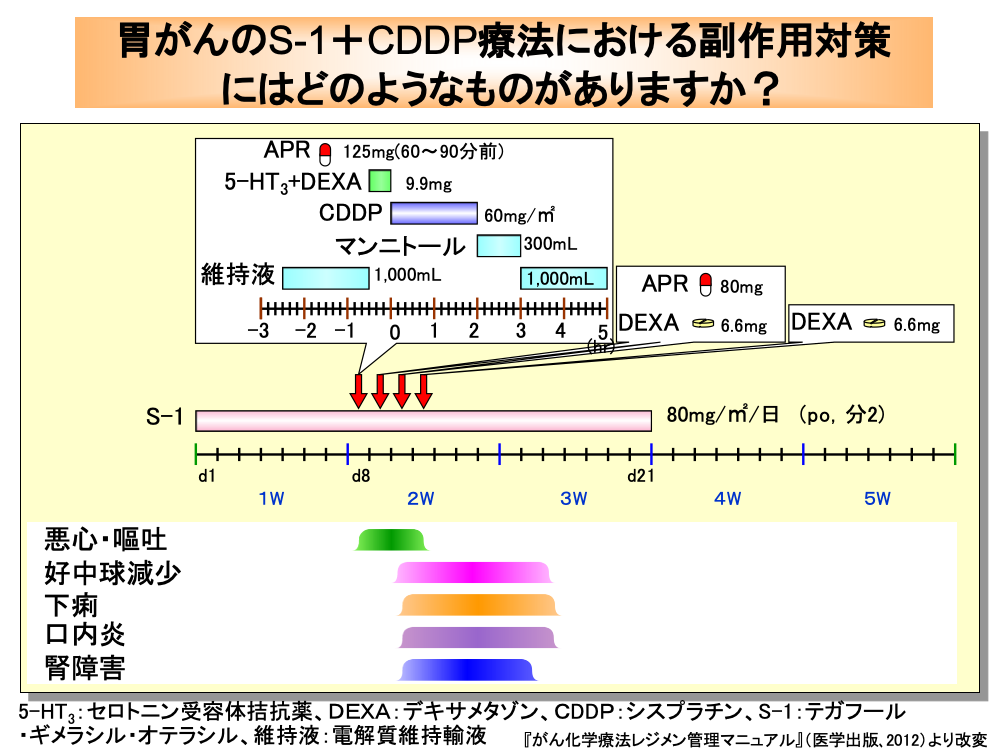
切除不能進行胃がんや再発胃がんでは、テガフール・ギメラシル・オテラシルとシスプラチンの併用療法(S-1+CDDP療法)が推奨されています。
テガフール・ギメラシル・オテラシルは、80mg/㎡/日を各コースの初日から21日目まで、朝夕2回に分けて経口投与します。
8日目にはシスプラチンを投与しますが、それに先立ち電解質維持輸液1,000mLを120分点滴静注します。
次いで悪心・嘔吐防止のため、アプレピタントをシスプラチン投与60~90分前に経口投与し、続いてセロトニン受容体拮抗薬とデキサメタゾンを点滴静注します。
シスプラチンは、60mg/㎡を1,000mLの生食に混合して120分かけて点滴静注します。
さらに、300mLのマンニトールと電解質維持輸液1,000mLを点滴して水分負荷と利尿を行います。
また、遅延性悪心・嘔吐防止のため、9日目と10日目にはアプレピタントとデキサメタゾンの、11日目にはデキサメタゾンの投与を行います。
テガフール・ギメラシル・オテラシルとシスプラチンの併用療法(S-1+CDDP療法)は、1コースが5週間で、4週目と5週目は休薬となります。
好中球減少、下痢、口内炎は10日目頃より出現します。
また、腎機能低下も10日目頃より現れます。
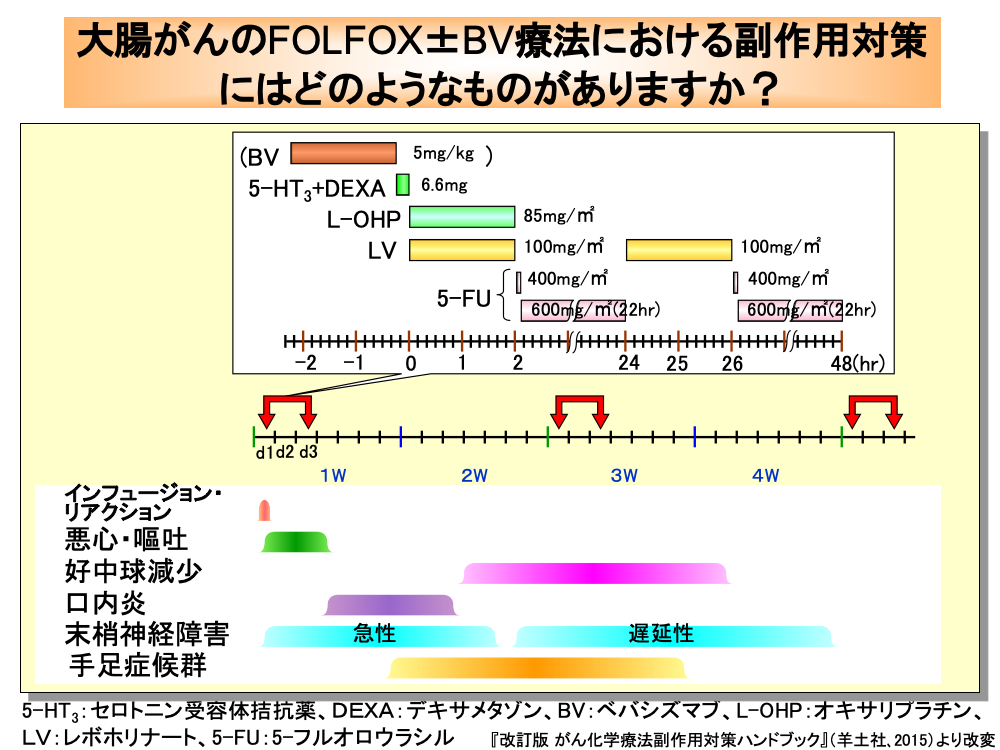
切除不能進行大腸がんや再発大腸がんの一次治療には、FOLFOX(フォルフォックス)療法やFOLFIRI(フォルフィリ)療法が用いられているほか、これらにベバシズマブ(BV)を加えた療法が行われています。
FOLFOX療法にはいくつかの投与スケジュールがありますが、FOLFOX4やmFOLFOX6が一般的に用いられています。
FOLFOX4は、初日に悪心・嘔吐防止のためセロトニン受容体拮抗薬およびデキサメタゾンの前投与を行い、次いでオキサリプラチン85mg/㎡とレボホリナート100mg/㎡を同時に2時間点滴静注します。
その後、50mLの5%ブドウ糖液に混合した5-フルオロウラシル400mg/㎡を急速点滴静注し、次いで600mg/㎡の5-フルオロウラシルを22時間かけて持続静注します。
2日目にはレボホリナートの2時間点滴静注、5-フルオロウラシルの急速点滴静注と22時間持続静注を繰り返します。
したがって、5-フルオロウラシルの静注が終わるのは3日目になります。
なお、ベバシズマブを併用する場合は、オキサリプラチン投与前に5mg/kgを初回は90分以上かけて点滴静注しますが、2回目には60分、3回目には30分で点滴静注します。
なお、ベバシズマブのみならずオキサリプラチンもインフュージョン・リアクションに注意が必要です。
FOLFOX療法における悪心・嘔吐のリスク度は、中等度に分類されています。
口内炎は、4日目頃から現れ、次いで好中球減少が10日目頃から出現します。
急性の末梢神経障害は、オキサリプラチン投与直後から発症し、遅延性の末梢神経障害は13日目頃から現れます。
手足症候群は、数週後から出現することが多いのですが、1週目から現れることもあります。
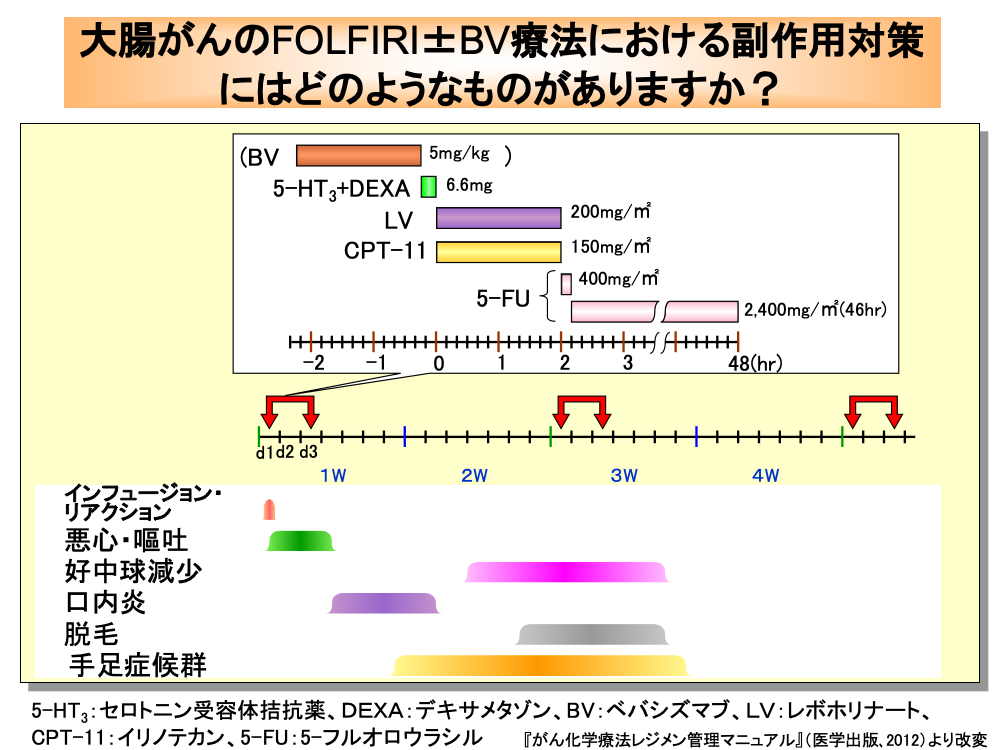
FOLFIRI(フォルフィリ)療法では、mFOLFOX6におけるオキサリプラチンをイリノテカンに置き換えた方法が用いられています。
FOLFIRI療法では、初日に悪心・嘔吐防止のためセロトニン受容体拮抗薬およびデキサメタゾンの前投与を行い、次いでイリノテカン150mg/㎡とレボホリナート200mg/㎡を同時に2時間点滴静注します。
その後、50mLの5%ブドウ糖液に混合した5-フルオロウラシル400mg/㎡を急速点滴静注し、次いで2,400mg/㎡の5-フルオロウラシルを46時間かけて持続静注します。
したがって、5-フルオロウラシルの静注が終わるのは3日目になります。
なお、ベバシズマブを併用する場合はインフュージョン・リアクションにも注意が必要で、イリノテカン投与前にベバシズマブ5mg/kgを初回は90分以上かけて点滴静注しますが、2回目には60分、3回目には30分で点滴静注します。
FOLFIRI療法における悪心・嘔吐のリスク度は、中等度に分類されています。
口内炎は、4日目頃から現れ、次いで好中球減少が10日目頃から出現します。
脱毛は、2週目の後半頃から出現します。
手足症候群は、数週後から出現することが多いのですが、1週目から現れることもあります。
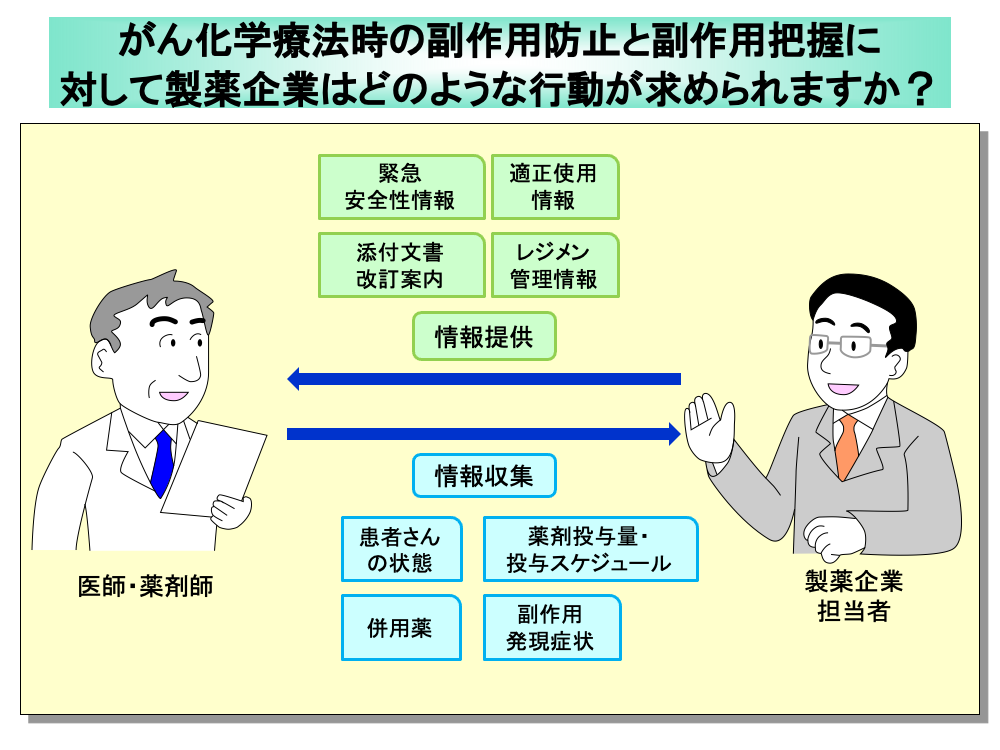
がん化学療法時の副作用防止のためには、緊急安全性情報や適正使用情報、添付文書改訂案内といった各種の情報を医療関係者に提供することが重要です。
さらに実際の投薬における細かいレジメン管理情報を医師・薬剤師に届けることにより、より綿密な副作用防止あるいは副作用対策が行うことができます。
このためには、個々の患者さんにおける情報収集が重要であり、副作用発現時の患者さんの状態や、薬剤投与量・投与スケジュールといった自社品に関わる情報のほか、併用薬に関する情報収集も必要です。
また、副作用発現症状やその程度(Grade)も把握して、未知の副作用や重篤な副作用であるか否かを判断しなければなりません。
これらのことを行うためには、自社品に関する情報だけでなく、他社の抗がん剤に対する知識あるいは副作用防止などに用いる薬剤を含めたがん化学療法に対する幅広い知識が必要となります。

がん化学療法施行時には抗がん剤同士の相互作用のみならず、合併症治療に用いられる薬剤との相互作用にも注意が必要です。
併用薬との相互作用により抗がん剤の効果が減弱したり、毒性が強くなったりすることのほか、逆に併用薬の効果減弱や毒性増強が起こることがあるので、これらの相互作用に対する確認も重要な仕事となります。
メトトレキサートは、NSAIDsとの併用により、メルカプトプリンは尿酸生成抑制薬との併用により、それぞれ毒性が増強されます。
フッ化ピリミジン系の薬剤は、ワルファリンやフェニトインの効果を増強して、抗凝固能の低下による出血や、フェニトイン中毒症状(嘔吐、眼振、運動障害など)を引き起こします。
ビンカアルカロイド系、タキサン系、イリノテカン、ボルテゾミブとエベロリムスなどの分子標的薬は、CYP3A4阻害作用を有するアゾール系抗真菌薬との併用により、毒性が増強されます。
また、ホルモン療法剤のタモキシフェンもCYP2D6阻害作用を有するパロキセチンとの併用により、毒性が増強されます。
このほか、ゲフィチニブ、エルロチニブ、ニロチニブなどの経口分子標的薬はプロトンポンプ阻害剤との併用により吸収が低下して、効果減弱を招きます。
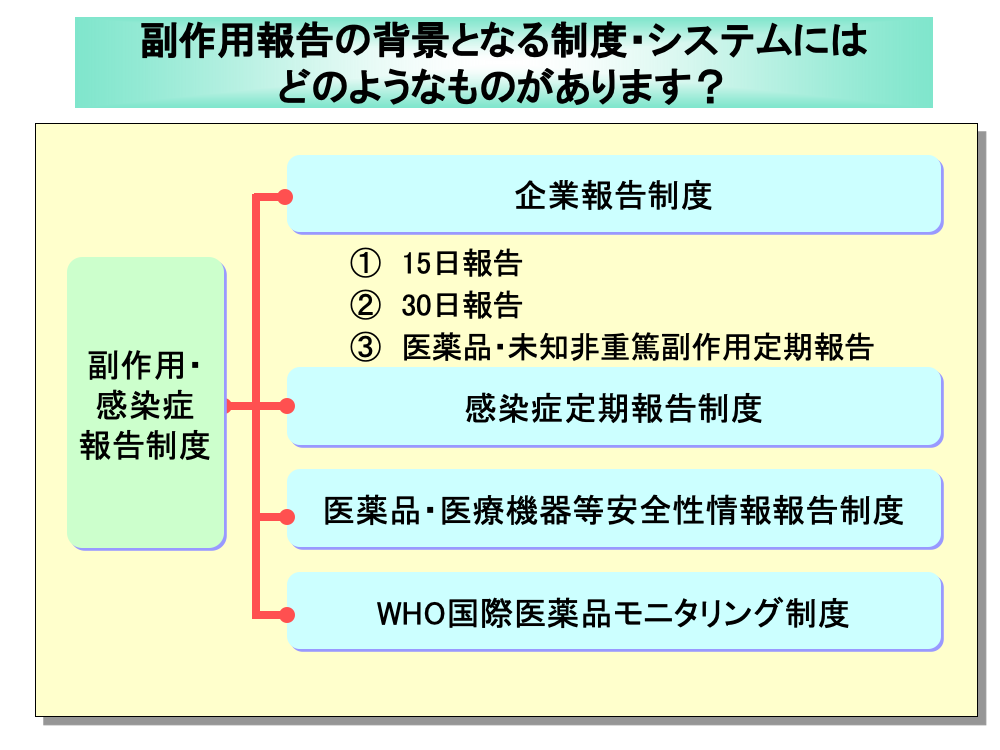
自社品を含むがん化学療法により副作用が発現した場合は、副作用・感染症情報の収集システムに従って、報告する必要があります。
わが国における医薬品の副作用・感染症情報の収集システムは、「企業報告制度」、「感染症定期報告制度」、「医薬品・医療機器等安全性情報報告制度」、「WHO国際医薬品モニタリング制度」から成り立っています。
企業報告制度には、15日報告、30日報告、医薬品・未知非重篤副作用定期報告が義務づけられています。

製薬企業が収集すべき「副作用」は、有害事象のうち当該医薬品との因果関係が疑われ、意図的でないものです。
つまり、医薬品有害反応(Adverse Drug Reaction)が「副作用」の意味で用いられています。
なお、医療関係者等から有害事象が自発的に報告された場合は、因果関係が不明であっても「副作用」とみなされ、報告の義務が生じます。
医療関係者が自発的に報告したということは、すなわち医薬品との因果関係を疑っているとみなされるためです。

副作用のうち、「使用上の注意」から予測できないものが「未知の副作用」に該当します。
具体的には、添付文書の「使用上の注意」の記載内容と、発現した事象の性質、重症度、特異性、転帰が一致しないものは「予測できない」、つまり「未知」とされます。
確信が持てない場合も「未知」として扱います。
また、予測性の判断に用いられる「使用上の注意」の項目は、狭義の「使用上の注意」の「その他の注意」を除く、全項目が対象であり、「警告」、「禁忌」、「効能・効果、用法・用量に関連する使用上の注意」も対象となります。

企業報告の種類と期限は、薬事法施行規則第253条に規定されています。
国内の副作用・感染症は、「重篤性」と「未知・既知」等により15日報告、30日報告などに分けられます。
副作用による未知・重篤症例は15日報告に該当します。
このうち、死亡症例は、製薬企業の安全管理統括部門から医薬品医療機器総合機構へファクシミリによる第一報が求められています。
未知・非重篤症例は、半年や1年ごとなどの定期的な報告を行います。
一方、既知・重篤症例は、承認後2年未満の新有効成分含有医薬品と市販直後調査により得られたものは15日報告ですが、それ以外は30日報告です。
報告期限の起算日は、「報告に必要な最低限の情報を含む、報告対象であることが判断できる情報を最初に受領した日」とされ、その日が0日目になります。
通常は、MRが自発報告を受けた日になります。
安全管理統括部門が「報告すべきと判断した日」ではないので、注意が必要です。
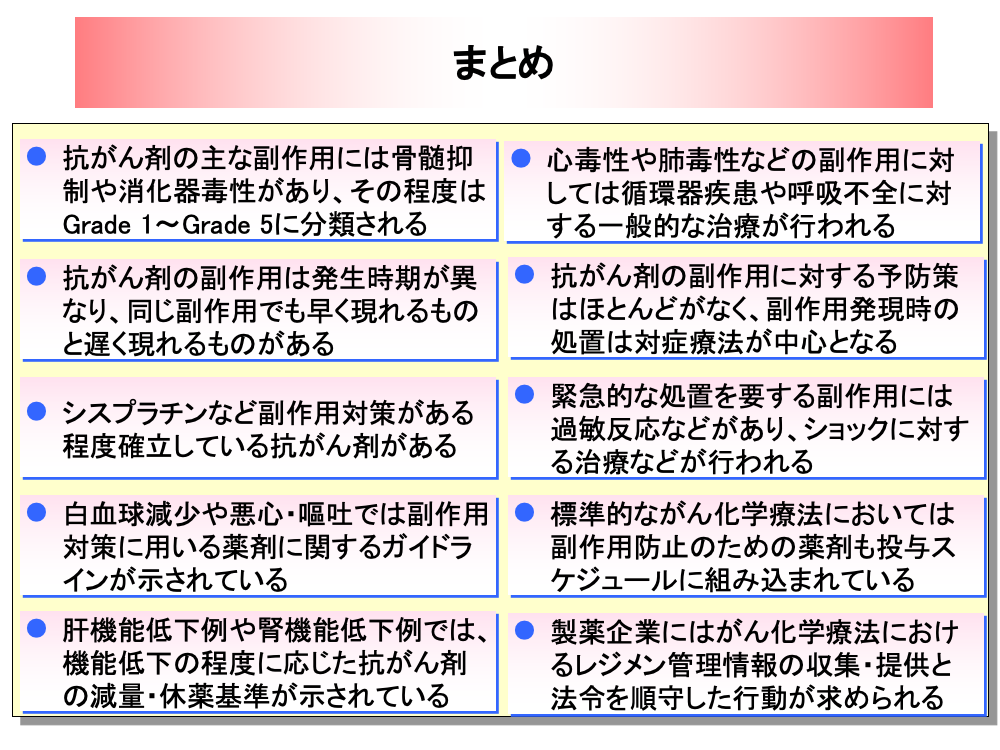
がん化学療法の副作用に関する項目をまとめてみます。
・抗がん剤の主な副作用には、骨髄抑制や消化器毒性があり、その程度はGrade 1~Grade 5に分類される
・抗がん剤の副作用は、発生時期が異なり、同じ副作用でも早く現れるものと遅く現れるものがある
・シスプラチンなど、副作用対策がある程度確立している抗がん剤がある
・白血球減少や悪心・嘔吐では、副作用対策に用いる薬剤に関するガイドラインが示されている
・肝機能低下例や腎機能低下例では、機能低下の程度に応じた抗がん剤の減量・休薬基準が示されている
・心毒性や肺毒性などの副作用に対しては、循環器疾患や呼吸不全に対する一般的な治療が行われる
・抗がん剤の副作用に対する予防策はほとんどなく、副作用発現時の処置は対症療法が中心となる
・緊急的な処置を要する副作用には過敏反応などがあり、ショックに対する治療などが行われる
・標準的ながん化学療法においては、副作用防止のための薬剤も投与スケジュールに組み込まれている
・製薬企業には、がん化学療法におけるレジメン管理情報の提供・収集と、法令を順守した行動が求められる





