がん化学療法の副作用対策入門(2)
抗がん剤の多くは肝臓で代謝されるため、肝臓の代謝能力を超える量の投与により肝障害を生じることがあります。
肝障害は抗がん剤自体により生じるほか、その代謝物によっても生じることがあります。
抗がん剤による肝障害の発生機序は、中毒性のものと特異体質性のものに分けられ、大半が中毒性の肝障害です。
中毒性の肝障害は用量依存性で投与開始後、数日から遅くとも8週までに発生します。
一方、特異体質性の肝障害は用量非依存性で即時型(Ⅰ型アレルギー)のものや2週間程度経ってから発現するもの(Ⅳ型アレルギー)があります。
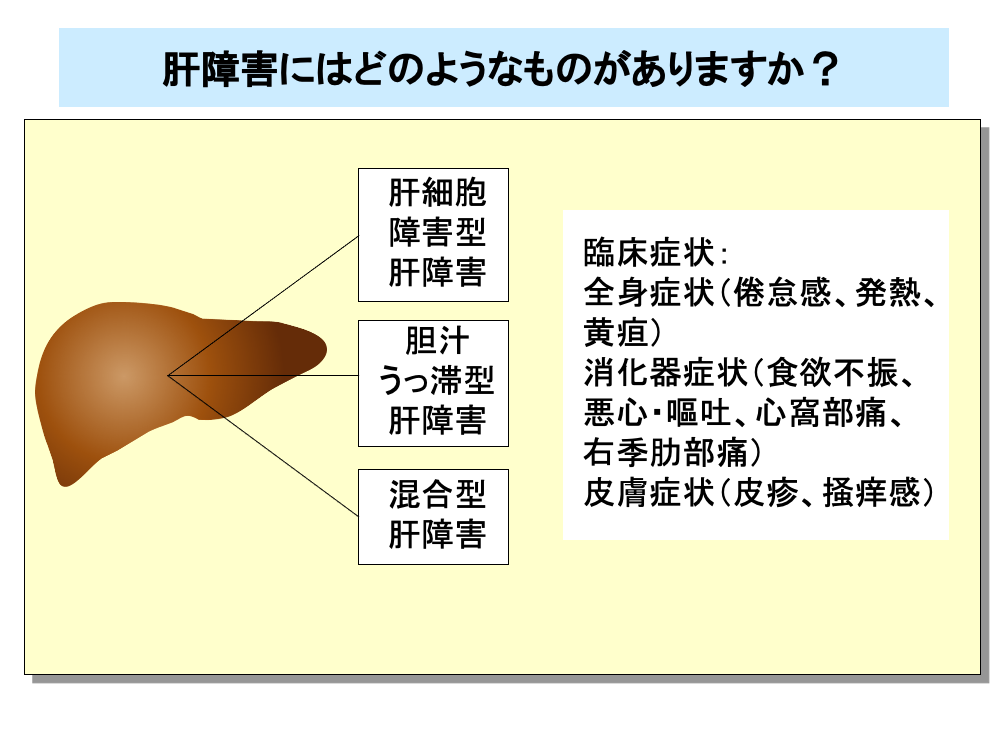
また、肝障害の型は他の薬物性肝障害と同様に、①肝細胞障害型、②胆汁うっ滞型、③混合型、に大別され、肝細胞障害型のものが多いことが知られています。
このほか、頻度の低い肝障害として血管内皮障害(veno-occlusive disease:VOD)があります。
VODは抗がん剤が血管内皮細胞を直接障害することにより肝の微小静脈の閉塞とその周囲の肝細胞の壊死をきたす肝障害です。
抗がん剤投与後に突然発症し、急激に増悪する場合が多く、疼痛を伴う肝腫大、急速に貯留する腹水、体重増加、ビリルビンの急激な上昇などをきたします。
肝障害の程度は血液検査により判断します。
アスパラギン酸アミノトランスフェラーゼ(AST)とアラニンアミノトランスフェラーゼ(ALT)の増加は肝細胞障害型、アルカリホスファターゼ(ALP)やγ-グルタミルトランスフェラーゼ(GGT)の増加は胆汁うっ滞型の肝障害と診断されます。
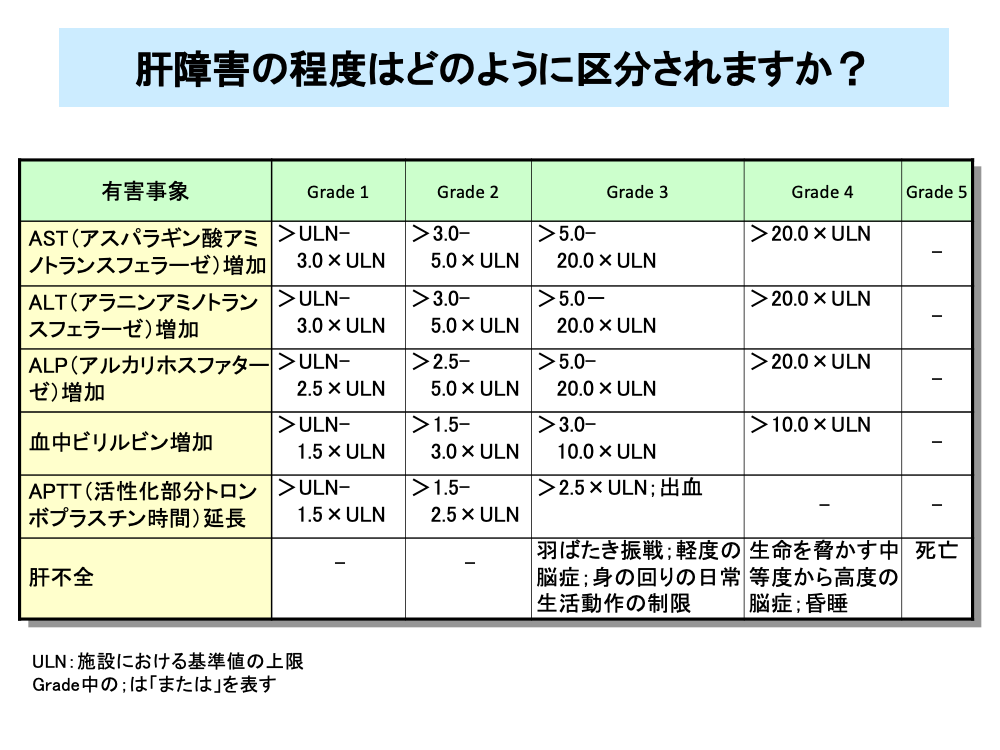
肝障害の程度は血液検査の値により分類されます。
肝障害が高度になり、肝不全に陥った場合はGrade 3以上の肝障害となります。
また、肝不全が進行した場合はGrade 4の肝障害となり、中等度から高度の脳症を発症し、最悪の場合は死に至ります。

肝障害をきたしやすい抗がん剤としては、シクロホスファミドなど多くの薬剤がありますが、シクロホスファミド自体には毒性はなくその代謝物が肝毒性を示します。
これらのうち、メトトレキサートやシタラビンは高頻度に肝障害を起こしやすく、シクロホスファミド、ブスルファン、アクチノマイシンD、メトトレキサート、シタラビンは高用量で高頻度に肝障害をきたしやすい薬剤です。
また、ブスルファン、メトトレキサート、シタラビンは不可逆的な肝障害を起こすので注意が必要です。

一般的な薬物性肝障害の予防策はありません。
治療中は定期的な血液検査により肝障害の早期発見に努めることが重要です。
まず、化学療法施行前に検査を行い肝障害の有無を調べ、肝障害を有する症例では、抗がん剤の減量を行います。
また、化学療法施行中に肝機能低下を認めた場合は、抗がん剤の減量や投与を中止します。
肝障害が進行性で全身状態の悪化がある場合には、抗がん剤投与を中止し、患者を入院させて治療を行います。
投与中止となる基準は、①総ビリルビン量が5mg/dL以上、②ALTが250IU/L以上といった中等度以上の肝障害を認めた場合です。
薬物性肝障害に対する治療法は確立されていませんが、多くの場合、軽度の肝障害では薬物投与中止により自然に改善します。
中等度以上の肝障害に対しては、抗がん剤投与を中止し、一般的な急性肝炎治療に準じて、安静臥床での経過観察、消化の良い食物による食事療法のほか薬物療法を入院治療で行います。
肝細胞障害型の肝障害に対する薬物療法は、ウルソデオキシコール酸100~200mg/回の1日3回経口投与やグリチルリチン製剤5~20mL/回を1日1回点滴静注することなどが一般的です。
ウルソデオキシコール酸は胆汁うっ滞型の肝障害に対しても第一選択薬として用いられます。
アレルギー性肝障害の場合は、プレドニゾロン20~50mg/回を1日1回経口投与します。
通常の薬剤では、薬剤のクリアランスが問題になることは末期の肝硬変以外にはあまりありません。
しかし、抗がん剤は治療域と毒性域の境界が近いため、わずかな肝機能障害によるクリアランスの低下が大きな毒性につながることとなります。
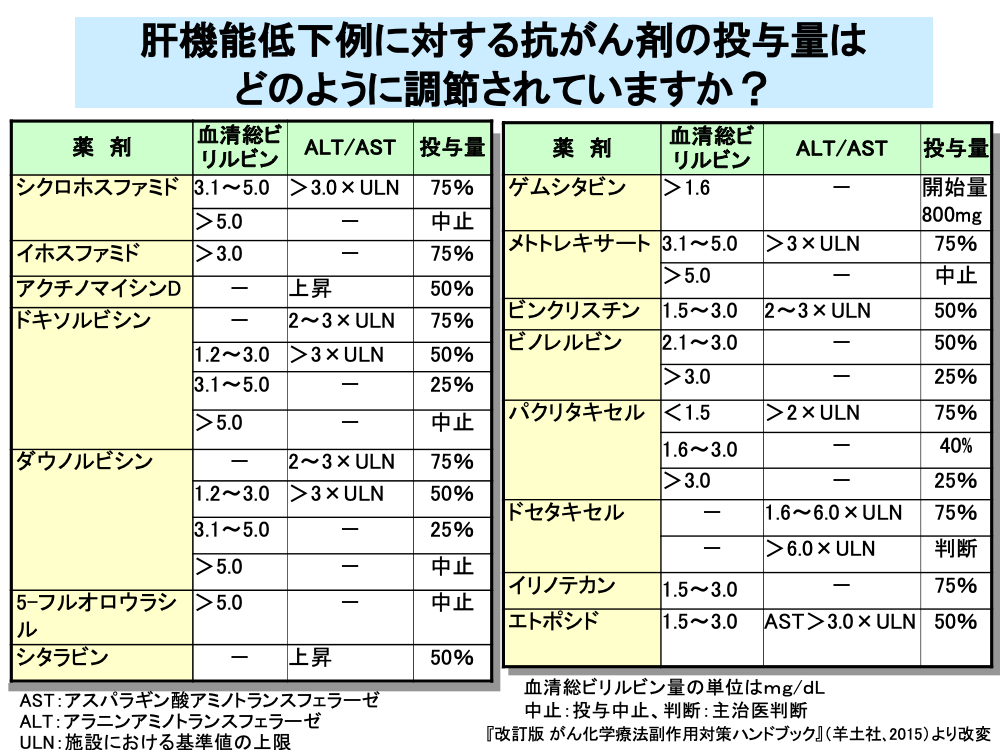
このため、多くの抗がん剤では肝障害時における減量基準が設定されています。
減量基準は血清総ビリルビン値とALTまたはASTの値をもとに決められていますが、これらの大半は経験的に設定されているものです。

抗がん剤による腎障害には急性腎不全のほか慢性腎不全(慢性腎臓病)があります。
腎臓は多くの抗がん剤の排泄に関与している臓器で、肝機能と同様に腎機能の低下は薬物の体内動態に大きな影響を与えるため、腎障害はがん化学療法の妨げとなります。
抗がん剤による腎障害の発症機序としては、薬剤による直接障害作用のほか、腫瘍崩壊症候群(tumor lysis syndrome:TLS)のような二次的作用があげられます。
また、腎障害は解剖学的に、腎前性、腎性、腎後性の3つに分類されます。
腎前性腎障害は、腎臓に到達する血液量が減少することにより起こるもので、がん化学療法中の下痢や嘔吐により引き起こされることがあります。
腎性腎障害は、毛細血管や糸球体の細胞が障害されて起こるもので、多くの抗がん剤やその代謝産物が腎糸球体や尿細管の直接的障害を引き起こすことが知られています。
腎後性腎障害は、尿路の閉塞などにより腎機能が低下するもので、腫瘍崩壊症候群により引き起こされるほか、抗がん剤やその代謝産物の結晶析出によっても発生します。
腎障害は、臨床所見として尿量減少や体重増加あるいは浮腫などにより、その発生を疑うことができ、血液検査と尿検査により腎障害の程度の把握が行われます。
このほか、腎エコーなどの画像所見も腎障害の把握に用いられることがあります。
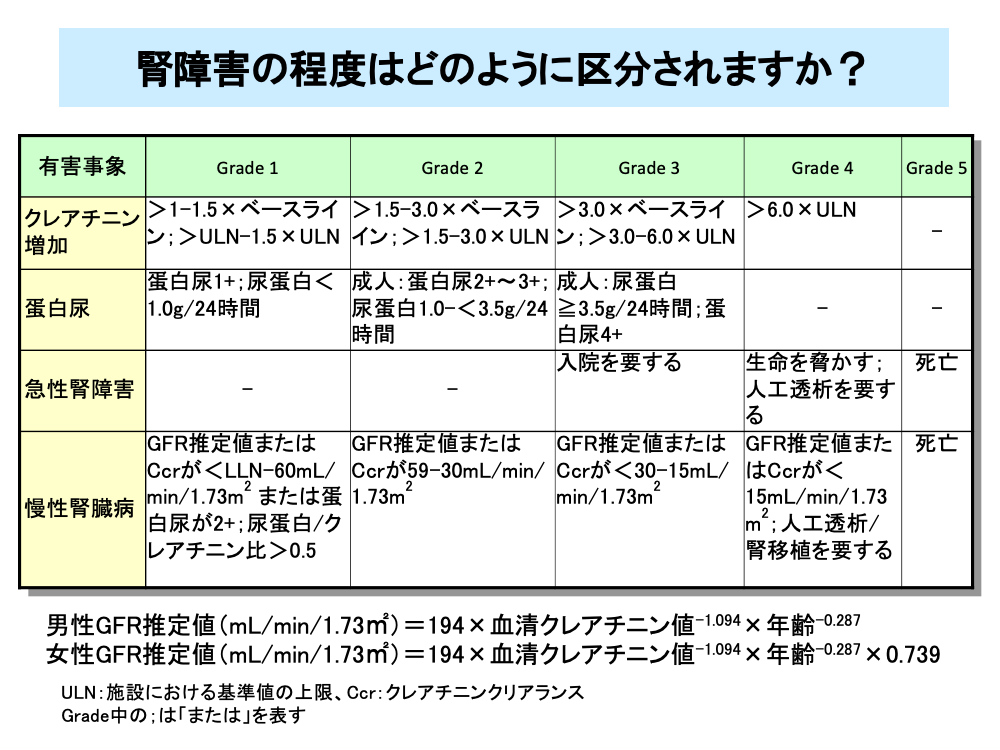
腎障害の程度はクレアチニン値や蛋白尿の程度により診断されますが、一般的な指標としてはGFR推定値(eGFR)や24時間クレアチニンクリアランス(Ccr)が用いられています。
国内のGFR推定値は、男性、女性とも血清クレアチニン値と年齢により求めることができます(男性;194×血清クレアチニン値-1.094×年齢-0.287に、女性;男性の値に×0.739)。
ただし、国際的にはGFR推定値はCockcroft-Gaultの式(eGFR=(140-年齢)×体重/72×血清クレアチニン値。
女性はこれに×0.85)が用いられています。
CTCAEでは各項目の定義を以下のように行っています。
・クレアチニン増加:臨床検査にて生体試料のクレアチニンレベルが上昇。
・蛋白尿:臨床検査で尿中に過剰に蛋白が認められる状態。
主にアルブミンであるが、グロブリンも含まれる。
・急性腎障害:急性(2週間以内)の腎機能低下であり、伝統的に、腎前性(腎臓への血流減少)、腎性(腎障害)、腎後性(尿管/膀胱流出路の閉塞)に分類される。
・慢性腎臓病:腎機能の段階的かつ通常は永久的な低下により腎不全に至る病態。
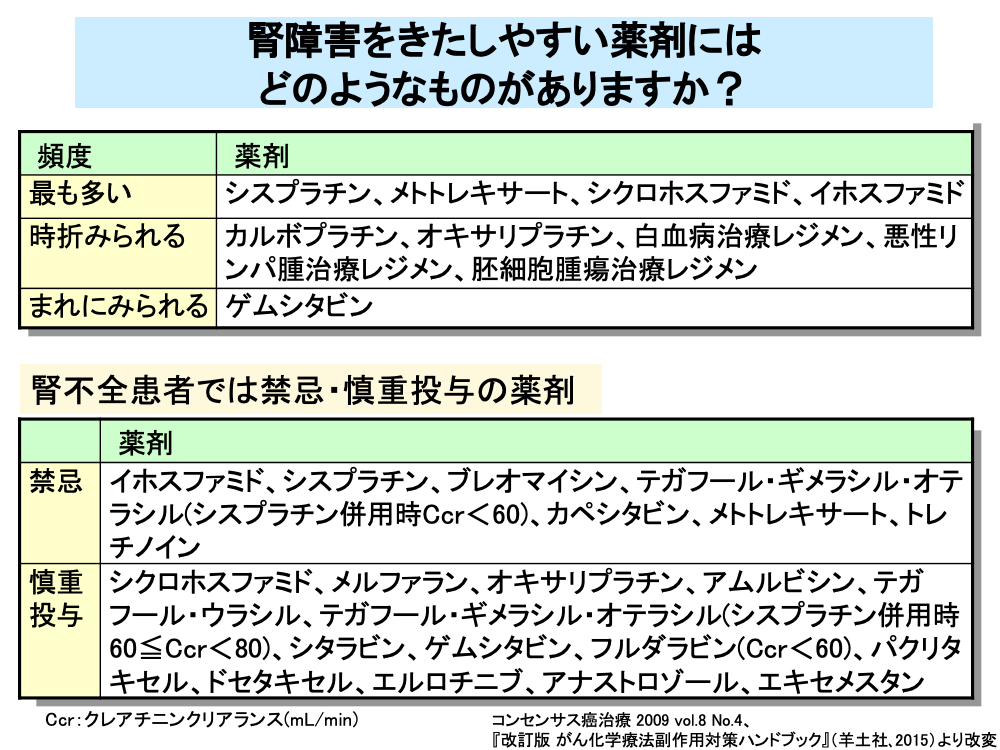
腎障害をきたしやすい抗がん剤としては、シスプラチン、メトトレキサート、シクロホスファミド、イホスファミドなどがあります。
シスプラチンは尿細管(主に近位尿細管)細胞に対する直接障害、メトトレキサートは原尿の酸性化に伴う結晶析出による遠位尿細管や集合管の障害、シクロホスファミドとイホスファミドは、近位尿細管に対する直接障害を引き起こすほか、シクロホスファミドとイホスファミドでは代謝産物であるアクロレインによる出血性膀胱炎を引き起こします。
腎障害が時折みられる抗がん剤には、カルボプラチン、オキサリプラチンのほか、白血病治療レジメン、悪性リンパ腫治療レジメン、胚細胞腫瘍治療レジメンがあります。
また、ゲムシタビンではまれに腎障害をきたすことがあります。
このほか血管新生阻害作用を持つ分子標的薬では、糸球体における血管内皮増殖因子の作用を抑制することにより、蛋白尿や血栓性微小血管障害を引き起こすことがあります。
シスプラチンをはじめとする腎障害をきたしやすい抗がん剤は、腎不全患者では投与禁忌となっており、テガフール・ギメラシル・オテラシルはシスプラチン併用時の腎機能低下例に対して投与禁忌となっています。
このほか、シクロホスファミドなどは腎不全患者では慎重投与となっています。
また、分子標的薬のエルロチニブ、ホルモン療法剤であるアナストロゾールやエキセメスタンも腎不全患者では慎重投与となっています。
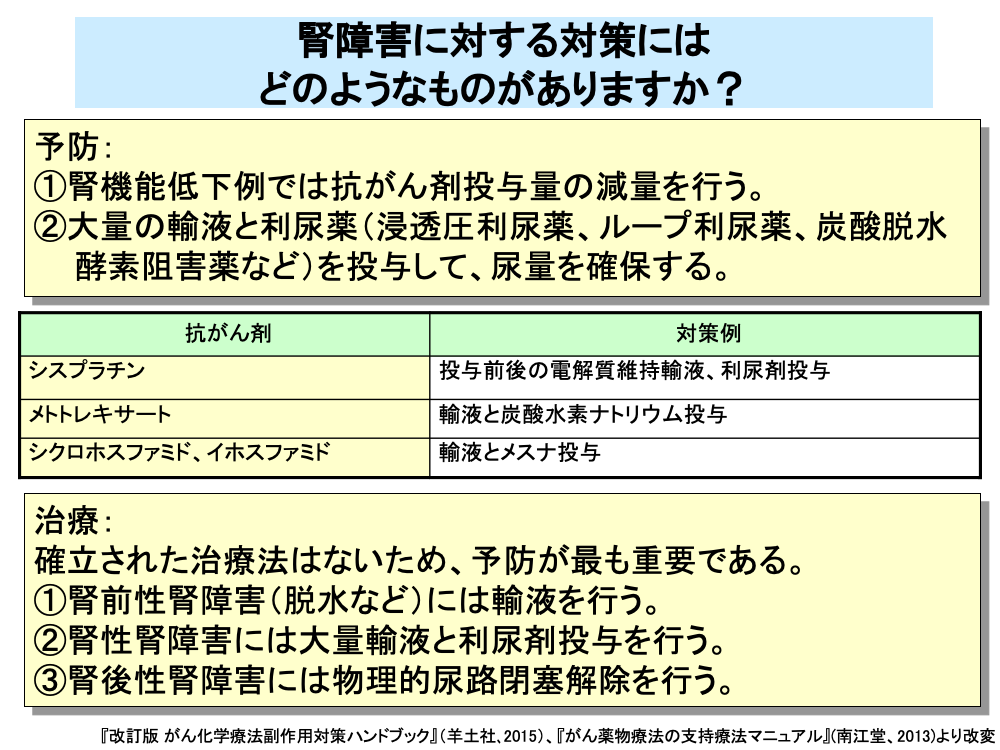
抗がん剤の腎障害に対しては、有効な治療法がないため予防が最も重要であり、腎機能低下例では抗がん剤の投与量を減量するとともに、定期的な血液検査と尿検査を行い、腎障害が生じないよう注意が払われます。
また、腎障害が生じやすい抗がん剤に対しては、抗がん剤投与前後に大量の輸液を行うとともに、各種の利尿薬を投与することにより、尿量の確保が行われます。
例えば、シスプラチンでは投与前後に1,000~2,000mLの電解質維持輸液とフロセミドやマンニトールなどの利尿剤を、4時間以上かけて投与することが行われています。
また、メトトレキサートでは腎尿細管における結晶化を防ぐために、投与前日から炭酸水素ナトリウムの投与により、尿のアルカリ化を図るとともに、輸液によるメトトレキサートの排泄促進を行います。
このほか、シクロホスファミドやイホスファミドでは出血性膀胱炎の予防目的で輸液とともに、メスナを投与します。
一方、腎障害が発生した場合は、確立した治療法や治療薬がないため、障害の程度に応じて抗がん剤の減量や投与を中止し、対症療法を行いながら腎機能の回復を待つことになります。
脱水などによる腎前性腎障害に対しては、輸液を行うことにより、腎糸球体の血流量の確保が行われます。
腎性腎障害に対しては、大量の輸液と利尿剤を用いることにより、尿量の確保が行われます。
尿細管内閉塞などによる腎後性腎障害に対しては、物理的な尿路閉塞解除が行われます。
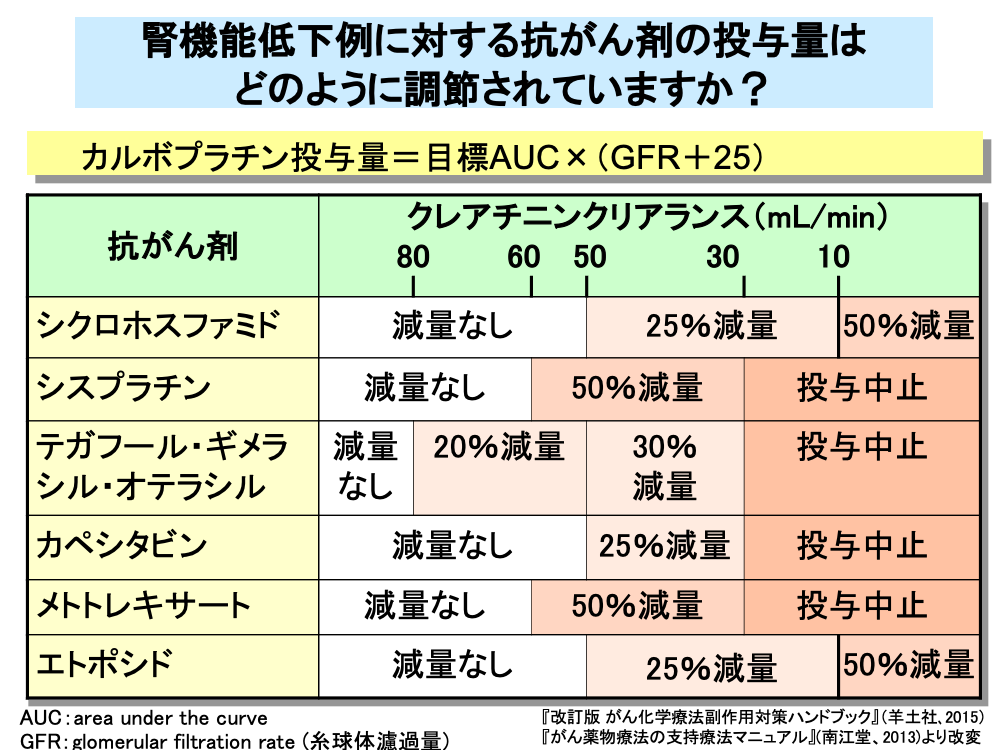
腎排泄率の高い抗がん剤は、腎機能低下時に排泄遅延による毒性が増強されるため、投与量の修正が必要となります。
カルボプラチンは、腎機能による投与量設定が確立されていますが、他の薬剤の多くは経験的な投与量設定であり、詳細な薬物動態解析に基づいた投与量修正はきわめてむずかしいのが現状です。
カルボプラチンでは糸球体濾過量(GFR)に25を加えた値を目標AUC値に掛けることにより、投与量を算出します。
その他の抗がん剤では、糸球体濾過量の代替値としてクレアチニンクリアランスを用いた減量基準が定められているものがいくつかあります。
シスプラチンとメトトレキサートでは、60mL/min以下、テガフール・ギメラシル・オテラシルでは80mL/min以下に腎機能が低下した場合に減量が行われますが、そのほかは50mL/min以下に腎機能が低下した場合に減量が行われます。
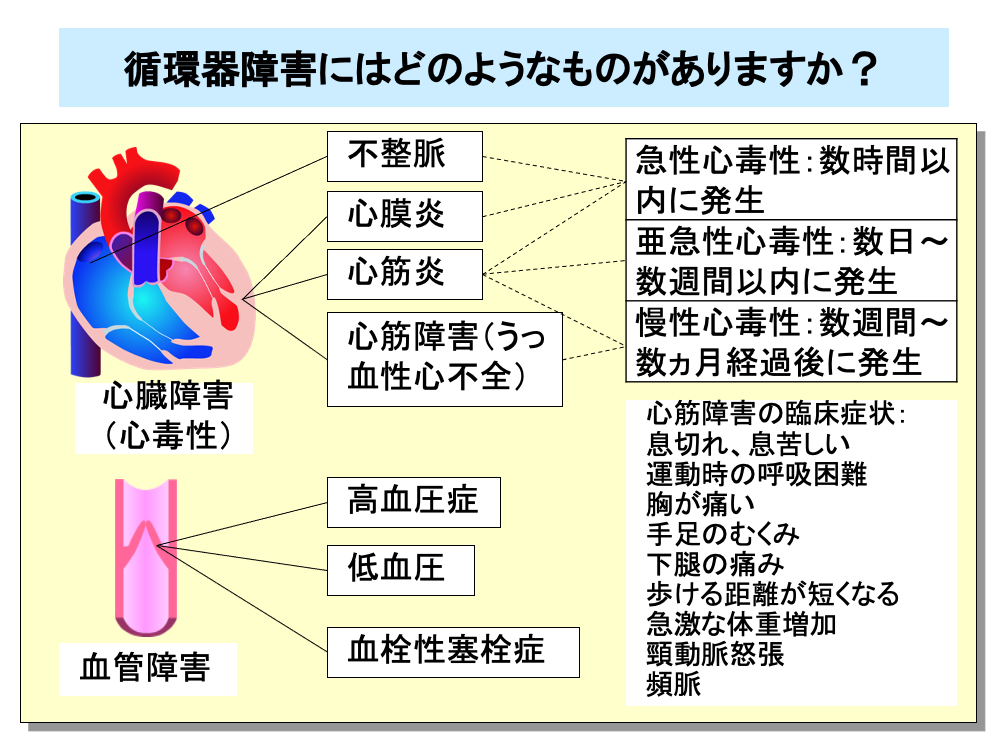
抗がん剤による循環器障害には、不整脈や心膜炎、心筋炎、心筋障害によるうっ血性心不全といった心臓障害(心毒性)や、高血圧症、低血圧、血栓性塞栓症などの血管障害があります。
心臓障害は、①投与後数時間以内に発生する急性心毒性(不整脈、心膜炎、心筋炎など)、②投与後数日から数週間以内に発生する亜急性心毒性(心筋炎、心外膜炎など)、③投与後数週間から数ヵ月以上経過してから発生する慢性心毒性(心筋炎、うっ血性心不全など)、の3つの型に分けられます。
心筋障害および心不全は、頻度は低いものの、重篤になる可能性があり、また不可逆的な副作用であるため注意が必要です。
心筋障害による臨床症状としては、息切れ、労作時呼吸困難(運動時の呼吸困難)、胸痛、下肢の浮腫、頸動脈怒張、頻脈など通常の心不全の症状であるため、抗がん剤との関連の鑑別が難しくなります。
血管障害の多くは発現時期が定まっていませんが、高血圧は投与開始から数ヵ月以内に発症することが多いことが知られています。

心膜炎や心不全では、検査所見で異常がみられても症状がみられない場合はGrade 1に分類されます。
高血圧は病的な血圧の上昇で、CTCAEではGrade1、2については成人、小児、青年に分けています(スライドは成人のみを表示)。
血栓症は血液に乗って末梢から移行してくる血栓による血管の閉塞です。
Gradeの基準は内科的治療の緊急度から分類しています。
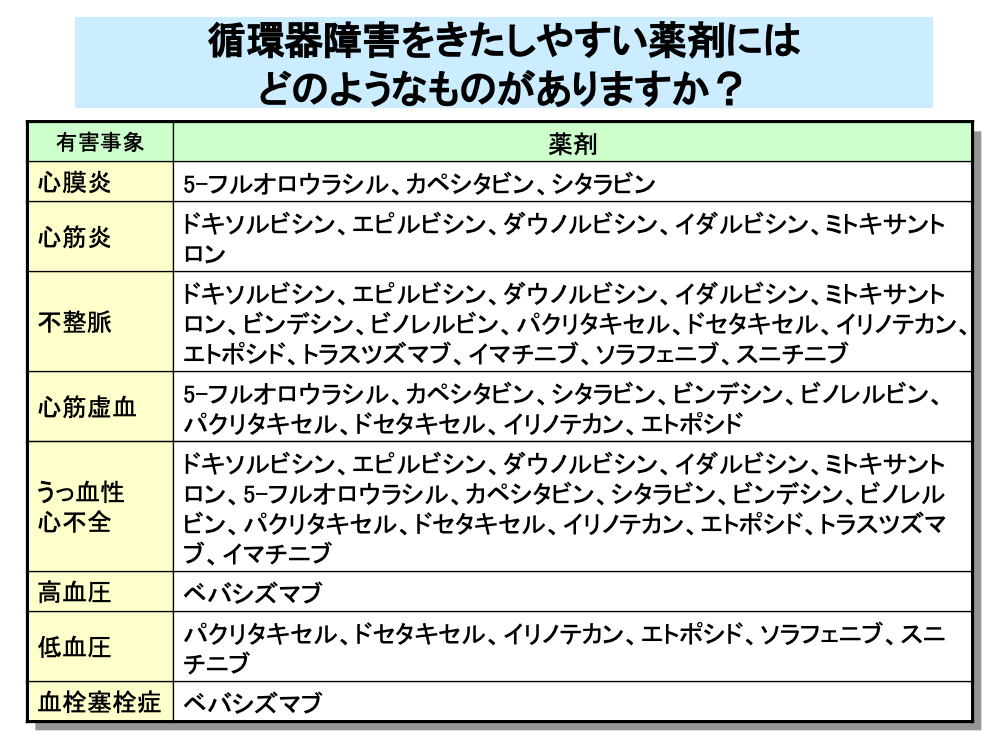
5-フルオロウラシルなどの代謝拮抗剤は、心膜炎のほか心筋虚血やうっ血性心不全などの心毒性に注意が必要です。
ドキソルビシンをはじめとするアントラサイクリン系抗がん剤は、累積投与量の増加に伴い心毒性の発現頻度が増加することが知られています。
ビンデシンなどの植物由来製剤も、うっ血性心不全や不整脈などの副作用が報告されており、これらの副作用はトラスツズマブなどの分子標的薬でも起こります。
一方、ベバシズマブなど血管新生阻害に働く分子標的薬では、高血圧や血栓塞栓症といった副作用が問題となります。
植物由来製剤とソラフェニブなどの分子標的薬では、副作用として低血圧も発現します。
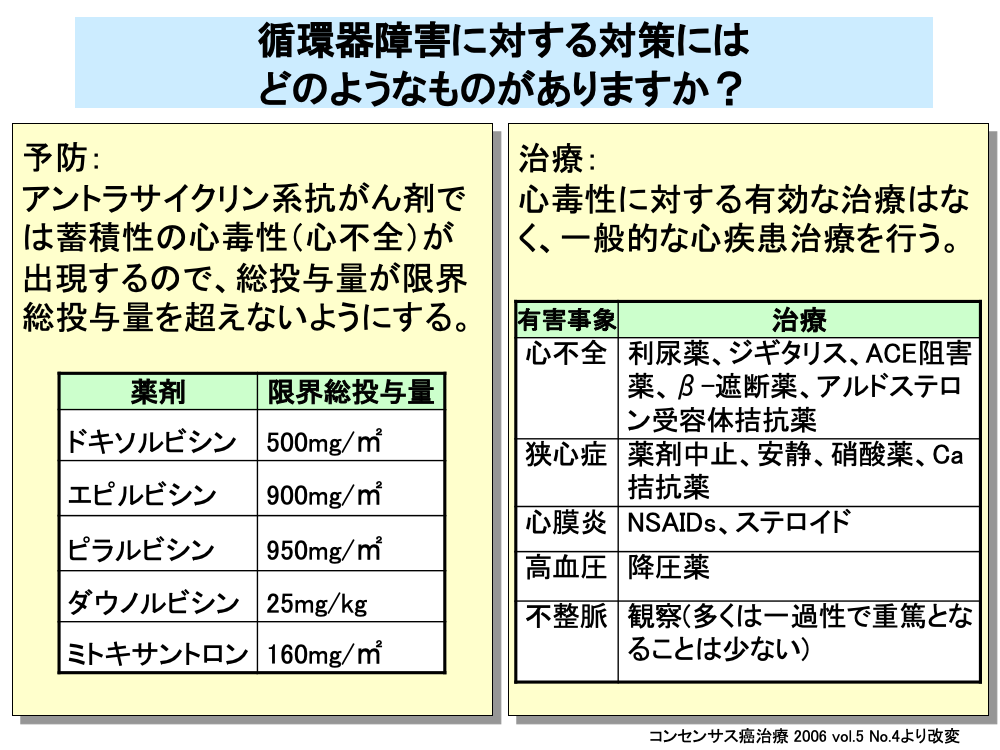
心毒性は不可逆的な場合が多く、併用する抗がん剤により、心毒性が増強しないよう注意が必要となります。
特に、アントラサイクリン系抗がん剤の使用にあたっては、前治療におけるアントラサイクリン系抗がん剤の総投与量も考慮に入れて、累積投与量が限界を超えないように注意を払う必要があります。
例えば、ドキソルビシンの場合は、総投与量が300mg/㎡に達したときに心エコーを行い、左室駆出率をチェックするなどの検査が必要で、総投与量が500mg/㎡となった時点で投薬中止となります。
他のアントラサイクリン系抗がん剤も同様に、エピルビシンでは900mg/㎡、ピラルビシンでは950mg/㎡、ミトキサントロンでは160mg/㎡、ダウノルビシンでは25mg/kgが投与中止となる限界総投与量です。
これ以外の薬剤についても治療開始前から十分な心機能評価を行うとともに、定期的な心機能評価を行うことが心毒性の早期発見につながります。
高血圧や低血圧に対しては、定期的な血圧検査が重要となります。
また、血栓症の予防としては、抗血栓薬である低分子ヘパリンやワルファリンの投与も可能ですが、出血リスクに注意を払う必要があります。
一旦、心毒性が発生した場合は有効な治療法はなく、一般的な心疾患治療が行われます。
心不全に対しては、利尿薬、ジギタリス、ACE阻害薬、β-遮断薬やアルドステロン受容体拮抗薬などが、狭心症に対しては、薬剤中止、安静のほか硝酸薬やCa拮抗薬の投与が、心膜炎に対してはNSAIDsやステロイドの投与が、高血圧に対しては降圧薬の投与がそれぞれ行われます。
不整脈の多くは一過性であり、重篤となることは少ないため、特に治療は行わず経過観察となります。
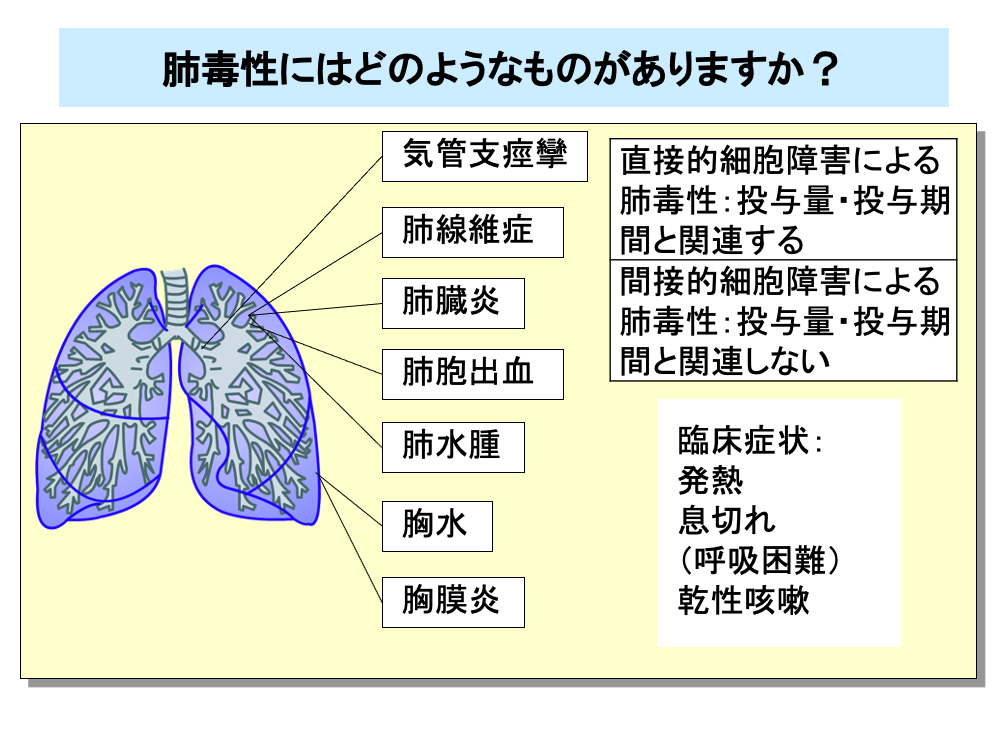
肺毒性は薬剤性肺障害とも呼ばれ、殺細胞性抗がん剤のみならず、分子標的薬など多くの薬剤で生じる副作用です。
肺毒性は、気道や肺胞の上皮細胞に対する直接的な細胞障害のほか、免疫細胞の活性化による間接的な障害により発生すると考えられています。
直接的な細胞障害による肺毒性は、投与量や投与期間と関連があり、数週間から数年の間に起こります。
免疫細胞の活性化による肺毒性は、アレルギー性のものであり、投与量や投与期間との関連はほとんどありません。
肺毒性には、気管支痙攣、肺線維症、肺臓炎、肺胞出血、肺水腫、胸水、胸膜炎をはじめとしてさまざまなものがあり、臨床症状や身体所見は各病型により異なります。

肺線維症は、画像所見上の線維化の度合いにより分類が行われています。
肺臓炎や胸水は、臨床所見や検査所見で異常が認められても症状がなければGrade 1となります。
肺水腫では、安静時においても呼吸困難がみられる場合は、Grade 3になります。
CTCAEでは各項目の定義を以下のように行っています.。
・肺線維症:結合組織による肺組織の置換。
進行性の呼吸困難、呼吸不全、右心不全の原因となる。
・肺臓炎:肺実質の局所性またはびまん性の炎症。
・肺水腫:肺組織への液体の貯留、ガス交換障害を引き起こし肺機能不全を生じ得る。
・胸水:胸腔内滲出液の増加。
息切れ、咳、著しい胸部の不快感を伴う。

いずれの抗がん剤も肺毒性を生じますが、古いものではブレオマイシンによる肺線維症とそれに続く間質性肺炎が有名で、このためブレオマイシンは300mgが限界総投与量となっています。
また、ゲフィチニブによる間質性肺炎も発売時に問題となりましたが、ゲフィチニブでは男性、喫煙者などが肺毒性のリスクファクターとなることが明らかにされています。
このほか、マイトマイシンCやメトトレキサート、シクロホスファミドなども肺毒性発現頻度の高い薬剤です。
肺毒性は、肺線維症や間質性肺炎を合併している患者で生じやすいことが知られており、このため間質性肺炎合併患者に対しては、イリノテカン、ゲムシタビン、アムルビシンは投与禁忌であり、テガフール・ギメラシル・オテラシルなどの薬剤では慎重投与となっています。
なお、ゲムシタビンは放射線治療との併用で肺がん治療に用いられることも多いですが、同時併用では肺臓炎などによる死亡例が報告されているため、放射線治療との同時併用は禁忌となっています。

肺毒性は、間質性肺炎や肺線維症がもともと存在している患者で発生しやすいことが知られています。
このほか、高齢者、喫煙者、腎障害合併例、肺への放射線照射歴のある患者で発生リスクが高まることが知られており、これらの高リスク患者では慎重投与が必要です。
このような高リスク患者では、投与前および投与中に胸部X線写真や胸部CT(HRCT)像をとり、KL-6、SP-Dなどの血液検査を行うほか、咳(ときに乾性)や呼吸困難などの症状がないかを確認します。
肺毒性(薬剤性肺障害)が疑われる場合は、さらに細かい臨床検査を付け加えるとともに感染症などとの鑑別診断のための検査を行い、気管支内視鏡を用いた気管支肺胞洗浄(BAL)や経気管支肺生検により得られた標本による肺病理所見検査結果をもとに鑑別診断を行います。
なお、スライド中の各略号は以下のことを示しています。
HRCT(高分解能CT)は薄層CTともいい、通常のCT検査よりも薄い(1~2mm)人体断面の病変を描出できる性能をもった高性能のCT。
肺がんや間質性肺炎などの診断に有効な機器です。
KL-6(シアル化糖鎖抗原)はヒト肺腺がんに対してつくられた単クローン性抗体が認識するシアル化糖鎖抗原の1つで、正常なⅠ型肺胞上皮細胞や気管支腺細胞でも産生され、間質性肺炎患者の血中で増加します。
SP-A、D(サーファクタントプロテインA、D)はⅡ型肺胞上皮細胞で産生されるリン脂質-タンパク複合体で、間質性肺炎患者の血中で増加します。
DLST(リンパ球刺激試験)はリンパ球の免疫機能を調べる検査。
ヒトリンパ球を薬疹の原因と想定される薬剤の共存下で培養すると活性化が生じ、サイトカインや免疫グロブリンの産生が亢進します。
この際の放射性チミジンの取り込みを検出するものです。
BAL(気管支肺胞洗浄)は気管支鏡を介して、気管支内に生理食塩水を注入し、肺胞や末梢気道を洗浄、その回収液の細胞成分や液性成分を解析する方法です。

肺毒性(薬剤性肺障害)の治療における基本は、①被疑薬の中止、②ステロイド剤の投与、③呼吸不全への対策と全身管理です。
これらのうち、被疑薬の中止は必須条件となります。
ステロイド剤の投与は、重症度により方法が異なります。
呼吸不全をきたしているような重症例では、ステロイド大量療法(ステロイドパルス療法)を行います。
ステロイド大量療法では、まずメチルプレドニゾロン1日1gを3日間経口投与します。
効果を確認しながら、これを1週おきに1~4回繰り返します。
軽症例では、ステロイド漸減療法を行います。
ステロイド漸減療法は、メチルプレドニゾロン1日0.5~1.0mg/kg程度で開始し、4週間服用後を目途に2~4週ごとに5~10mgずつ減量してゆきます。
呼吸不全への対策としては、酸素吸入などを行います。
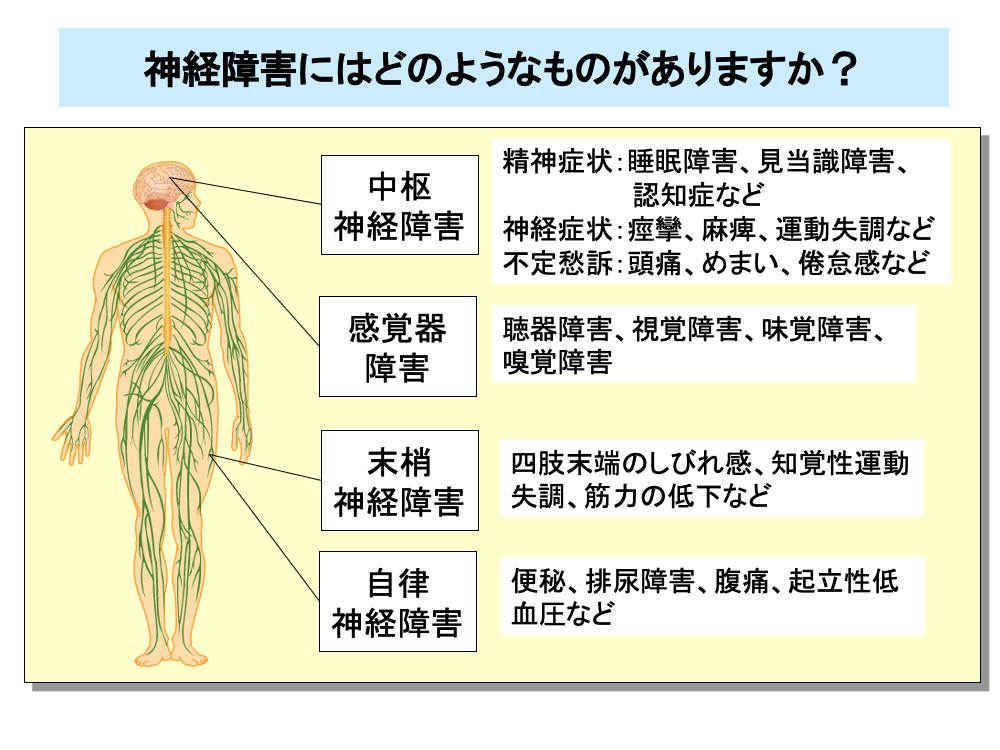
抗がん剤による神経障害は、中枢神経障害と末梢神経障害に大別されます。
中枢神経障害には、①睡眠障害、見当識障害、認知症などの精神症状、②痙攣、麻痺、運動失調などの神経症状、③頭痛、めまい、倦怠感などの不定愁訴があるほか、感覚器障害も含まれます。
感覚器障害には、聴力低下、耳鳴、平衡障害といった聴器障害のほか、網膜症、視神経炎などの視覚障害や味覚障害、嗅覚障害があります。
中枢神経障害は生命に関わるものがあり、注意が必要です。
末梢神経障害には、四肢末端のしびれ感、知覚性運動失調、筋力の低下などがあり、患者のQOLを著しく低下させる有害事象の1つです。
末梢神経障害は、最も発症頻度の高い神経障害で、ほかの神経障害よりも早期に出現します。
また、末梢神経障害には、便秘、排尿障害、腹痛、起立性低血圧などの自律神経障害があります。
神経障害が起こる機序は、不明な点が多く、神経細胞への直接障害のほか、神経軸索の変性・脱髄や微小管の損傷などが考えられています。

神経障害のうち、認知障害や浮動性めまいなどでは生命を脅かすまでには至りませんが、末梢性運動ニューロパチーや末梢性感覚ニューロパチーでは死に至ることがあります。
脳の白質部分が障害を起こす白質脳症は死亡率の高い副作用で、発現症状の程度とMRI検査結果によりGradeが決定されます。
CTCAEでは各項目の定義を以下のように行っています。
・認知障害:認知機能の著しい変化。
・浮動性めまい:浮遊感、ふらつき、目のくらみ、回転する感覚、揺れる感覚などの症状。
・末梢性運動ニューロパチー:末梢運動神経の損傷または機能障害。
・末梢性感覚ニューロパチー:末梢知覚神経の損傷または機能障害。
・白質脳症:非炎症性の多発壊死巣を伴う、びまん性反応性の星状膠細胞の増多。

中枢神経障害をきたしやすい抗がん剤としては、イホスファミドやL-アスパラギナーゼのほか、5-フルオロウラシルなどの代謝拮抗剤や、リツキシマブなどの分子標的薬があります。
このうち、5-フルオロウラシルをはじめとするフッ化ピリミジン系抗がん剤(5-フルオロウラシル、テガフール製剤、ドキシフルリジンなど)では、白質脳症を引き起こすことがあります。
白質脳症は、2/3の症例が死亡する重大な副作用であり、注意が必要です。
また、フッ化ピリミジン系抗がん剤は、嗅覚障害をきたすことが知られています。
末梢神経障害をきたしやすい抗がん剤としては、シスプラチンをはじめとする白金製剤(シスプラチン、カルボプラチン、ネダプラチン、オキサリプラチン)や代謝拮抗剤、植物由来製剤、分子標的薬があります。
シスプラチンやオキサリプラチンでは、総投与量の増加に伴い四肢末梢における感覚鈍麻などの蓄積性の神経障害が発生します。
なお、これらの薬剤による末梢神経障害は知覚障害であり、運動神経は障害されません。
オキサリプラチンでは、総投与量が800mg/㎡を超えると四肢末梢における知覚障害が生じるほか、投与開始数時間後から四肢、喉頭、口唇などにしびれ、ピリピリ感などが生じる急性末梢神経障害が出現します。
また、タキサン系抗がん剤であるパクリタキセルやドセタキセルでは、高頻度に四肢の感覚異常が引き起こされ、薬剤の用量規制毒性(Dose Limited Toxicity:DLT)となっています。
このほか、シスプラチン、ビンクリスチン、ビンブラスチン、パクリタキセルでは、聴覚障害をきたすことがあります。
視覚障害をきたしやすい抗がん剤には、白金製剤、代謝拮抗剤、ホルモン製剤、分子標的薬などさまざまな種類の薬剤があります。

中枢神経障害、末梢神経障害とも、確立された予防法や治療法はありません。
このため、日常生活動作などから早期発見を行うことが重要となります。
中枢神経障害の徴候としては、歩行時にふらつく、口がもつれる、物忘れが多い、性格が変わったなどがあり、このほかに物が二重に見える、聞こえずらい、味覚が変わる、臭いが感じられないなどの感覚器異常があります。
末梢神経障害の徴候としては、手足の先がしびれるといった知覚異常のほかに、ボタンが留めずらい、つまずきやすい・転びやすい、手足に力が入らない、リモコン操作がしにくいなどがあります。
抗がん剤による中枢神経障害が疑われる場合は、可能な限り早期に抗がん剤投与を中止することが推奨されています。
また、各障害に対する症状軽減が図れる薬剤がある場合には、これらにより症状軽減のための対症療法を行います。
末梢神経障害が疑われる場合は、障害の重症度を評価した上で抗がん剤の減量あるいは投与中止を行い、症状が軽減した時点で投与の再開などが検討されます。
それとともに症状軽減のための対症療法を行います。
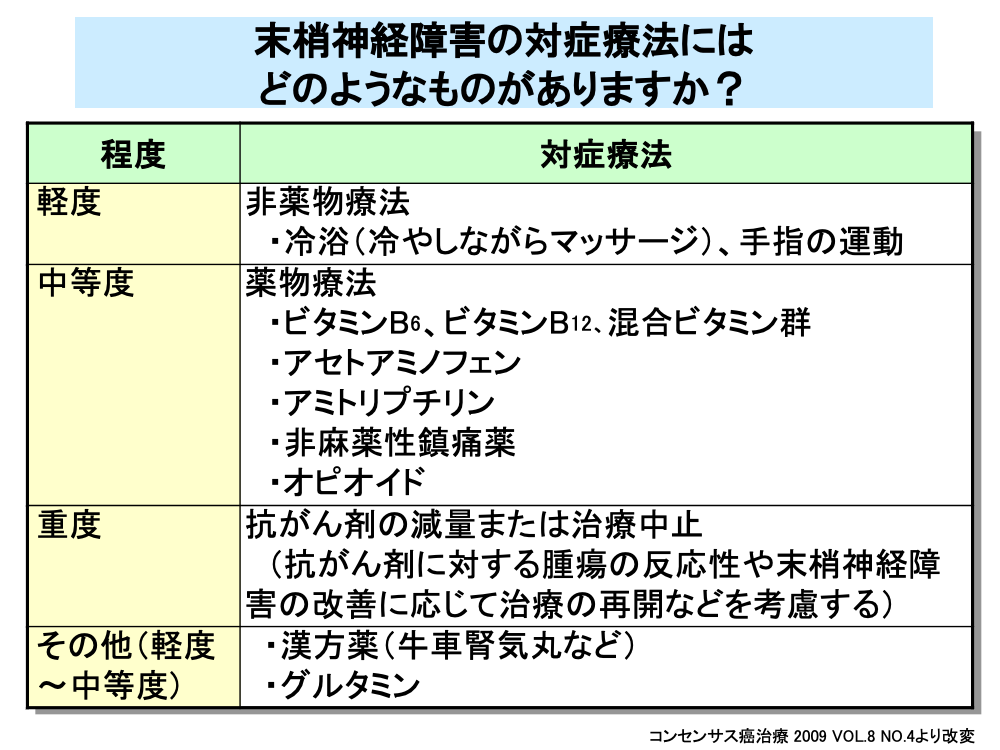
末梢神経経障害に対しては、重症度により異なる対症療法が用いられます。
障害が軽度の場合は、マッサージや手足の運動といった非薬物療法で対応が行われます。
中等度の障害に対しては、薬物療法が用いられます。
手足に冷感やしびれ感がある場合は、温かい手袋や靴下を身につけて保温し、末梢循環の改善を図るとともに、症状の緩和のためにビタミンB6、ビタミンB12、ビタミン複合剤などのビタミン製剤を追加使用することもあります。
神経痛や筋肉痛などの痛みがひどい場合は、アセトアミノフェンやNSAIDs(非ステロイド性消炎鎮痛薬)を使用します。
海外では神経性の痛みに対し三環系抗うつ薬のアミトリプチリンや、抗痙攣薬のカルバマゼピンなどが用いられています。
中等度および重症の場合は、非麻薬性鎮痛薬やモルヒネなどの麻薬性鎮痛薬(オピオイド)を追加使用します。
重症から高度重症の場合は、治療薬の減量または中止が考慮されますが、この際には抗がん剤に対する腫瘍の反応性や末梢神経障害の改善に応じて治療の再開なども考慮されます。
なお、パクリタキセル投与に伴う軽度および中等度の末梢神経障害に対しては、牛車腎気丸などの漢方薬や、グルタミンが奏効したという報告があります。
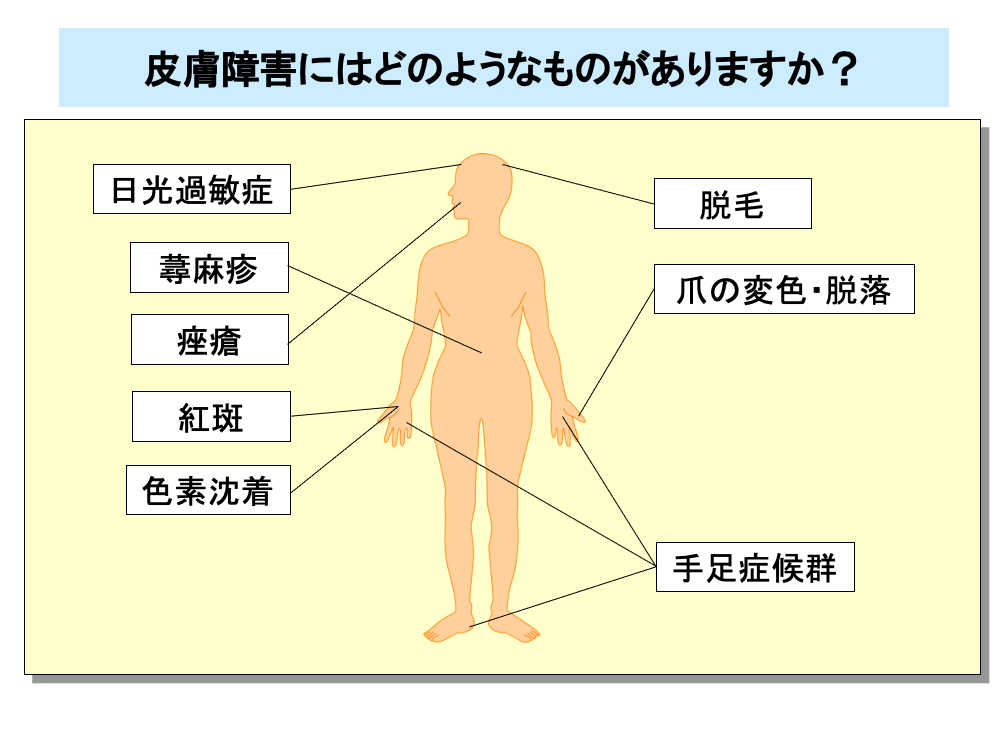
抗がん剤は、増殖の盛んな細胞に作用するため、皮膚の基底細胞にも影響を及ぼします。
抗がん剤による皮膚障害には、アレルギーによる日光過敏症や蕁麻疹のほか痤瘡(にきび)や紅斑、色素沈着といった皮膚症状や、爪の変色・脱落、脱毛といった皮膚付属器の障害があります。
脱毛は、毛包内皮細胞の障害により引き起こされます。
薬剤投与から2~3週間で脱毛をきたすことが多く、薬剤投与中止2~3ヵ月で再び発毛が起こります。
分子標的薬でもEGFR(上皮成長因子受容体)をターゲットとする薬剤では、皮膚に発現しているEGFRに障害が及ぶため、皮膚障害が発現します。
また、薬剤投与数週間後から手掌・足底といった四肢末端に皮膚障害が生じる手足症候群(hand-foot syndrome)がみられることがあります。
手足症候群の発症機序は不明な点が多く、軽度の場合は、しびれや皮膚知覚過敏、無痛性腫脹・無痛性紅斑といった日常生活に制限が及ぶことの無い障害ですが、重症化すると水疱やびらん・潰瘍、強い痛みが生じるとともに、物がつかめない、歩行困難など、日常生活に支障をきたします。
皮膚障害は、致死的なものや緊急処置の必要なものはほとんどありませんが、患者の日常生活に与える影響が大きいので注意が必要です。
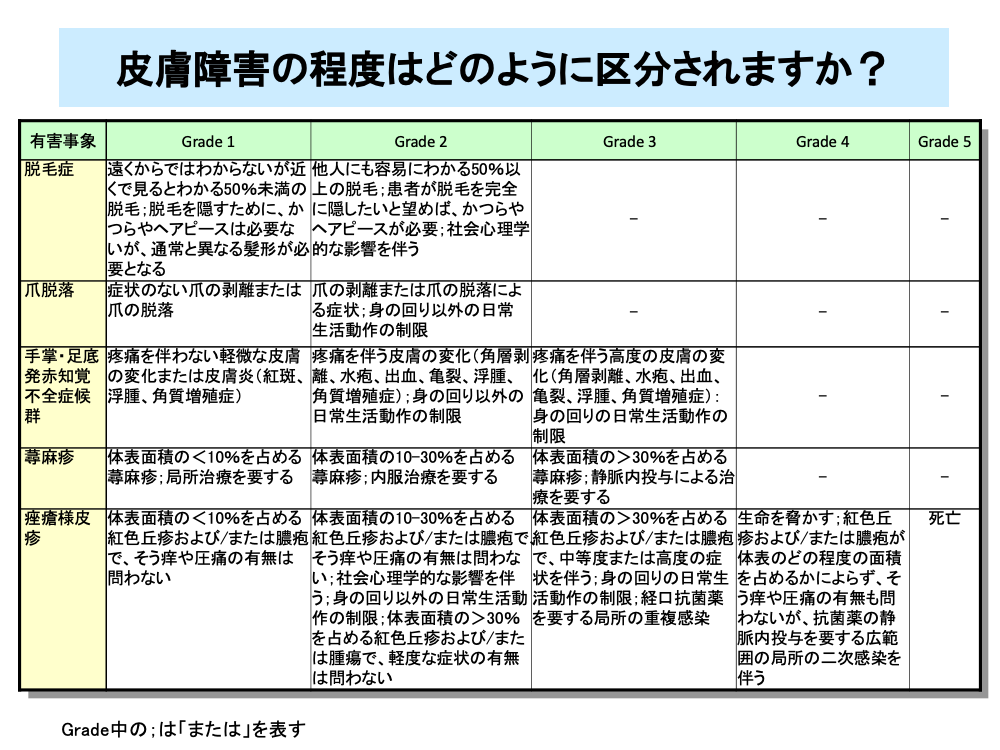
脱毛や爪の脱落は、入院治療の不要なGrade 1~2の副作用ですが、脱毛は女性に心理的な負担を与えるため、治療開始前からの十分な説明とサポートが必要となります。
手足症候群は、CTCAEでは手掌・足底発赤知覚不全症候群とされており、重症の場合は入院治療が必要なものの、致死的な副作用でないためGrade 3までに分類されます。
蕁麻疹も同様に致死的な副作用でないためGrade 3までに分類されます。
痤瘡様皮疹は、二次感染により死に至ることがあるため、Grade 5までの分類がなされています。
CTCAEでは各項目の定義を以下のように行っています。
・脱毛症:年齢、部位に相応の量よりも毛髪が減少。
・爪脱落:爪のすべてまたは一部の脱落。
・手掌・足底発赤知覚不全症候群:手掌や足底の、発赤、著しい不快感、腫脹、うずき。
手足症候群としても知られている。
・蕁麻疹:かゆみを伴う皮疹で、内部が青白く、辺縁部が鮮明な赤色を呈する膨疹。
・痤瘡様皮疹:典型的には顔面、頭皮、胸部上部、背部に出現する紅色丘疹および膿疱。

脱毛を高頻度にきたす抗がん剤には、ドキソルビシンなどのアントラサイクリン系抗がん剤や植物由来製剤があります。
手足症候群は、フッ化ピリミジン系抗がん剤(特にカペシタビン)に特徴的な副作用で、早期にはチクチクまたはピリピリするような感覚異常がみられます。
その後、皮膚表面の光沢が消失し色素沈着や疼痛が出現します。
進行すると水疱・びらん・潰瘍が生じるようになります。
分子標的薬のうちEGFR阻害作用を有する薬剤では、発赤・知覚異常・疼痛にはじまり水疱の形成へと発展する手足症候群が出現しますが、フッ化ピリミジン系抗がん剤と異なり限局性で角化傾向が強いという特徴があります。
EGFR阻害作用を有する分子標的薬では、痤瘡様皮疹・発疹や乾皮症、爪周囲炎といった皮膚障害も問題となります。
特に、にきびのような皮疹である痤瘡様皮疹が特徴的で、皮疹に続き皮膚が乾燥した状態である乾皮症へと進展し、少し遅れて爪周囲炎が発現します。
痤瘡様皮疹は、顔面や前胸部・上背部に好発する点は一般の痤瘡(にきび)と同様ですが、一つひとつの皮疹がやや大きめで四肢にも生じることがある点が異なっています。

皮膚障害に対する確立された予防法は、現在のところありません。
皮膚障害に早期に対応できるよう、保湿、皮膚を清潔に保つ、刺激を避けるなどのスキンケアに努めるように患者指導を行うなど、いくつかの試みが行われています。
脱毛の予防的措置としては、抗がん剤治療時に頭皮を圧迫したり冷却するなどの方法により、頭皮毛包への循環血流量を下げて、抗がん剤の到達量を減らす試みがなされています。
海外では頭皮を冷却する医療機器が用いられています。
手足症候群の予防として行われるスキンケアでは、ヘパリン含有物質製剤の塗布や、ビタミンB6の内服などが行われています。
痤瘡用皮疹予防におけるスキンケアでは、ジフルプレドナート軟膏やミノサイクリンの全身塗布、ヒドロコルチゾン酪酸エステル軟膏の顔面塗布が行われるほか、ヘパリン含有物質製剤の塗布が行われています。
また、色素沈着や爪の変化に対する予防として行われるスキンケアにも、ヘパリン含有物質製剤の塗布が行われています。
皮膚障害のうち、脱毛については確立した治療法はなく、かつら(ウィッグ)や帽子、スカーフなどで脱毛を目立たなくする方法がとられています。
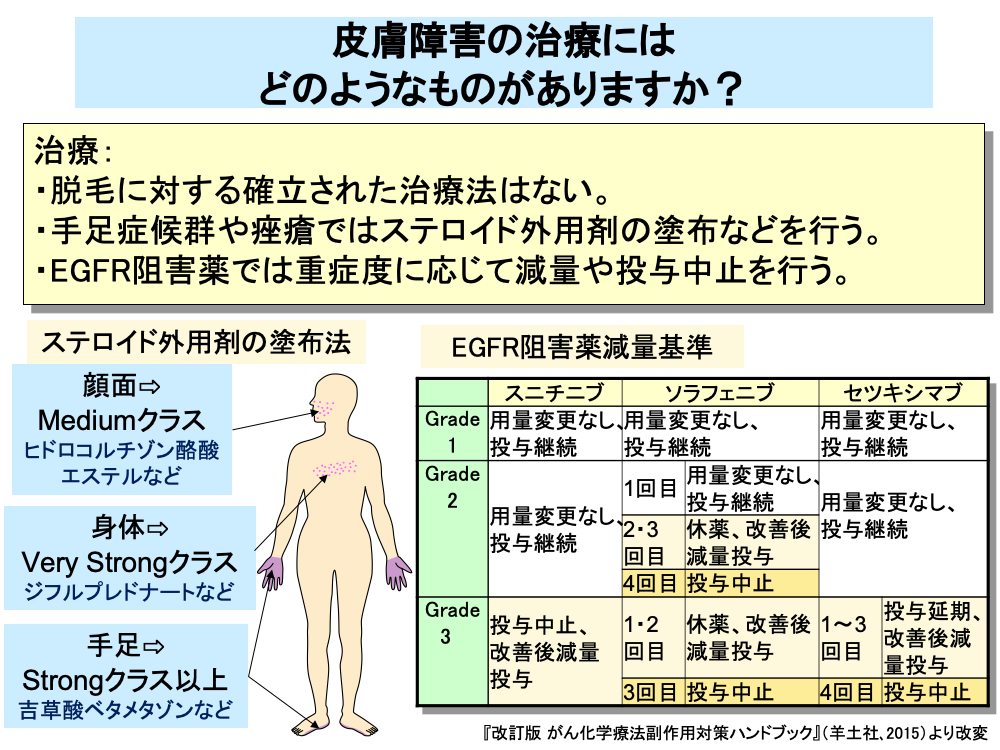
手足症候群や痤瘡様皮疹に対する治療としては、ステロイド外用剤の塗布などが行われています。
ステロイド外用剤は、塗布部位によって吸収率が異なるため、全身性の副作用を避けるため使い分けが行われています。
具体的には、顔面に対してはヒドロコルチゾン酪酸エステルなどのMediumクラスの薬剤を、身体に対してはジフルプレドナートなどのVery Strongクラスの薬剤を、手足に対しては吉草酸ベタメタゾンなどのStrongクラス以上の薬剤を用います。
手足症候群では、ステロイド外用剤の塗布のほかに鎮痛薬の投与も行われます。
痤瘡では、ステロイド外用剤の塗布のほかに抗菌作用と抗炎症作用を期待してミノサイクリンの投与が行われます。
EGFR阻害作用を有する分子標的薬(EGFR阻害薬)における痤瘡に対しては、程度に応じて減量や休薬が行われています。
EGFR阻害薬では、症状が軽い場合や初回発現の場合は、そのまま投与を継続し、重症の場合や2回目以降の発現の場合は、休薬後、減量投与となっています。
4回以上痤瘡が発現した場合や症状が重篤な場合は、投与中止となります。
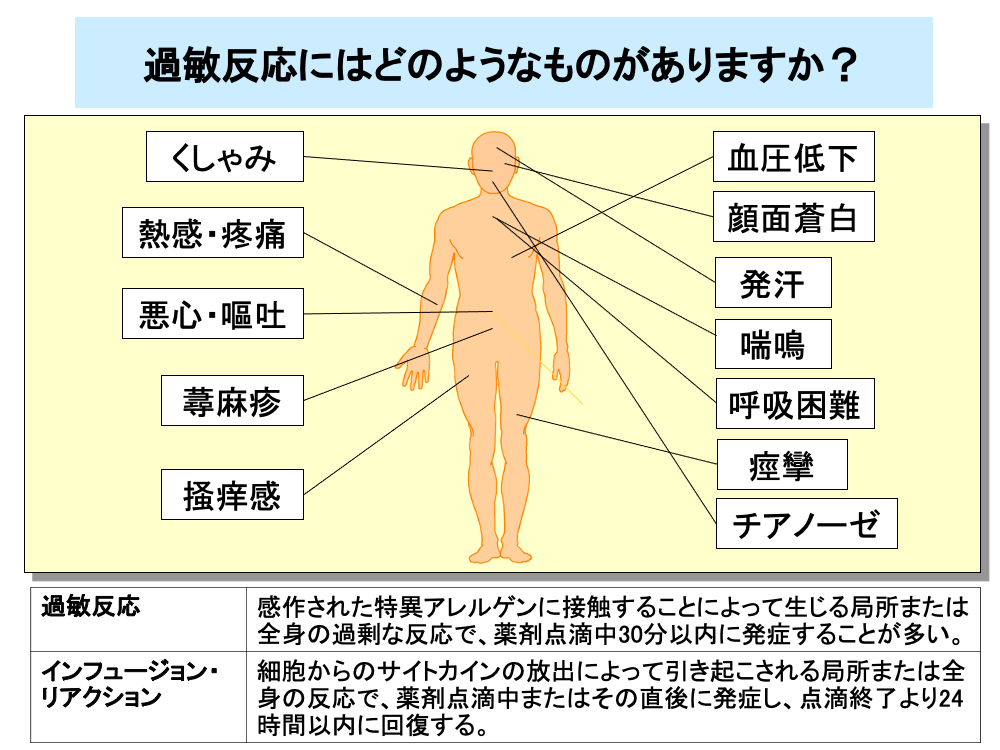
過敏反応(アレルギー反応)は、抗がん剤のみならず、すべての薬剤で起こりうるもので、感作された薬剤の再投与により起こり、多くは薬剤点滴中30分以内に発症します。
軽度のアレルギー症状としては、一過性の顔面紅潮や注射部位から中枢に向けての熱感・疼痛や悪心・嘔吐のほか、蕁麻疹などの皮疹や掻痒感などがあり、中等度の場合は血圧低下などバイタルサインの変化や発汗、顔面蒼白、気管支痙攣や気道閉塞による喘鳴・呼吸困難などが認められます。
重症の場合は、痙攣やチアノーゼなどが発現し入院治療が必要です。
特に、Ⅰ型のアレルギー反応であるアナフィラキシーでは、気管支痙攣、浮腫、血圧低下などの循環不全を伴い致死的な状況となるため、早急な対応が必要となります。
過敏反応に似た副作用として、インフュージョン・リアクションがあります。
インフュージョン・リアクションは、細胞からのサイトカインの放出によって引き起こされるもので、薬剤点滴中もしくは点滴直後に発症し、点滴終了24時間以内に症状の回復がみられます。
インフュージョン・リアクションは、アレルギー反応と類似していますが、投与回数の増加に伴い発現頻度や発現Gradeが低くなる点が異なっています。
アレルギー反応は、一過性の潮紅や皮疹の場合は、特に治療の必要はありませんが、軽症から急速に重症化することがあるため注意が必要です。
症状に対する治療が遷延する場合や、一度改善しても再発する場合あるいは続発する場合は入院治療が必要です。
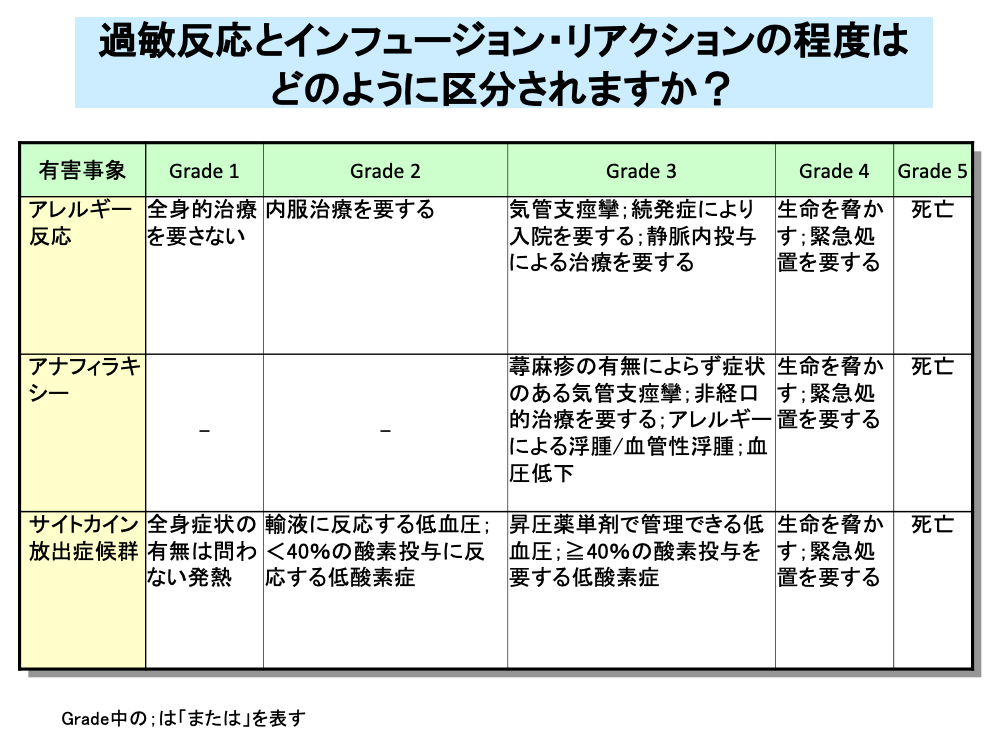
アレルギー反応のうち薬剤投与開始から比較的短時間で生じるアナフィラキシーは、気管支痙攣による呼吸困難や血圧低下によるショックを引き起こすことがあるため、Grade 3以上の重篤な副作用に分類されます。
インフュージョン・リアクションは、サイトカイン放出症候群と呼ばれることもあり、アレルギー反応と同様に軽度の場合は治療は不要ですが、治療が遷延する場合や、一度改善しても再発する場合あるいは続発する場合は入院が必要です。
CTCAEでは各項目の定義を以下のように行っています。
・アレルギー反応:抗原物質への曝露により生じる局所あるいは全身の有害反応。
・アナフィラキシー:肥満細胞からのヒスタミンやヒスタミン樣物質の放出により引き起こされる急性炎症反応を特徴とする過剰な免疫反応。
臨床的には、呼吸困難、めまい、血圧低下、チアノーゼ、意識消失を呈し、死に至ることもある。
・サイトカイン放出症候群:サイトカインの放出により引き起こされる発熱、頻呼吸、頭痛、頻脈、低血圧、皮疹、低酸素症。

過敏反応(アレルギー反応)が高頻度で早期に起こる薬剤としては、タキサン系抗がん剤やL-アスパラギナーゼがあります。
晩期に高頻度で過敏反応が起こる薬剤には、カルボプラチン、オキサリプラチンがあります。
また、シクロホスファミドをはじめとする多くの抗がん剤では、比較的低頻度ながら過敏反応に対して注意を払う必要があります。
インフュージョン・リアクションは、トラスツズマブをはじめとするモノクローナル抗体型の分子標的薬で発現が認められますが、その多くは初回投与時に起こります。
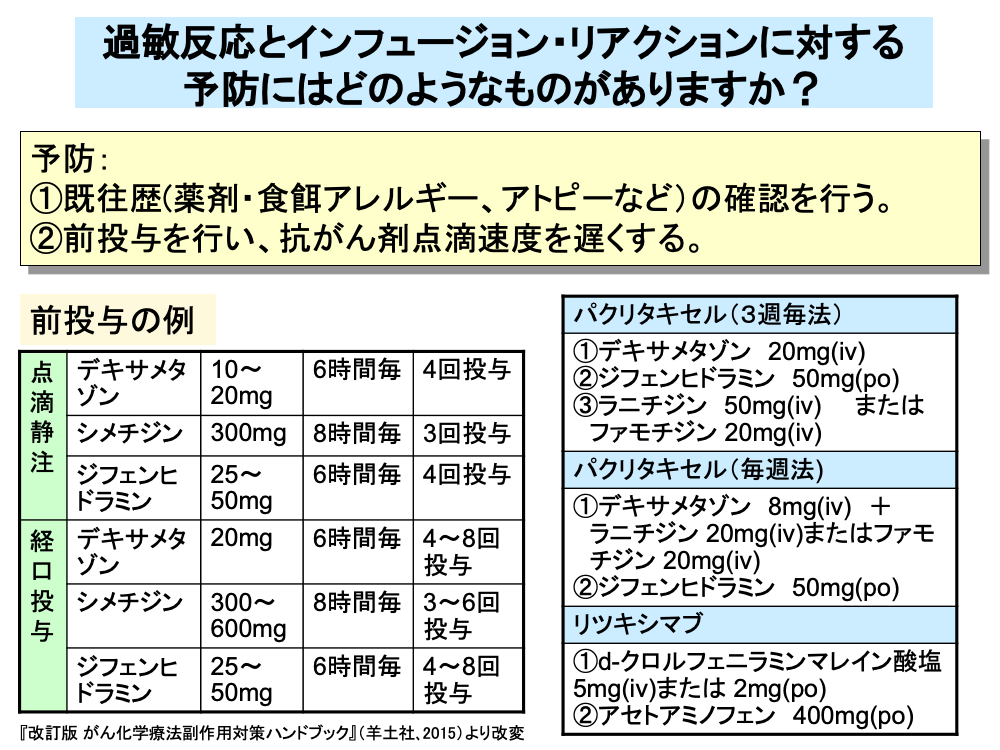
過敏反応の予防には、まず患者の薬剤・食餌アレルギーに対する既往歴や、アトピーなどの確認を行う必要があります。
タキサン系抗がん剤など、早期に高頻度で過敏反応出現が予測される場合は、デキサメタゾンなどのステロイド剤やシメチジンなどのH2受容体拮抗薬と、ジフェンヒドラミンなどの抗ヒスタミン薬の前投与(プレメディケーション)を行うとともに、抗がん剤の点滴速度を遅くするなどの対応を行います。
前投与は、最終投与が抗がん剤投与30分前までに終了するように点滴静注または経口投与で数回行います。
このほか、抗がん剤投与直前に1回だけ前投与を行うこともあり、パクリタキセルでは3週1回投与法と毎週投与法ではステロイド剤の投与量を変えた前投与が行われます。
インフュージョン・リアクションに対する予防としては、抗がん剤の点滴速度を遅くする方法がとられています。
インフュージョン・リアクションは、初回治療時に発現することが多いため、初回治療時には点滴速度を遅くするとともに投与中の観察を十分に行う必要がありますが、2回目以降の治療時には点滴時間を短縮することが可能になります。
このほか、リツキシマブでは抗ヒスタミン薬(d-クロルフェニラミンマレイン酸塩)や解熱鎮痛薬(アセトアミノフェン)などの、またセツキシマブでは抗ヒスタミン薬の前投与がそれぞれ行われています。

抗がん剤による過敏反応が疑われる場合は、まず薬剤の投与を中止しアレルギーに対する治療を行い、さらに重症の場合は、ショックに対する治療を行います。
過敏反応が軽症の場合は、バイタルサインをチェックしながら生食などの輸液を開始します。
呼吸困難が認められる場合は十分な酸素投与を行います。
薬物治療としてはd-クロルフェニラミンマレイン酸塩などの抗ヒスタミン薬と、アドレナリンの投与を行います。
症状が改善しない場合や中等度以上の症状であった場合は、輸液とともに気管内挿管などにより気道確保を行い、血圧低下が認められる際はドパミン投与により循環管理を行います。
薬物治療としては、抗ヒスタミン薬とアドレナリンのほか、メチルプレドニゾロンなどのステロイド剤投与を行います。
インフュージョン・リアクションに対しては、薬剤の投与中断などとともに、過敏反応に準じた対策を行います。
インフュージョン・リアクションが軽度の場合は、点滴速度を半分以下に減速することにより回復することが多く、症状が消失した後に再び元の速さで点滴を行います。
中等度の症状に対しては、薬剤投与を中断して抗ヒスタミン剤など前投薬に用いる薬剤にステロイド剤を加えて投薬し、症状消失後に点滴速度を遅くして投与を再開します。
呼吸困難、血圧低下、アナフィラキシー様症状などを伴う重症の場合は、抗がん剤投与を中止し、アナフィラキシーに対応した重症過敏症に対する処置を行います。
この場合、抗がん剤の再投与は行いません。

抗がん剤によって引き起こされる全身性の障害は、アレルギー反応以外にも多くのものがあります。
倦怠感は、ほとんどのがん患者に認められます。
Gradeは3までですが、QOLの低下や治療の継続に影響を及ぼす重要な症状のひとつです。
倦怠感は、抗がん剤のみならず合併症や社会的・精神的な因子も影響するため原因の把握が難しく、また全身的な不快感、だるさ(疲労感、消耗感)、元気がない(気力の減退)といった患者の主観的な愁訴に基づくため客観的な評価が難しい側面を持ちます。
疲労も倦怠感を引き起こす要因のひとつで、休息によっても改善しない場合は入院が必要となります。
浮腫は、体液の過剰な貯留によって起こり、顔面浮腫や体幹浮腫、四肢浮腫(末梢性浮腫)などがあります。
四肢浮腫は、抗がん剤以外に深部静脈血栓症や静脈弁不全、リンパ浮腫などによっても引き起こされるため、鑑別診断が必要です。
がんに伴って生じる疼痛は、がん性疼痛と呼ばれます。
がん性疼痛は治療への意欲に悪影響を及ぼし、QOLの低下を招くとされ、疼痛緩和はがん緩和ケアの中心です。
抗がん剤による疼痛には、末梢神経痛や筋肉痛のほか関節痛があり、この関節痛は抗がん剤の直接的な作用によるものと、エストロゲンの減少により生じる間接的なものがあります。
また、エストロゲンの減少によって生じる間接的な副作用として骨粗鬆症があげられます。
疲労、四肢浮腫、疼痛・関節痛、骨粗鬆症は生命を脅かすまでには至らないためGrade 4~5の区分はありませんが、重篤な場合は入院治療が必要になります。

すべての抗がん剤が倦怠感を引き起こす可能性を持っていますが、投与10~14日後の白血球減少時期に合わせて倦怠感の増悪を見ることが多くなっています。
倦怠感は殺細胞性抗がん剤のみならず、分子標的薬でも生じます。
特に、ブスルファン、ゲムシタビン、シタラビン、アザシチジン、ドセタキセル、ゲムツズマブオゾガマイシンでは、50%以上の症例に倦怠感が発現しており注意が必要です。
末梢性浮腫は、ドセタキセルやイマチニブなどの分子標的薬で発現しており、ドセタキセルでは総投与量が300~400mg/㎡以上で、イマチニブでは1日投与量が600mgを超える症例で発生しやすいことが知られています。
関節痛は、微小管阻害作用を有する植物由来製剤のほか、エストロゲン減少作用を持つホルモン剤で発現が認められます。
パクリタキセルでは1~3コース目に現れることが多く、アナストロゾールでは3ヵ月以内に発現することが多いことが知られています。

がん化学療法における倦怠感の発現には、①がんに対する治療によるもの、②がん自体によるもの、③支持療法によるもの、④合併症によるもの、といった複雑な要素が関連しています。
このため、倦怠感の原因がどこにあるのかを明らかにする必要があり、薬剤の副作用である場合は減量を行い、可能であれば投与を中止します。
この際、抗がん剤による副作用防止に用いている抗ヒスタミン薬や抗不安薬により倦怠感が生じている可能性にも注意が必要です。
倦怠感に対する対策として、症状が軽度の場合は、体力を温存するよう日常生活の指導が行われます。
中等度以上の倦怠感に対しては、血液検査などにより治療可能な倦怠であるか否かの鑑別を行います。
貧血、感染症、電解質バランス異常・脱水、高カルシウム血症に対しては、輸血・輸液や薬剤投与を行います。
低栄養・代謝異常に対しては、食事内容の検討を、睡眠障害に対しては睡眠薬投与や睡眠環境を整備します。
抑うつ症状・不安心理には、抗不安薬や抗うつ薬の投与を、呼吸機能低下・低酸素症に対しては酸素吸入や生活環境の整備のほか、モルヒネ投与を行います。
腫瘍進行に伴い倦怠感が発現しているような場合や、がん悪液質に伴って倦怠感が出現している場合は、ステロイド剤やオピオイド投与などで対応します。

ドセタキセルによる浮腫は、毛細血管透過性の亢進により毛細血管外にタンパク質が漏出して間質に水分が貯留するもの(fluid retention syndrome)と考えられています。
このため、ドセタキセルではステロイド剤の予防的投与が行われています。
浮腫が発現した場合、ドセタキセルでは休薬を行い、一般的な浮腫の治療である利尿剤を用います。
他の薬剤による浮腫に対してもフロセミドなどの利尿剤投与で対処します。
フロセミドでコントロールできない浮腫に対しては、スピロノラクトンが用いられます。
関節痛に対して確立された予防策や治療は特にありません。
微小管阻害薬で関節痛が現れた場合は、NSAIDs(非ステロイド性抗炎症剤)が用いられます。
NSAIDsで症状が改善しない場合は、低用量のステロイド剤の経口投与や、漢方薬である芍薬甘草湯の投与が行われます。
また、ホルモン療法剤における関節痛に対しては、NSAIDsの投与が行われています。
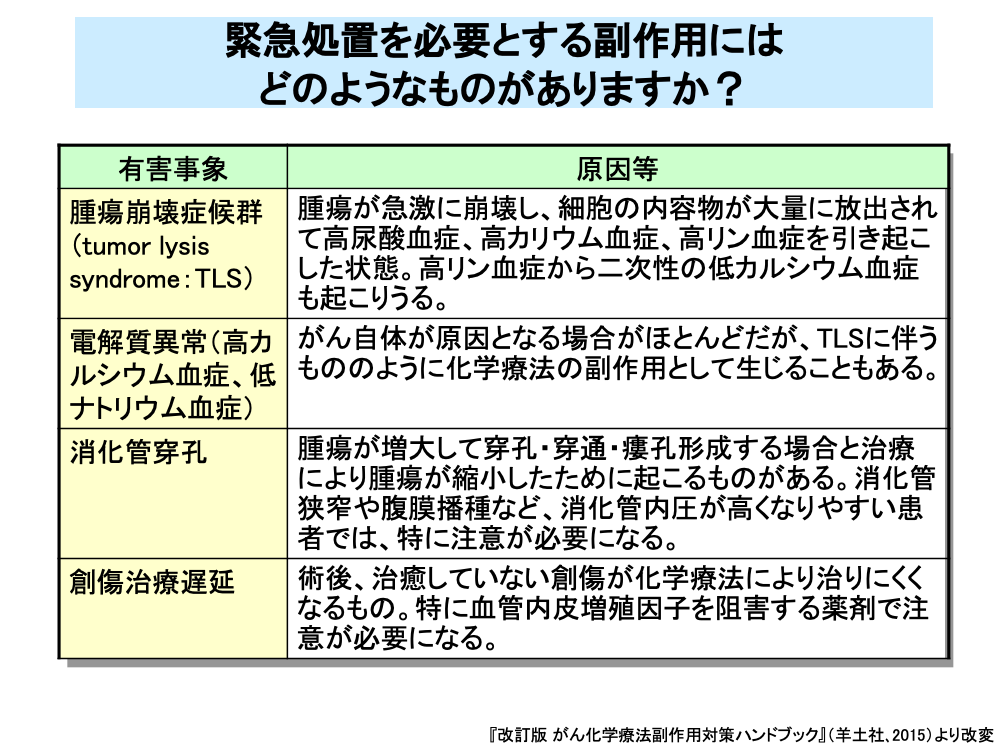
腫瘍崩壊症候群(tumor lysis syndrome:TLS)は腫瘍が急激に崩壊し、細胞の内容物が大量に放出されるものです。
高尿酸血症、高カリウム血症、高リン血症から、腎機能障害、意識障害、痙攣、致死的な不整脈に進展しうるOncologic Emergencyの1つです。
発症リスクが高い場合、アロプリノール内服(200~300mg/日)や、補液による十分な尿量の確保が必要になります。
電解質異常はがん自体が原因になる場合がほとんどですが、上記のTLSによるものもあります。
食欲低下、嘔気・嘔吐、頭痛、意識障害などがみられた場合、血液検査による血清カルシウム濃度、ナトリウム濃度のチェックが必須になります。
消化管穿孔は腫瘍自体の増大による場合と、治療により腫瘍が縮小したために起こる場合があります。
治療は一刻を争うため、早期発見が重要になります。
急な腹痛、腹痛の増強、説明不能の発熱など、身体所見の把握がポイントになります。
創傷治癒遅延は、術後の創傷の治癒が遅れるもので、ベバシズマブなど血管内皮細胞の増殖を抑制する薬剤で特に注意が必要になります。
ベバシズマブに関しては、術後28日以上経過してからの投与が勧められています。

