1.がん拠点病院

はじめに。
想定する場面は以下の5つです。
1.がん拠点病院
2.がんの検査・診断
3.がんの外来治療
4.がんの入院治療
5.がん診療の連携
おわりに
これら各項目について、①どのようなシステムか、②どのような診療が行われるのか、③制度として押さえるべきポイントは何か、④これからどうなっていくか、の4点を解説していきます。
制度の概要、制度の要点、診療の実際、今後の動き、これらをセットで考えることで、がん診療の「今とこれから」を把握しましょう。
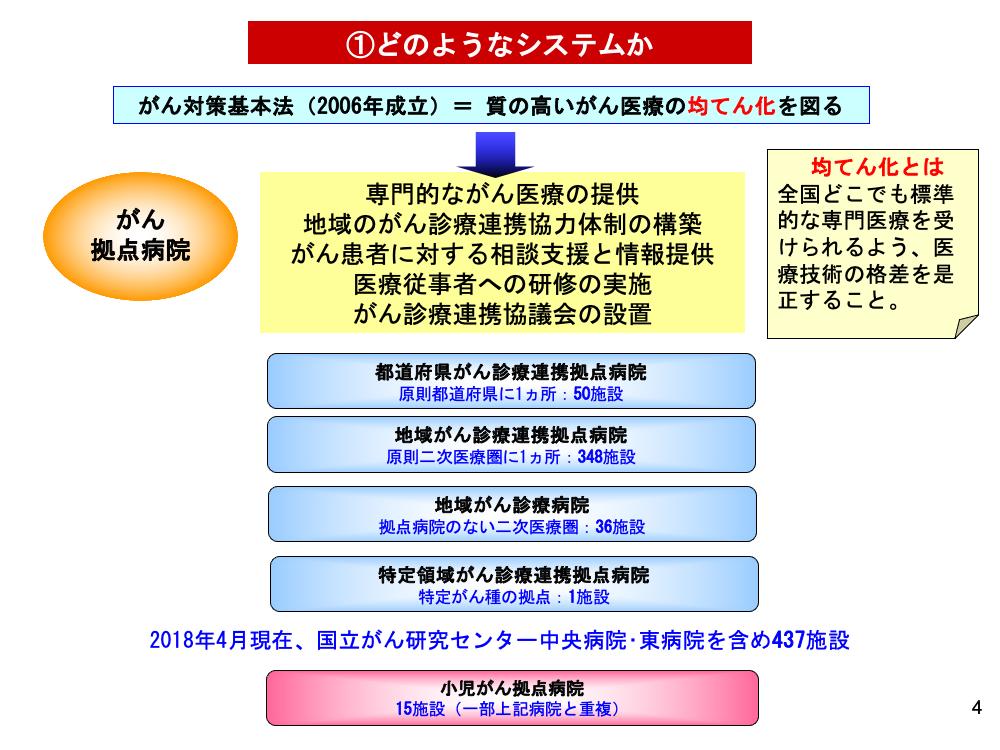
2006年、質の高いがん医療の均てん化を目的にがん対策基本法が成立しました。均てん化とは、全国どこでも標準的な治療を受けられるようにすることで、これに基づき指定されたのが「がん診療連携拠点病院」です。専門的ながん医療の提供、診療連携協力体制の構築、がん患者への相談支援と情報提供などを行うための医療機関と定義されています。
現在これらの施設は「がん拠点病院」という名称でまとめられます。具体的には、都道府県に1ヵ所以上置かれる「都道府県がん診療連携拠点病院」、二次医療圏に置かれる「地域がん診療連携拠点病院」、二次医療圏に拠点病院がない地域に設置される「地域がん診療病院」、特定がん種について拠点の役割を果たす「特定領域がん診療連携拠点病院」に区分されます。
またこれとは別に、小児のがん診療について中心的な役割を担う「小児がん拠点病院」も15施設が指定されています。こちらは一部、都道府県がん診療連携拠点病院と重複しているものもあります。
その指定病院数は、2018年4月現在都道府県がん診療連携拠点病院50施設、地域がん診療連携拠点病院348施設、地域がん診療病院36施設、特定領域がん診療連携拠点病院1施設で、これにナショナルセンターである国立がん研究センター中央病院と東病院を加えた437施設ががん拠点病院となります。

がん拠点病院の診療報酬のうち、患者受け入れの際に関係するものを示します。これらはがん対策基本法施行に伴って導入され、数度の改定を経て充実が図られています。
例えば、連携先である診療所でがんを疑われた患者さんが拠点病院である病院を紹介され、入院治療を受けた場合、がん拠点病院加算が認められます。2006年度の施行当初は、紹介時点でがんの診断がなされている必要がありました。しかし現在では、がんの疑いで紹介され、最終的にがんと診断された場合、入院初日に認められるようになっています。
一方がん治療連携管理料は、入院には至らず外来で化学療法などを施行された場合でも、病院としての報酬を確保できるようにするものです。こちらは1人1回につき認められています。
保険点数はいずれも、がん拠点病院500点、地域がん診療病院300点、小児がん拠点病院750点となっています。がん診療を画一的に捉えるのではなく、患者個々の診療実態に合わせた評価を行おうという意図が、これらの改定の背景にあります。
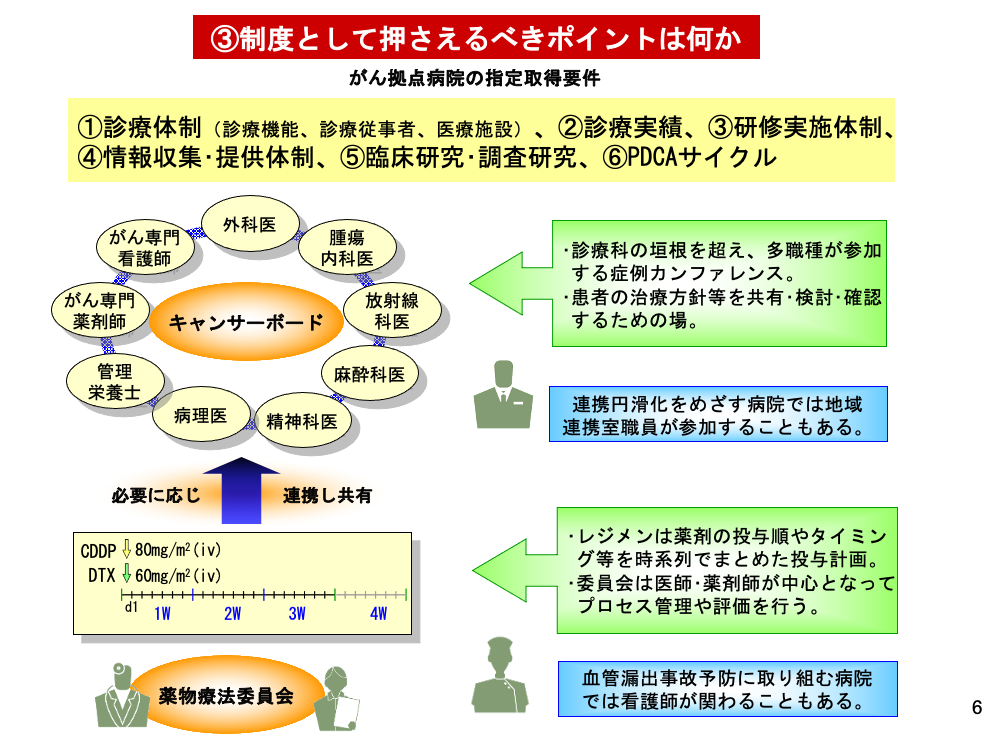
がん拠点病院の指定要件は、①診療体制、②診療実績、③研修実施体制、④情報収集・提供体制、⑤臨床研究・調査研究、⑥PDCAサイクルに大別されます。中でも診療体制ついては、診療機能・診療従事者・医療施設を明確に規定しています。ここではキャンサーボードを紹介しながら、がん拠点病院に求められる機能をみてみましょう。
キャンサーボードは「がん診療について知識・技能をもつ医師その他の専門職が患者の治療方針等を共有・検討・確認するための場」です。一般的な症例カンファレンスの規模を拡大させたもので、診療科の垣根を越え多職種が参加します。キャンサーボードは治療状況全般を共有しますが、別に設置される薬物療法委員会と連携して治療内容の評価も行います。
組織の具体的構成基準は特に定められてはいません。したがって、形態は病院ごとに異なります。連携円滑化のため医療連携室の職員をキャンサーボードに参加させている施設や、血管漏出事故防止のため医師・薬剤師とともに看護師が積極的に薬物療法委員会に関わっている施設もあります。
多職種によるチーム医療において、こうしたフリーハンドの余地は重要です。しかし近年は、機能強化のため職種に関する規定を定めるべきという議論も起きています。

これからの動きについて触れます。2019年4月以降のがん拠点病院指定要件として議論にあがっている主な項目です。
医療安全体制の確保については、要件としての新設が確実になっています。具体的には、組織上明確な医療安全管理部門を設置し、専任の薬剤師と専従の看護師を配置するなどです。
さらに医療安全管理を施設内で完結させず、第三者機関の評価を受けること、あるいは拠点病院同士でピュアレビューを行うことも議論されています。
また、これらの結果を評価として反映させるため、最も優れた施設をがん拠点病院の「中核病院」(仮称)に指定し、インセンティブを付与することも検討されています。
そのほか相談支援センターの機能強化についても、議論の対象になっています。
2.がんの検査・診断
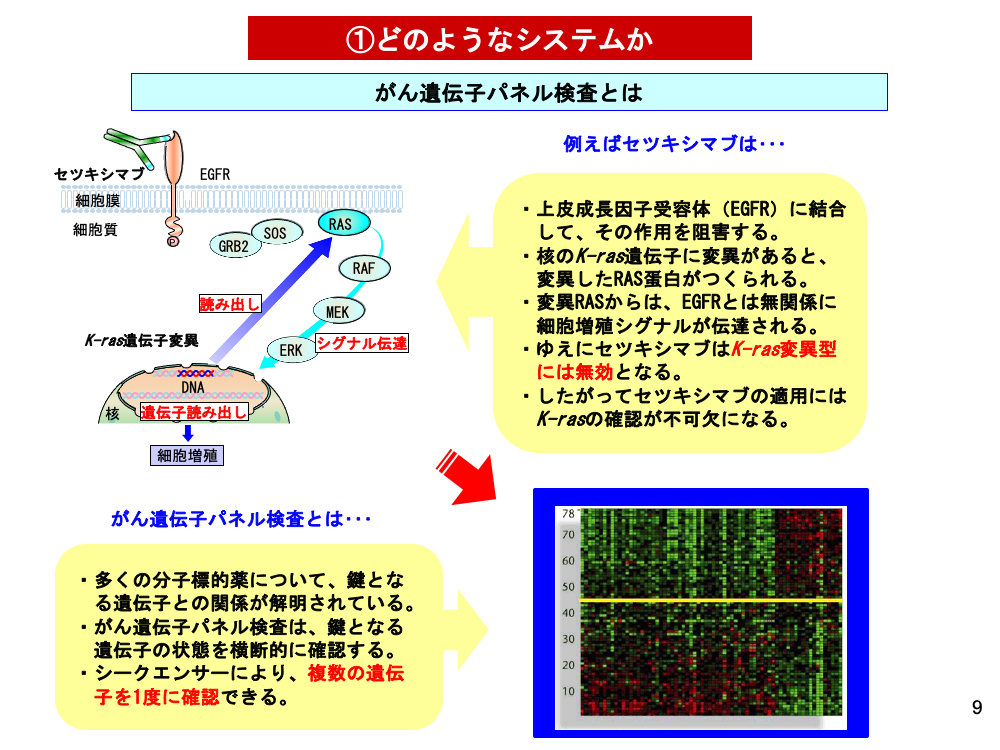
がんの遺伝子パネル検査は、今最も注目を集めている検査項目です。
分子標的薬の登場はがんの臨床を劇的に変えましたが、遺伝子検査もその1つです。例えばセツキシマブは、細胞の上皮成長因子受容体(EGFR)に結合することで増殖を抑制します。しかし細胞の核にK-rasという遺伝子が発現している場合、つくられたRAS蛋白からはEGFRと無関係に細胞増殖シグナルが伝達されるため、増殖は抑えられません。セツキシマブ適用に際し、K-ras発現の有無を調べることが不可欠となる理由です。
こうした遺伝子との関係は、すでにさまざまな分子標的薬において明らかになっています。従来は個々の薬剤について行われていた遺伝子の状態の確認を、1度に行うのががん遺伝子パネル検査です。
患者の病理組織や血液から抽出したDNAをシークエンサーという装置にかけることで、複数の遺伝子についての解析が可能となります。

保険診療でも遺伝子検査は行われます。診療報酬では「悪性腫瘍組織検査」として、現在12種類を認めています。通常コンパニオン(CDx)検査と呼ばれるこれらと、がん遺伝子パネル検査はどう違うのでしょうか。
CDx検査は、特定の分子標的薬に適用をもつかどうかを確認するために行われます。一方がん遺伝子パネル検査は、複数の患者の組織や血液を検体として抽出し、そのそれぞれについて遺伝子の状態を1度に確認するものです。2018年に国立がん研究センターが申請し「先進医療B」として実施が認められた「OncoGide NCCオンコパネルシステム」でその実際をみてみましょう。
対象は16歳以上で全身状態良好の、治癒切除不能または再発の病変を有する原発不明がん、または標準治療がない、標準治療が終了している、または終了が見込まれる固形がんの患者です。彼らから抽出調製した解析試料につき、シークエンサーを用いて114のがん関連遺伝子の塩基配列を解読します。これにより、検体ごとに有効な治療方法の検討を試みるもので、最大350例に実施されることになっています。
CDx検査と遺伝子パネル検査、両者の違いを表にするとスライドのようになります。

がん遺伝子パネル検査は、国立がん研究センター以外にも東京大学など複数の研究機関が独自に実施しています。その流れは、がんゲノム医療推進コンソーシアム懇談会の規定に基づく共通のものです。
検査内容の説明から始まり検体準備、シークエンスの実施、結果の解析、結果説明へと進みますが、最も重要なのは作成されたレポートを基にした専門家会議です。シークエンスでは一般に500~1000個程度の遺伝子変異や多型が検出されます。その中から治療ターゲットとなるものを選別する作業です。ここにおいて、例えば適用する分子標的薬の選択根拠となる情報を見つけ出さなくてはなりません。「専門家会議=エキスパートパネル」と呼ばれる所以です。
現在がん遺伝子パネル検査としての専門家会議を実施できるのは、全国に11ヵ所指定されている「がんゲノム医療中核拠点病院」*1のみです。各中核拠点病院は、連携して診療にあたる「がんゲノム医療連携病院」とネットワークを組んでおり、その結果は連携病院にレポートという形で返却されます。
*1:2019年度に、シークエンスが実施できる「がんゲノム医療拠点病院」を新たに19施設指定する予定。

がん遺伝子パネル検査については、未だ未確定な要素が多くあります。
2018年12月13日、国立がん研究センターのシステムは「OncoGuide NCCオンコパネルシステム」として厚生労働省薬事・食品衛生審議会医療機器・体外診断薬部会において了承されました。申請はシスメックス社で、これとは別に中外製薬を申請者とする「FoundationOne CDx がんゲノムプロファイル」も同時承認されています。通常ここで承認されれば時をおかず保険収載されますが、現時点では保険点数も含めて明確にはなっていません。
すでにみたように、がん遺伝子パネル検査は対象を厳格に規定しています。対象外で保険が使えない場合、その患者を自由診療とすることは可能でしょうか。厚生労働省保険局は先進医療承認時に、自由診療ではなく臨床研究として検証するよう通知を出しています。
変化は抗がん剤の適応症にも現れています。ゲノム医療が主流となる米国では、特定の遺伝子変異をもつ固形がんであれば、臓器にかかわらず用いることができるようになっています。日本でもペムブロリズマブの添付文書には効能・効果として「高頻度マイクロサテライト不安定性の固形癌」と記載されるようになっています。こうした事態は、治験のあり方にも影響を及ぼしていくことでしょう。
3.がんの外来治療

次にみるのは外来化学療法です。かつて化学療法は入院が一般的でした。それが近年、薬物治療は外来での施行が盛んになってきています。背景にはさまざまな要因が考えられますが、国民の2人に1人が罹患するという状況で”がんと共に生きる”という意識が患者にも芽生えているようです。
スライドには、外来化学療法加算を算定するための基準を示しています。
まず、施設の基準により加算1と加算2に大別されます。加算1、加算2とも治療室については、外来化学療法を実施している間は、外来化学療法その他の点滴注射(輸液を含む)以外の目的で使用することはできません。また、加算1の⑥の委員会については、各診療科の医師の代表者、業務に関わる看護師、薬剤師から構成され、少なくとも年1回の開催が求められます。
点数のAとBは用いる抗がん剤の違いに基づきます。分子標的薬を含む一般的な抗がん剤は概ねAに分類され、Bは乳がんや前立腺がんに用いられるホルモン剤などが該当します。投与経路や管理の必要性が多様化している化学療法を、より適正に評価するためのものです。
抗がん剤の外来投与はどう行われるか、事例とともにみてみましょう。
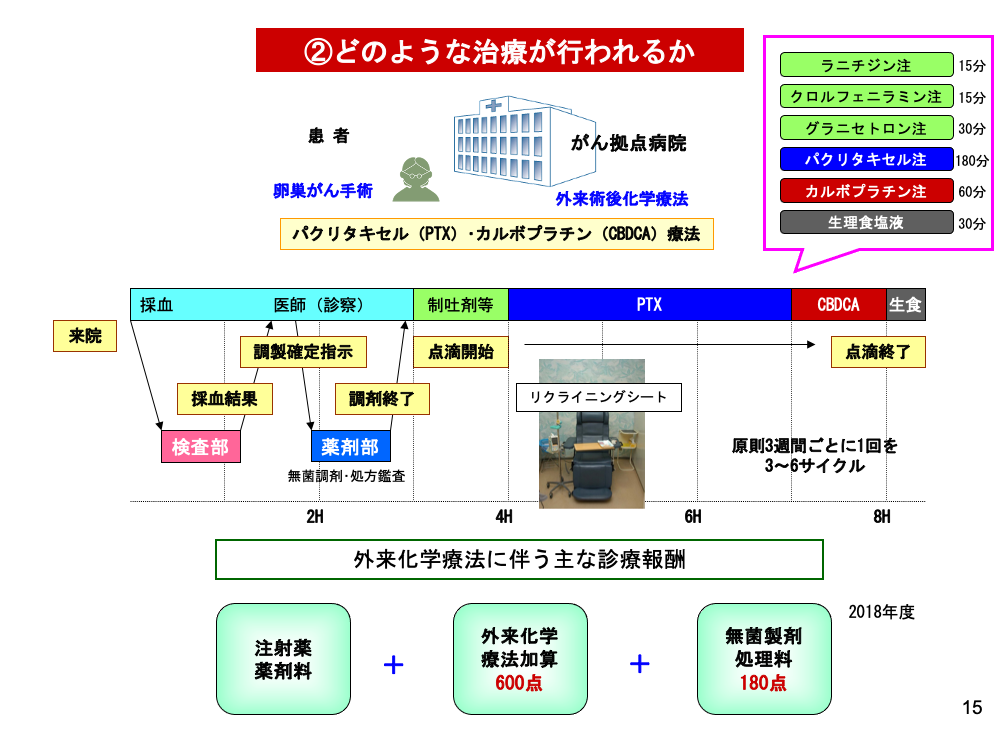
患者さんはがん拠点病院で卵巣がんの手術を受け、術後化学療法のため外来通院することになりました。スライドに示すのは、病院側の作業の流れです。
来院するとすぐに採血を受けます。主治医が診察するのは、通常採血の結果が出てからです。主治医は白血球の状態や患者さんの主訴、バイタルサインを基にこの日の治療の可否を決定します。
治療が決まれば、医師から薬剤部に調製確定の指示が出されます。この指示により、化学療法剤の無菌調剤が行われ、処方レジメン・調製薬剤の鑑査を経て、治療室に薬剤が搬入されます。
点滴治療はここから始まります。アレルギー防止や吐気防止のための薬剤の後、パクリタキセル、カルボプラチンが点滴され、最後に点滴管を生理食塩液で洗い流します。全行程の終了には半日~1日を要し、これを原則3週間に1回、3~6サイクル行うのが標準的です。
スライドには15歳以上の外来化学療法加算Aと、閉鎖式接続器具を使用した場合の無菌製剤処理料を示しています。
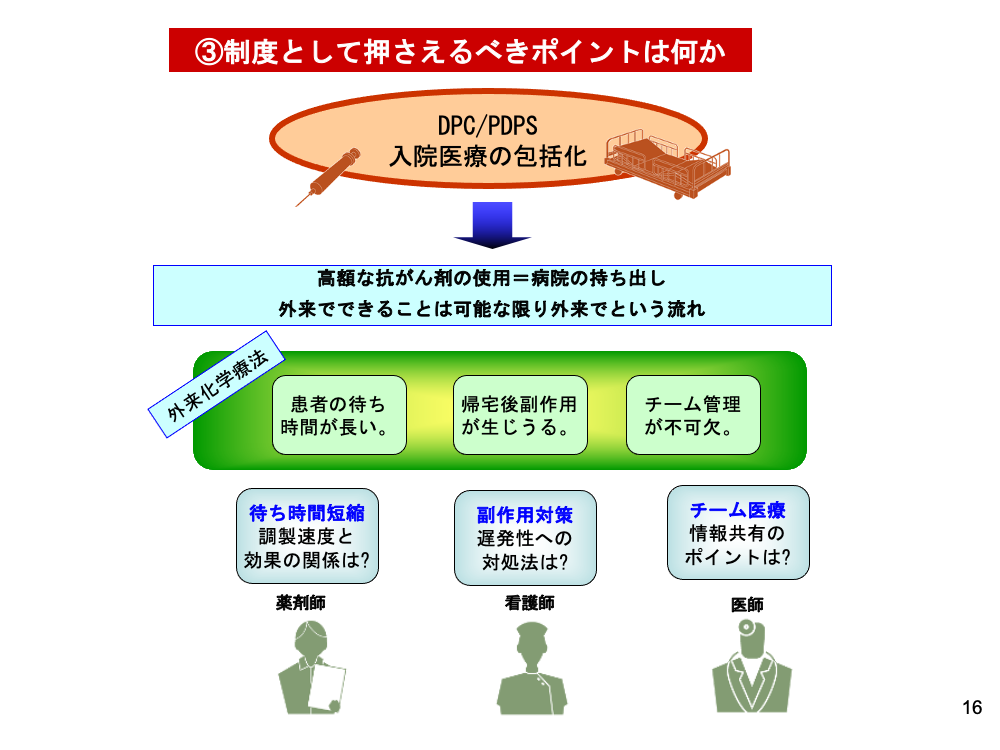
外来化学療法が盛んになった要因の1つに、医療制度の変化があげられます。DPC/PDPSによる入院医療の包括化拡大です。近年の高額な抗がん剤は、包括化の影響を特に大きく受けます。外来でできる医療は可能な限り外来で、という流れは今後も加速していくことでしょう。
その外来化学療法は、前スライドからもわかるように、薬剤によっては半日~1日という時間を要するものがあります。点滴時間自体を速めることはできませんが、部署間の連絡体制を工夫するなどして、少しでも患者の待ち時間を短縮する試みは、多くの病院で行われています。
また、投与後は自宅に戻るため、時間を経て発現する副作用には入院医療とは異なる対応が必要です。
さらには、チームで行う医療であるため、さまざまな地点で発生した問題点をどう共有し、改善に結びつけるかが外来化学療法の成否を決するポイントになります。

外来でのがん化学療法の広がりは、新たな課題も生み出しています。
遅発性の副作用が生じ、体調不良を自覚した患者が近隣のかかりつけ医を受診しても、その医師が患者の外来化学療法の内容を把握できていない、などがその具体例です。
また、把握できたとしても、分子標的薬に代表される新規抗がん剤については、副作用情報の蓄積自体が不十分であり、共有化も進んでいません。原因をつかめず診療に苦慮した症状が抗がん剤の副作用だったという例が、実際に報告されています。
また、外来療法の広まりに呼応して、緩和ケア領域などでは在宅での施行を見据えた診療報酬点数化がなされています。
4.がんの入院治療
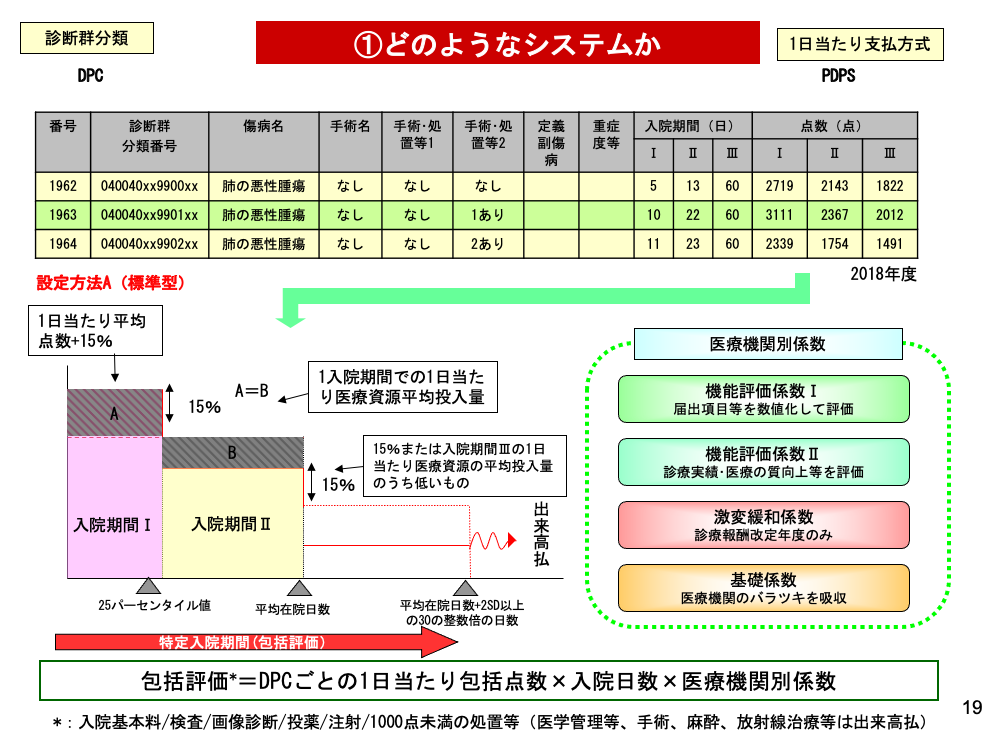
DPC/PDPSは、2003年から始まったわが国独自の急性期入院医療包括評価制度で、データ集積によって医療の標準化を図る取り組みです。2018年4月1日現在でDPC対象病院は1730施設を数え、急性期入院医療を担う病床(7対1または10対1看護)の83%を占めるに至っています。がんの入院診療を考える上でも仕組みの理解は不可欠です。
DPC/PDPSでは、入院期間を通じ最も医療資源を投入した傷病名をICD(国際傷病分類)から決定し、医療行為や副傷病から1つの診断群分類番号を求めます。標準的な設定では、この分類番号の1日当たり包括点数を、集積データを元にスライドに示す点数に分類します。
同一分類番号患者100人を入院日数の少ない順に並べた25人目の日数、25パーセンタイル値までを入院期間Ⅰ、そこから平均在院日数までを入院期間Ⅱ、さらに平均在院日数+標準偏差の2倍以上の30の整数倍の日数を入院期間Ⅲとします(包括算定する期間を特定入院期間と呼ぶ)。Ⅰには1入院期間での1日当たり医療資源平均投入量の15%増、ⅡにはⅠの増加分を除いた分、ⅢにはⅡの15%減または入院期間Ⅲの1日当たりの医療資源平均投入量のうちの低い方の点数を付与します。Ⅲを超えるとすべて出来高払となります。
さらに医療機関ごとに、スライドに示すような係数が定められており、その積が包括評価部分として算定されます。包括評価対象は入院基本料、検査、画像診断、投薬、注射、1000点未満の処置等などです。
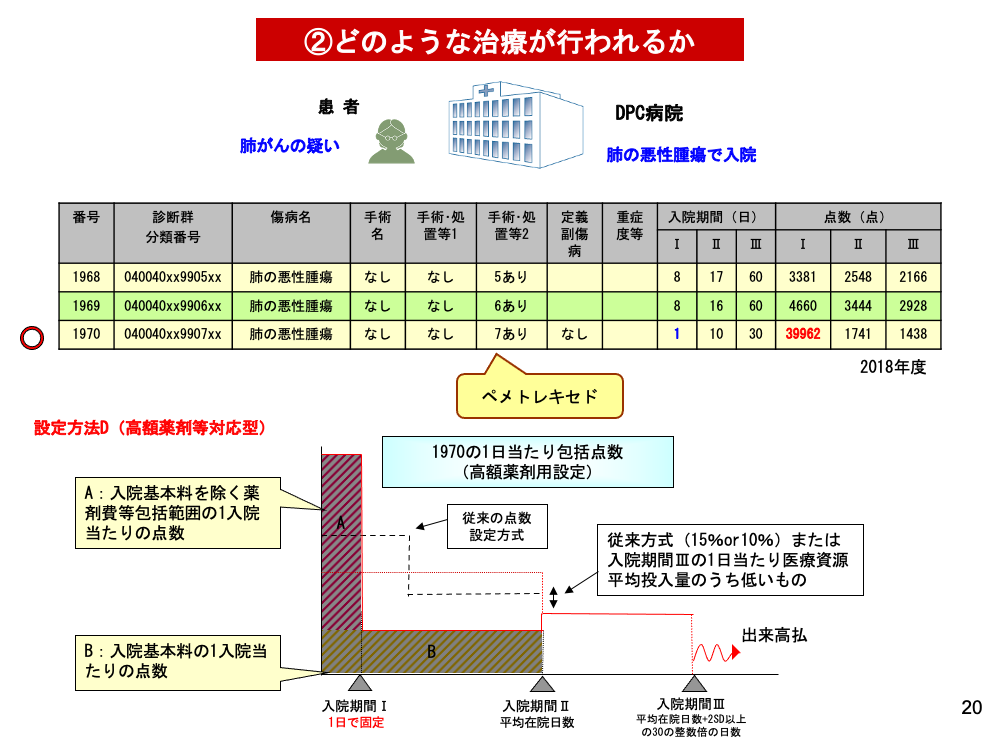
DPC/PDPSにおけるがん診療を事例で示します。肺がんの疑いでDPC病院を受診、肺の悪性腫瘍と診断された患者さんです。診断群分類番号は1970。分類番号決定には「手術・処置等2」のペメトレキセド投与がポイントになります。
下段に示すグラフは、1970の1日当たり包括点数設定です。入院期間Ⅰは1日で固定されており、点数が39962点になっています。高額な薬剤を使用する特定の診断群分類に用いられます。
入院基本料を除く薬剤費等の費用がすべて入院期間Ⅰに投入される一方、期間は1日で固定されます。この患者さんの場合、入院初日に包括部分として39962点×医療機関別係数が算定されることになります。
設定方式Dでは、入院初日に入院基本料以外の報酬がすべて償還され、高額薬剤使用による医療機関の持ち出しを最小化します。同時に在院日数延長の防止効果も担っています。
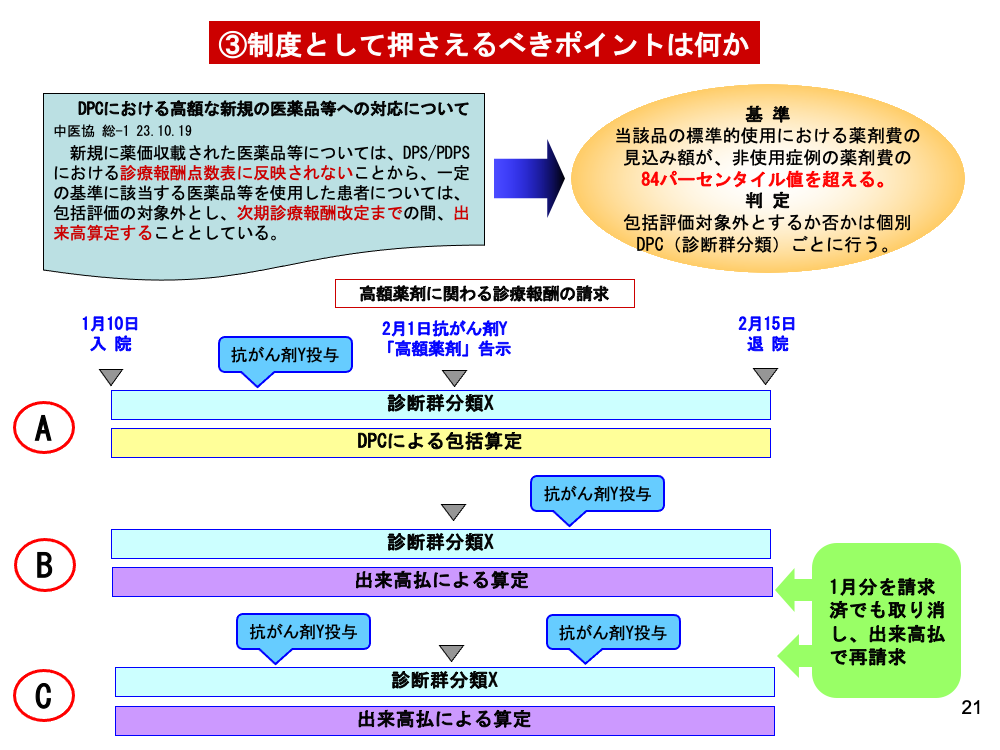
DPC/PDPSには、特定の薬剤を一定の期間包括評価から除外する仕組みもあります。新規に上市された高額な薬剤を用いた診療は、当然上市以前のデータに基づく診療報酬には反映されていません。したがってその場合は、すべての診療行為を医科点数表に基づく出来高払にするというものです。
「高額薬剤」の判定基準は「前年度に使用経験のない薬剤等について、当該薬剤等の標準的な使用における薬剤費(併用薬を含む)の見込み額が、使用していない症例の薬剤費の84パーセンタイル値を超えるもの」とされています。ただし、判定は機械的に行われるのではなく、個別の診断群分類番号で行われます。
例えば診断群分類Xについて、ある年の2月1日に抗がん剤Yが「高額薬剤」として告示されたとします。その場合の算定はどうなるのか、それを説明したのがスライドです。
Aのように、投与が告示前のみである場合は、DPCによる包括となります。一方BやCのように、告示以降もYが使われた場合は、1月分が請求済みであっても、そのレセプトを取り消し、出来高払で再請求を行います。
いずれのパターンも、Yの治療が1入院期間を通じて最も医療資源として投入されたという想定です。

機能評価係数Ⅱは病院が負うべき役割を評価するものですが、その評価項目にがん拠点病院指定の有無やがん地域連携の実績が組み込まれています。
一方がん拠点病院にあっては、保険適応外の治療法や未承認薬の取り扱いが議論の対象になっています。機能性を重視した個別化医療と、医療全体の標準化を施行するDPC医療の整合性をどう考えるかが課題になっています。
5.がん診療の連携
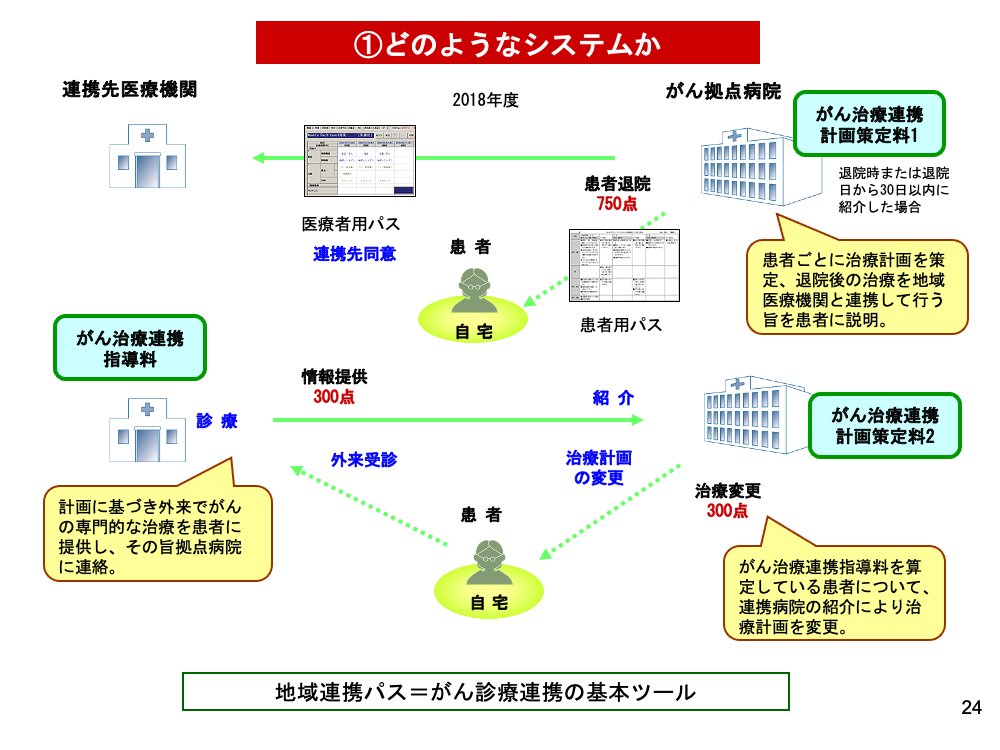
退院した患者は地域の医療機関で治療を受けます。その際重要になるのは医療機関同士の連携です。
拠点病院は、患者ごとに治療計画を策定、退院後の治療を地域医療機関と連携して行う旨患者に説明することで「がん治療連携計画策定料1」が算定できます(この際医療者用・患者用2つの地域連携パスが作成される)。請求できるのは退院時または退院から30日以内に紹介した場合で、通院治療に慣れるまでの調整期間を含んでいます。
一方連携先医療機関は、計画に基づき外来でがんの専門的な治療を患者に提供します。それを拠点病院に診療情報として提供した際に「がん治療連携指導料」が算定できます。
さらに情報提供を受けた病院が、患者の状態の変化等に伴う連携先医療機関からの紹介により治療計画を変更した場合「がん治療連携計画策定料2」を算定することがきでます。
こうした連携の基本ツールとなるのが、地域連携パスです。

パスは実際にどのように用いられるのか、そのフローチャートをみてみましょう。
個別の患者に対するパスの適用開始はがん拠点病院の医師が判断します。その時期は概ねがんに対する治癒切除術後もしくは初回治療後で、告知済み、直近の検査で異常のない、状態の安定した患者などが対象となります。
連携先については、患者の希望や通院のしやすさなども尊重されますが、原則としては紹介元の医師に依頼が出されます。
全体を通じて主導的な役割を果たすのが連携コーディネーターで、地域の医療資源の情報に精通していることが求められます。
連携の継続に重大な意味をもつのが逸脱の発生です。逸脱はバリアンスとも呼ばれ、パス終了の原因となることも少なくありません。
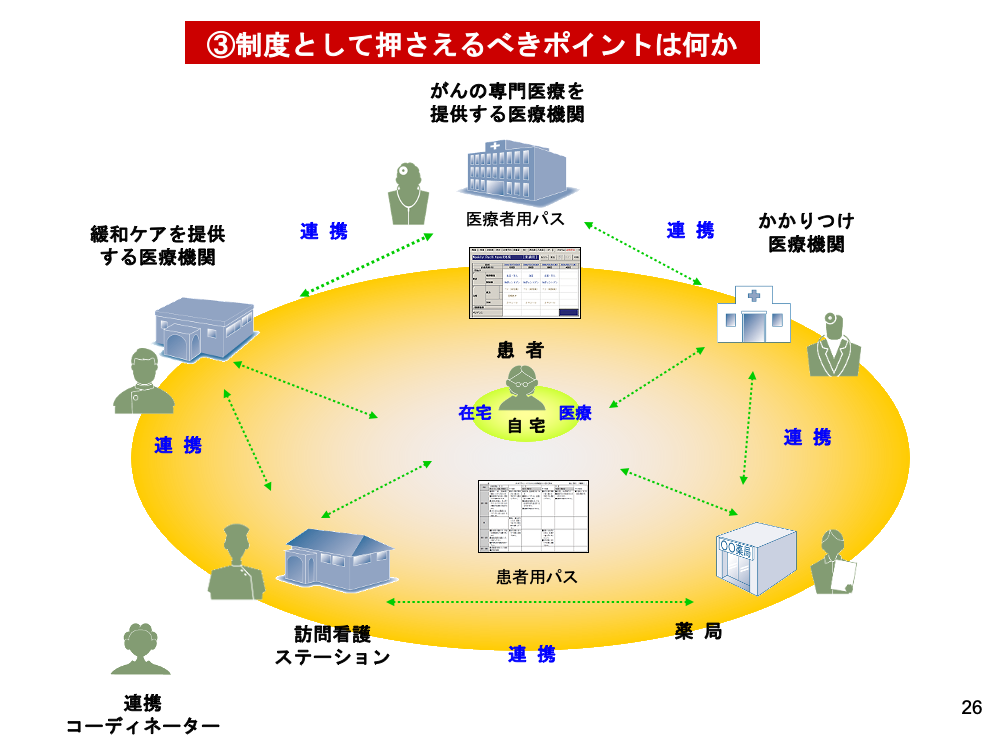
がんの診療連携の全体像を確認しておきましょう。
がん医療の質と安全を保証し、均てん化を図るツールとして地域連携パスが果たす役割はきわめて大きいものがあります。
同時に、前のスライドに示した連携コーディネーターの関わり方も重要になってきます。

連携に関する今後の課題を示します。
連携パスは五大がんを中心に、多くの地域で共有されるようになってきています。
バリアンスへの対処は診療結果を左右する大きな要因です。中でも再発・再燃は時に命に関わることもあります。再発・再燃が疑われる際も、緊急性の度合い(非緊急・準緊急・緊急)に応じて、どの時点で誰が判断したか、それをどのように共有したかを可視化する道が模索されています。
さらに壮年がん患者の就労支援を想定した、医療機関・自宅・勤務先を含むより広域な診療ネットワークの必要性も指摘されています。

おわりに。
すべてのがん診療はルールに基づいて行われており、製薬企業担当者はその理解が不可欠です。それぞれの切り口別に、これから重要になるキーワードをあげておきます。
1.がん拠点病院に関しては、いまだ空白の二次医療圏が70ヵ所程度存在しています。
2.がん遺伝子パネル検査については、保険収載がいつになるか、保険点数がどうなるかが最大の注目点です。
3.外来化学療法については、さらに在宅を見据えた保険点数の配分が検討されています。
4.DPC医療については、高額な治療薬との調整は今後ますます重要視されるでしょう。
5.地域連携については、就労支援に関する仕組みつくりが必要になるとされています。







