この講義で伝えたいこと
バイオ医薬品市場は年々増加し、2017年には世界売上上位10品目のうち9品目がバイオ医薬品となりました。そして国民医療費が43兆円を超えたいま、医療費適正化効果の観点からバイオシミラーが注目され、骨太の方針2019には「バイオ医薬品の研究開発の推進を図るとともに、バイオシミラーについては、有効性・安全性等への理解を得ながら研究開発・普及を推進する」と明記されるなど、バイオ医薬品の発展は国の重要課題に位置づけられています。
この講義では、MRとして押さえておくべきバイオ医薬品に関する最低限の知識と、バイオ医薬品をめぐる動向を中心に解説していきます。
バイオ医薬品基本知識の振り返り
まずは、バイオ医薬品に関する基本的な知識の振り返り学習を行います。
バイオ医薬品とは
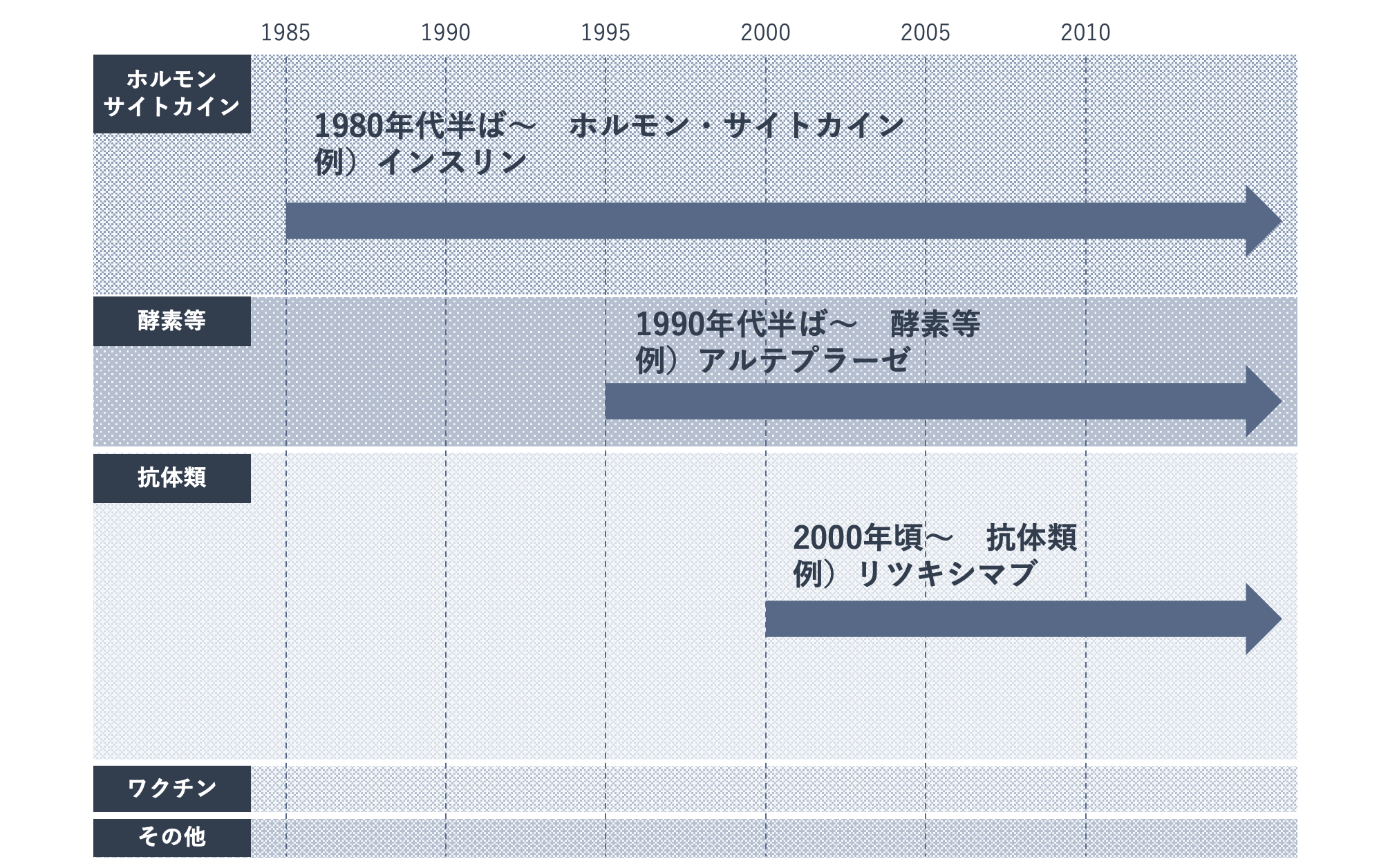
バイオ医薬品とは、遺伝子組換え技術や細胞培養技術といったバイオテクノロジーを応用して製造される医薬品です。最初に開発されたバイオ医薬品はヒトインスリン製剤で、日本での承認は1985年のことでした。
以降、生体内で分泌されるホルモンやサイトカイン(※)、抗体などのタンパク質をもとに作られる医薬品から、細胞やウイルスといった生物由来の物質により産生される医薬品まで、多くの医薬品が開発されてきました。
※サイトカイン:免疫細胞などから放出される生理活性タンパク質の総称。インターフェロンやインターロイキンなど、数百種類存在し、その作用もさまざまで、免疫細胞の活性化や機能抑制に関わる。
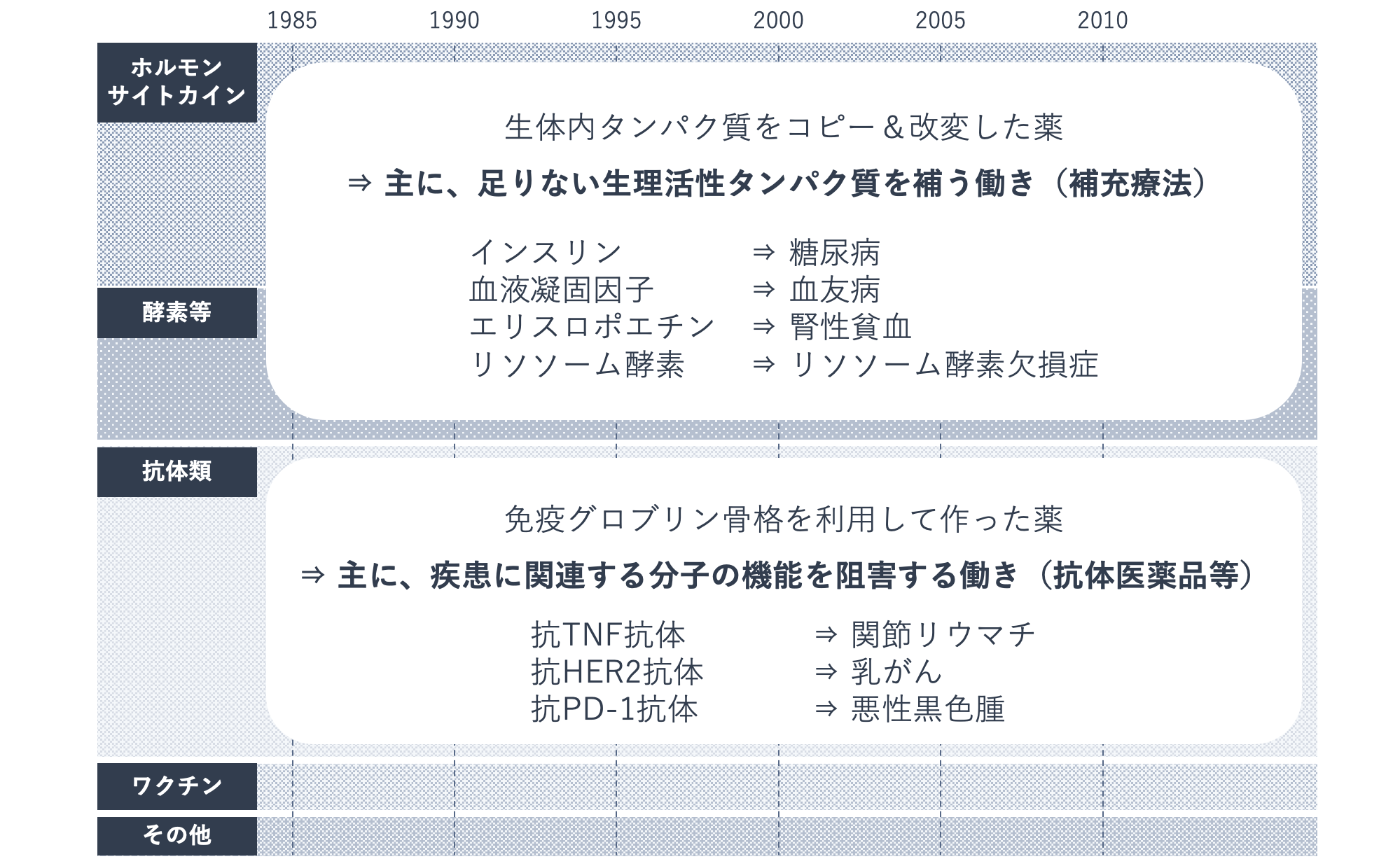
バイオ医薬品は、体内で足りなくなった生理活性タンパク質を補う医薬品と、疾患に関連する分子の働きを阻害する抗体医薬品に大別されます。
前者の例としては、インスリン製剤、血液凝固因子製剤、エリスロポエチン製剤などがあり、第一世代のバイオ医薬品と呼ばれます。後者には、抗TNF抗体、抗HER2抗体、抗PD-1抗体などがあり、第二世代のバイオ医薬品と呼ばれます。
バイオ医薬品の特徴
バイオ医薬品の特性は、アミノ酸から構成されるタンパク質を有効成分としていることです。つまりバイオ医薬品は高分子医薬品です。バイオ医薬品に対し、よく比較に挙げられるのが化学合成により作られる低分子医薬品(化学合成医薬品)です。
バイオ医薬品と低分子医薬品の違いをまとめるとこうなります。
バイオ医薬品と化学合成医薬品の違い
| 項目 | バイオ医薬品 | 化学合成医薬品 |
|---|---|---|
| 製造方法 | 細胞で生産 | 化学合成 |
| 製造プロセス | コントロールのためには より多くのデータが必要 | コントロール可能 |
| 製造コスト | 非常に高い | 低い |
| 薬価 | 高額 | 比較的低い |
| 製品数 | 約130種類 | 数多くの医薬品 |
| 剤形 | 主に注射剤 | 錠剤等多種類 |
| 分子量 | 非常に大きい(数千~15万程度) | 小さい(多くは500以下) |
| 構造 | 分子量が大きく、有効成分に 糖鎖構造等の不均一性がある | 明確に定義され安定した化学構造 |
| 特性解析 | 多面的評価が必要 | 物理化学的評価で明確 |
| 血中半減期 | 数時間~数週間程度 (IgGやアルブミン) | 数時間~数日程度 |
令和元年度厚生労働省主催バイオ医薬品・バイオシミラー講習会 医師向け講習会資料 より作成
タンパク質自体が不安定な高分子物質であることから、バイオ医薬品には、分子構造上不均一なものが産生される可能性が本質的に存在し、製造プロセスのさまざまな因子に影響を受けやすいという特徴があります。また、細胞培養などを行うための大規模な設備が必要であるなどの理由から、製造コストは非常に高くなります。
なお、バイオ医薬品の剤形は主に注射剤です。すべて医療用医薬品であり、一般用医薬品はありません。
バイオ医薬品には、低分子医薬品では十分に解決できなかった、がんや自己免疫疾患など難治性疾患への治療効果が期待されます。また、有効成分がタンパク質のため代謝されるとアミノ酸に分解されること、標的分子への特異性が高いことから、オフターゲット(※)による副作用(標的分子を介さない副作用)が少ないという意義があります。
※オフターゲット:本来の目的とする標的をはずれているということ。
バイオ医薬品の意義
令和元年度厚生労働省主催バイオ医薬品・バイオシミラー講習会 医師向け講習会資料 より作成
- がんや自己免疫疾患など、難治性疾患への治療効果が期待できる
- 有効成分がタンパク質であり、標的分子への特異性が高いため、オフターゲットによる副作用が少ない
しかしまったく有害反応がないわけではなく、薬理作用や免疫原性に起因する有害反応や、インフュージョンリアクション(※)といった副作用も報告されています。
※インフュージョンリアクション(Infusion reaction):注射剤の投与中あるいは投与後24時間以内に生じる急性の過敏症反応の総称。発症機序は明確になっていない。
バイオ医薬品の投与に伴い発現する有害反応の例
| タイプ | 例 | |
|---|---|---|
| 有効成分の作用に起因する有害反応 | 有効成分の過剰な薬理作用に起因(効き過ぎ) | t-PAによる出血傾向 インスリンによる低血糖 |
| 有効成分が複数の薬理作用を持つことに起因 | インターフェロンによる発熱 | |
| 標的分子が複数の生理機能を持つことに起因 | 抗TNF抗体による結核再燃 抗EGFR抗体による皮膚障害 | |
| その他の 有害反応 | 免疫原性(抗薬物抗体の産生)に起因 | エリスロポエチン製剤による赤芽球癆 |
| 不純物等に対するアレルギー反応 | 糖鎖α-galとIgEとの反応 宿主細胞由来タンパク質によるアレルギー | |
| 感染性因子混入 | ウイルス、プリオン等の伝播(実例なし) | |
令和元年度厚生労働省主催バイオ医薬品・バイオシミラー講習会 医療関係者(薬剤師等)向け講習会資料 より作成
免疫原性とは、抗原が抗体の産生や細胞性免疫を誘導する性質をいいます。バイオ医薬品が抗原として作用し、抗薬物抗体産生が誘導される場合があり、治療効果の低下や、患者さん自身の内在性因子に作用して有害反応を起こすことがあります。エリスロポエチン製剤による赤芽球癆(せきがきゅうろう)はその例です。
バイオ医薬品の安全性と品質管理
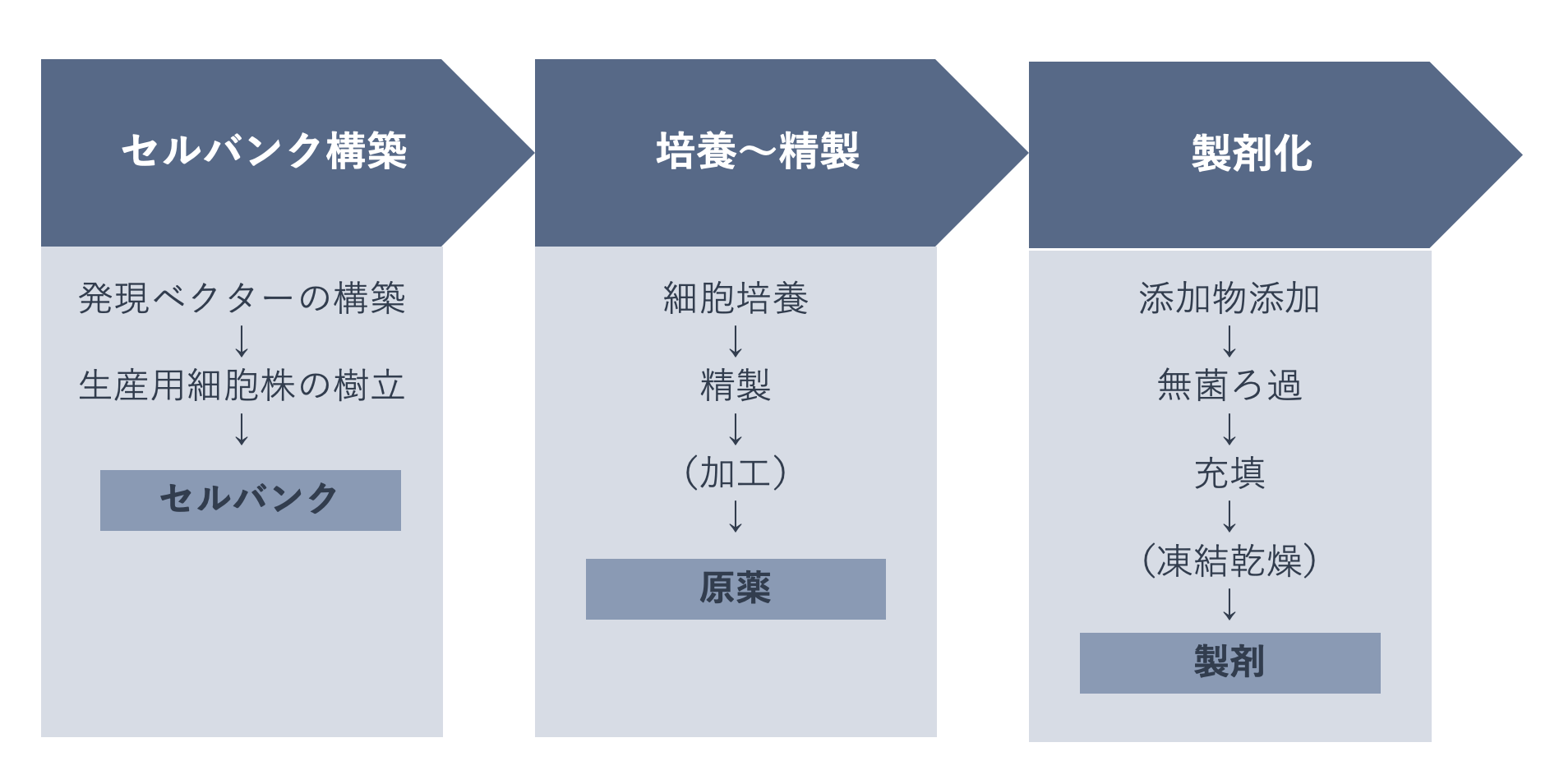
バイオ医薬品の製造工程は、大きく分けて3つのステップからなります。
最初のステップとして、目的のタンパク質を作るために遺伝子組換え技術を用いて生産用細胞株を樹立し、セルバンク(※)を構築します。次のステップでは、大量生産をするために細胞培養を行い、精製し、原薬を製造します。最後のステップとして、添加物添加、無菌ろ過、充填などを行い、製剤となります。
これらの製造工程では、低分子医薬品と比較して大規模な設備が必要であることから、製造コストが高くなります。
※セルバンク:均一な組成の内容物として適切な容器に納めた細胞の収集であり、一定の条件下で保管されるもの。品質の恒常性を確保するため、目的遺伝子を導入して樹立し、適格性を確認した細胞株が複数のバイアルで保管される。
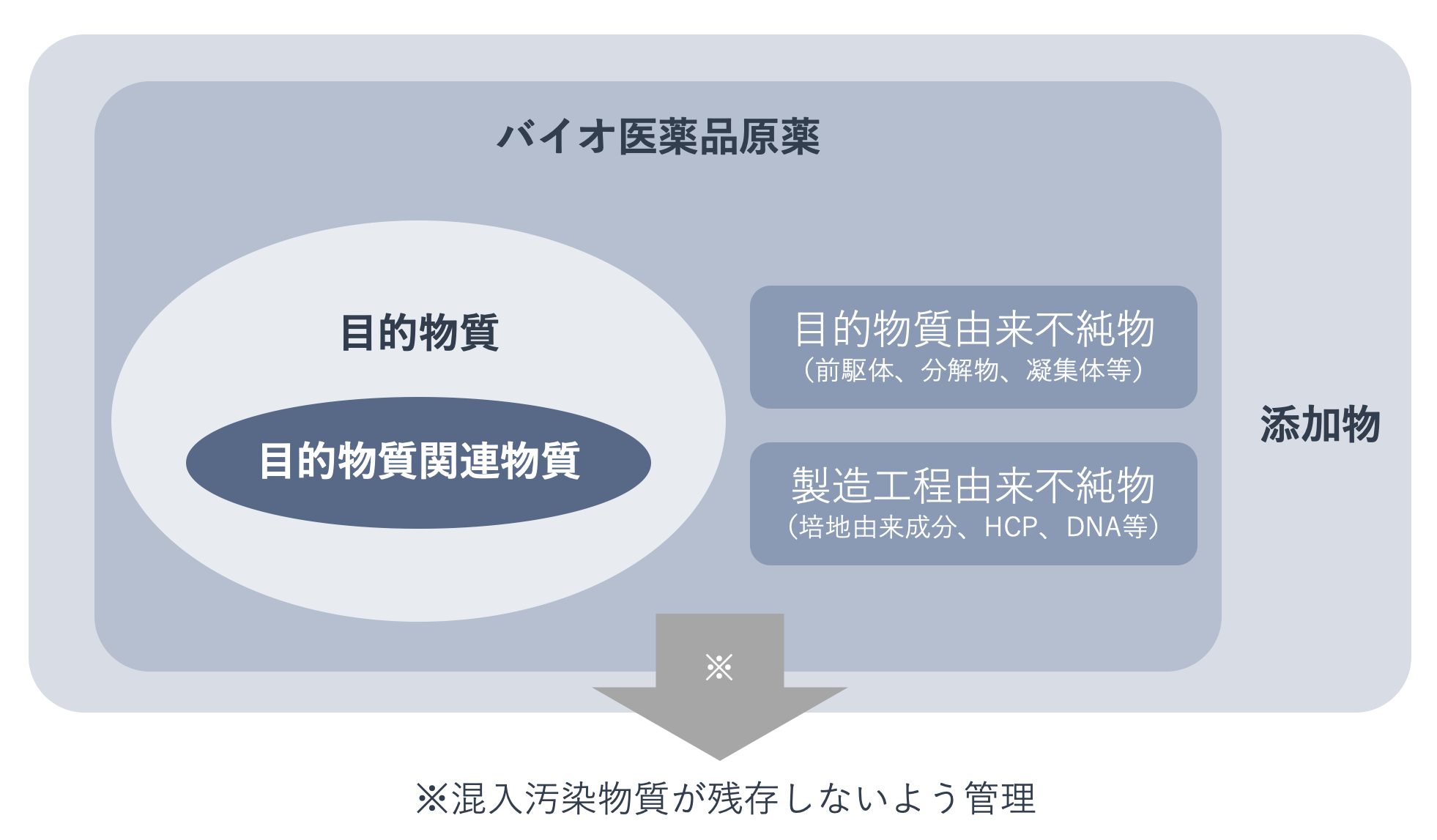
バイオ医薬品の構成成分には、目的物質と目的物質関連物質のほか、目的物質由来不純物、製造工程由来不純物が含まれます。
目的物質由来不純物は目的物質の分子変化体で、生物活性、有効性、安全性の点で目的物質に匹敵する特性を持たないものです。目的物質由来不純物の例として、ジスルフィド結合ミスマッチ体、メチオニン酸化体、糖化体、アスパラギンの脱アミド化、アスパラギン酸の異性化、切断体、電荷の異なる物質(シアル酸付加体等)、糖鎖非付加体、凝集体などが挙げられます。
製造工程由来不純物には、細胞基材に由来するもの、細胞培養液に由来するもの、細胞培養以降の工程である目的物質の抽出・分離・加工・精製工程に由来するものがあります。例として、宿主細胞由来タンパク質(HCP)、宿主細胞由来DNA、培地成分・添加物、細胞分泌物、抽出時に使用する試薬・溶媒や漏出物、無機塩などが挙げられます。
バイオ医薬品に含まれる分子種の定義
| 目的物質 |
|
|---|---|
| 目的物質関連物質 | 製造中や保存中に生成する目的物質の分子変化体で、生物活性があり、製品の安全性及び有効性に悪影響を及ぼさないもの (これらの分子変化体は目的物質に匹敵する特性を備えており、不純物とは考えない) |
| 目的物質由来不純物 | 目的物質の分子変化体(例えば、前駆体、製造中や保存中に生成する分解物・変化物)で、生物活性、有効性及び安全性の点で目的物質に匹敵する特性を持たないもの |
| 製造工程由来不純物 | 細胞基材に由来するもの(例えば、宿主細胞由来タンパク質、宿主細胞由来DNA)、細胞培養液に由来するもの(例えば、インデューサー、抗生物質、培地成分)、あるいは細胞培養以降の工程である目的物質の抽出、分離、加工、精製工程に由来するもの等 |
令和元年度厚生労働省主催バイオ医薬品・バイオシミラー講習会 医療関係者(薬剤師等)向け講習会資料 より作成
バイオ医薬品の構成成分を図であらわすとこのようになります。
ウイルスやマイコプラズマ(※)、プリオン(※)、エンドトキシン(※)など、汚染物質が混入するリスクがありますが、製剤に残存しないよう管理されます。
※マイコプラズマ:細胞壁を持たない非常に小さな細菌。
※プリオン:タンパク質性の感染因子。
※エンドトキシン:グラム陰性菌の菌体成分。発熱性物質であり、極めて微量の混入によって発熱を引き起こす。
バイオ医薬品では、有効成分や不純物がヒトに何らかの免疫応答を引き起こす可能性について留意が必要です。また、ヒトや動物の細胞を用いて生産されるため、特にウイルスなど感染症の発症リスク面からみた安全性の確保も重要です。
こうした特性を踏まえ、バイオ医薬品の品質管理には製造工程の管理と製品の品質試験の双方が不可欠であり、化学合成医薬品とは異なる品質評価試験が行われます。
バイオ医薬品原薬の品質管理
| 製造工程の管理 |
|
|---|---|
| 製品の品質試験 |
|
令和元年度厚生労働省主催バイオ医薬品・バイオシミラー講習会 医療関係者(薬剤師等)向け講習会資料 より作成
バイオ医薬品は温度や光により品質が変化することがあるため、出荷までの保管に加え、医療機関や患者さん宅での保管まで、適切な管理を行う必要があります。品質の変化は有効性、安全性に影響する可能性があるため、保存条件を逸脱しないよう細心の注意を払う必要があります。
また、凍結乾燥品など調製が必要な注射剤では、