この講義で伝えたいこと
血液製剤は、赤血球、血小板、蛋白成分、血液凝固因子といった血液成分の量や機能が低下した時にその成分を補う補充療法に用いられ、現代医療にとって不可欠なものとなっています。そしてその原料は言うまでもなく、人の血液です。
血液製剤を供給する現在の血液事業には、薬害エイズと薬害肝炎の反省が込められています。安全対策が強化され、生産や流通も通常の医薬品とは異なる体系が確立されています。
この講義を通して、薬害への反省から敷かれた血液製剤の安全対策体制を学び、現代医療に大きく貢献する血液製剤の安全性の確保がいかに重要かを再認識するきっかけとしましょう。
本編の前に
本編をはじめる前に、独自に行ったアンケート調査の結果の紹介と、用語の確認をしておきます。
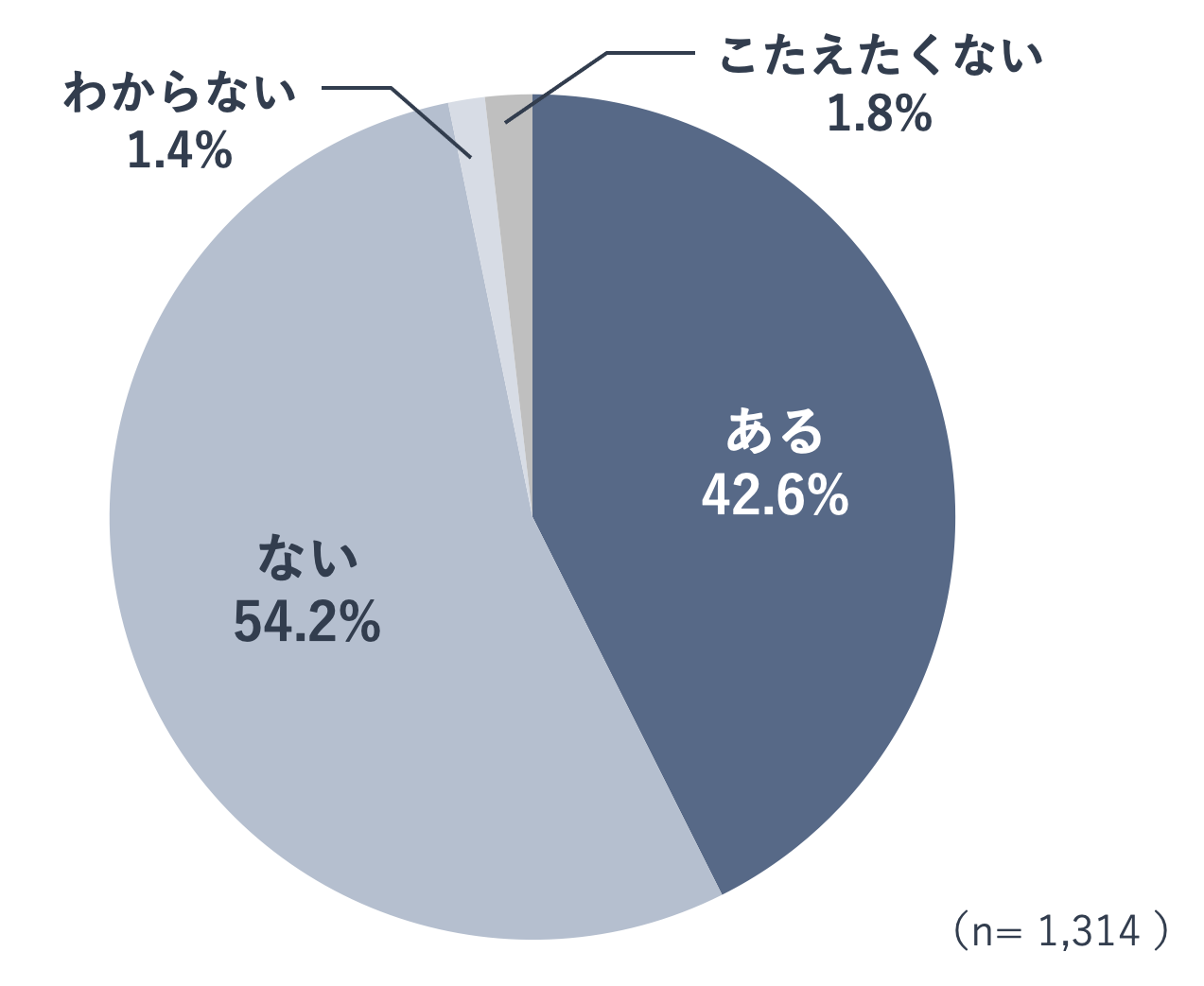
献血の経験についてのアンケート調査
年齢性別や職業を問わず16歳以上の一般の人へ、「献血をした経験はありますか」と質問したところ、42.6%の人が「ある」と回答し、54.2%の人が「ない」と回答しました。
【参考】献血(全血献血:200mL献血)は16歳から可能。
なお、「ある」と回答した人を年代別にみると、年齢層が高くなるにつれて、「ある」と回答した人の割合が大きくなっていました。
「献血」とは
献血とは、「自発的な無償供血」と定義されています。血液製剤を必要とする患者さんのために、血液を提供する者が、自らの意思で、金銭などの報酬なしに、血液を提供するものです。
献血とは、「自発的な無償供血」のことであり、血液製剤を必要とする患者さんのために、供血者(血液を提供する者)が血液を自らの意思で提供し、かつそれに対して、金銭又は金銭の代替とみなされる物の支払を受けないことをいいます。
厚生労働省「令和2年度血液事業報告」より
血液製剤の基本知識と適正使用
ここから、講義の本編をはじめます。まずは、血液製剤の基本知識と適正使用についてみていきます。
血液製剤の種類と用途
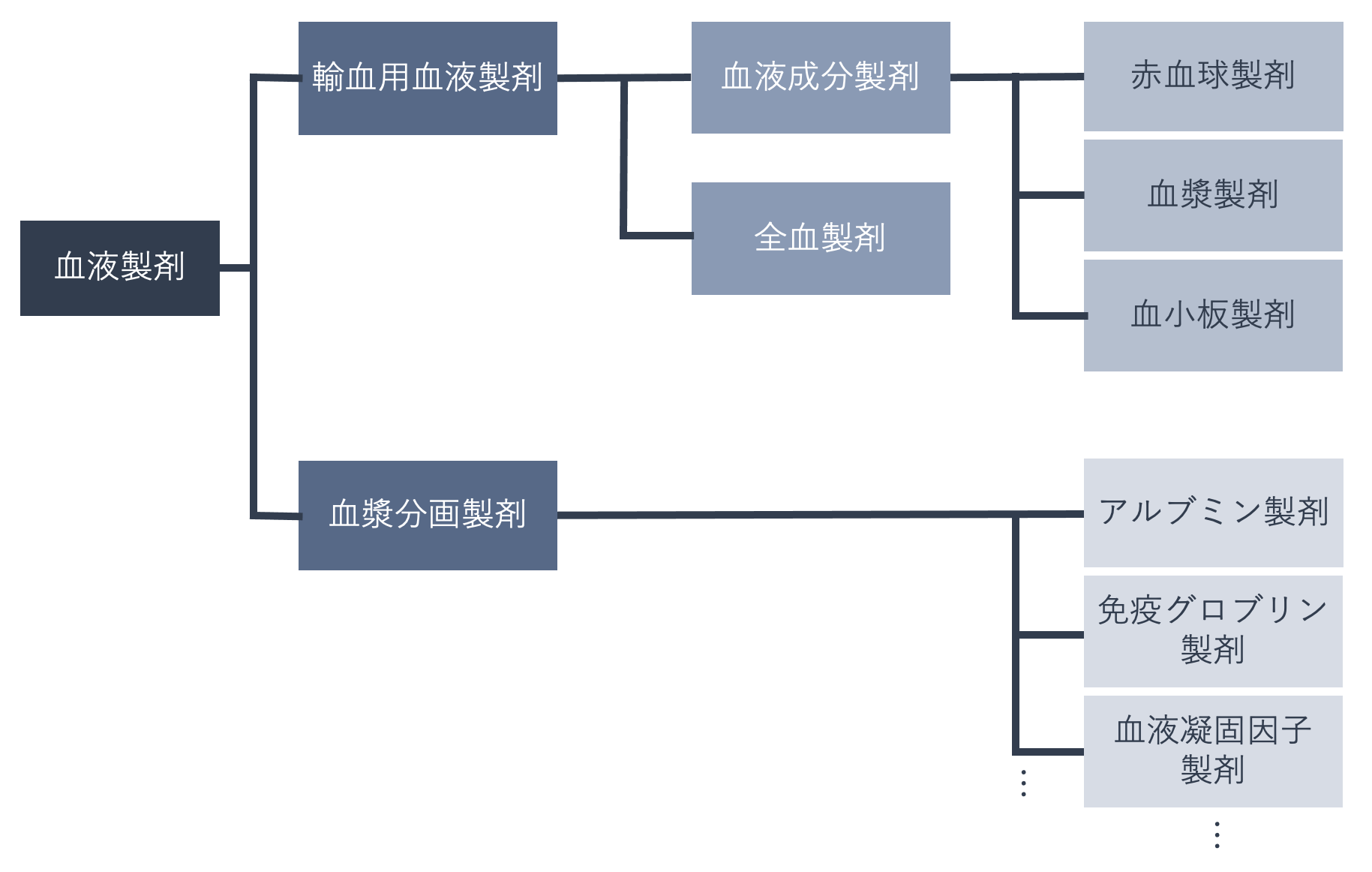
血液製剤とは、人の血液またはこれから得られた物を有効成分とする医薬品のことで、輸血用血液製剤と血漿分画製剤に分かれます。
輸血用血液製剤は、人の血液成分の全部からなる全血製剤と、成分の一部を分離・調製した血液成分製剤(赤血球製剤、血漿製剤、血小板製剤)があります。受血者の心臓などに与える負担や副作用を考慮して成分輸血(※)が普及したため、現在では全血製剤はほとんど使用されていません。
血漿分画製剤は血漿中のタンパク質を成分ごとに分離精製したもので、アルブミン製剤、免疫グロブリン製剤、血液凝固因子製剤などがあります。
※成分輸血:人の血液をそのまま輸血せず、必要な成分のみを輸血すること。受血者にとって不必要な成分が輸血されないため、心臓や腎臓といった循環器への負担が軽減できる。
輸血療法の主な目的は、血液中の赤血球などの細胞成分や凝固因子などの蛋白質成分が量的に減少または機能的に低下したときに、その成分を補充することにより臨床症状の改善を図ることにあります。
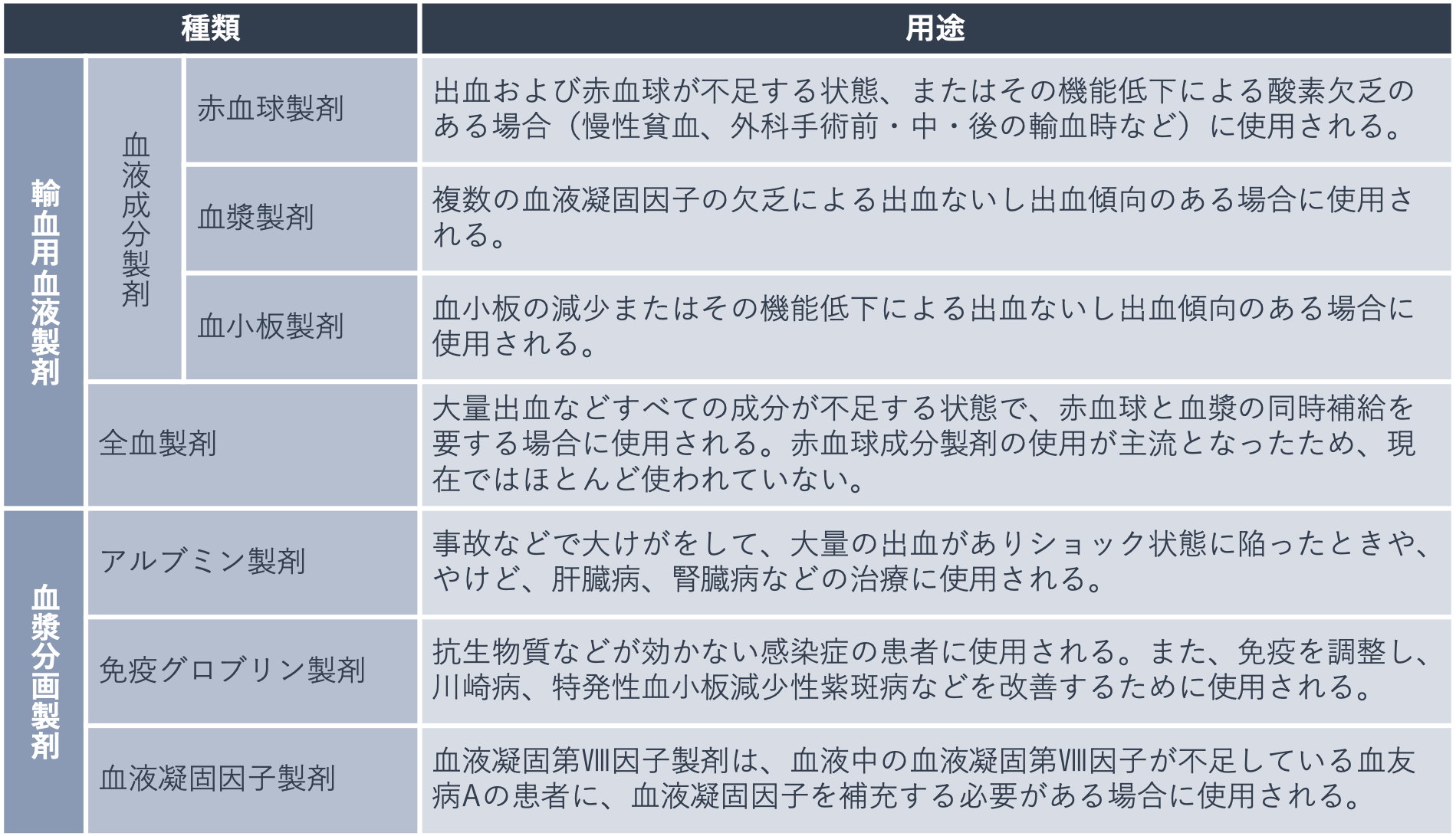
下の表は、血液製剤の主な用途をまとめたものです。このように、血液製剤は多くの疾患の治療や救命のために用いられ、また、一部の疾患の患者さんにとっては生命維持に不可欠なものです。
血液製剤の適正使用の重要性
1975(昭和50)年、血液および血液製剤に関するWHO決議で、無償血液を基本として各国の血液事業を推進することが加盟国に勧告されました。
血液及び血液製剤に関するWHO決議(抜粋)
(加盟国に対する勧告)
- 無償献血を基本として各国の血液事業を推進すること
- 血液事業の運営を管理するために効果的な法律を制定し、献血者と血液あるいは血液製剤の投与を受ける者の健康の保持・増進のために必要な措置をとること
厚生労働省ウェブサイト「血液事業の考え方の経緯」ページ より作成
「血液事業」とは、一般に、血液を提供する者を募集して血液を採取し、血液製剤として、治療を必要とする患者さんのため、医療機関に供給する一連の事業をいいます。
血液製剤は人の血液を原料としていることに鑑み、倫理性、国際的公平性などの観点から、自国内で献血により得られた血液を用いて製造する国内自給の確保が、国際的な原則となっています。
現在、日本では、輸血用血液製剤と血液凝固第Ⅷ因子製剤の国内自給率はそれぞれ100%に達していますが、アルブミン製剤や免疫グロブリン製剤、その他の特殊な血漿分画製剤に関しては血漿や製剤を輸入しています。
【参考】現在、日本国内に流通している血液製剤の採血国は、日本、アメリカ、ドイツ、オーストリア、フィンランド、スイス、ポーランドの7か国。
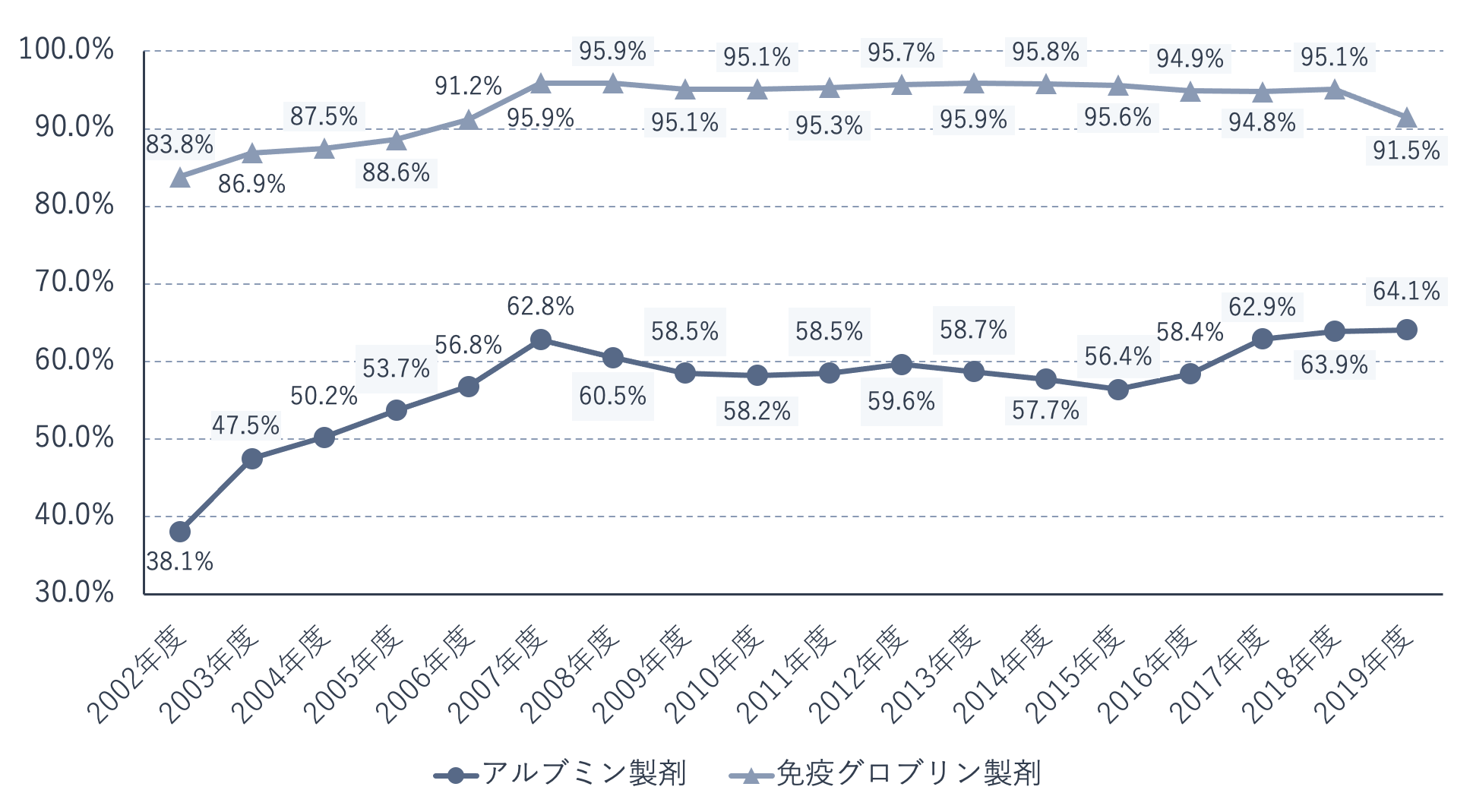
下の図は、アルブミン製剤と免疫グロブリン製剤の国内自給率の推移を示したものです。2019年度の国内自給率はアルブミン製剤が64.1%、免疫グロブリン製剤が91.5%でした。これらについては、適正使用の推進などにより、必要とされる製剤を原則として国内の献血で賄うことを目指しています。
血液製剤は、人の血液という、限りある貴重な資源を原料にしています。そのため、適正に使用されなければなりません。
厚生労働省は、「輸血療法の実施に関する指針」や「血液製剤の使用指針」を策定し周知するほか、医療機関における血液製剤の管理体制や使用実態の調査などを実施し、適正使用を推進しています。
【参考】特に「血液製剤の使用指針」には、各種血液製剤を使用する疾患について記載があるため、目を通しておくとよい。
血液製剤の安全対策体制
ここからは、血液製剤の安全対策体制についてみていきます。
血液事業のあゆみと輸血後感染症の歴史
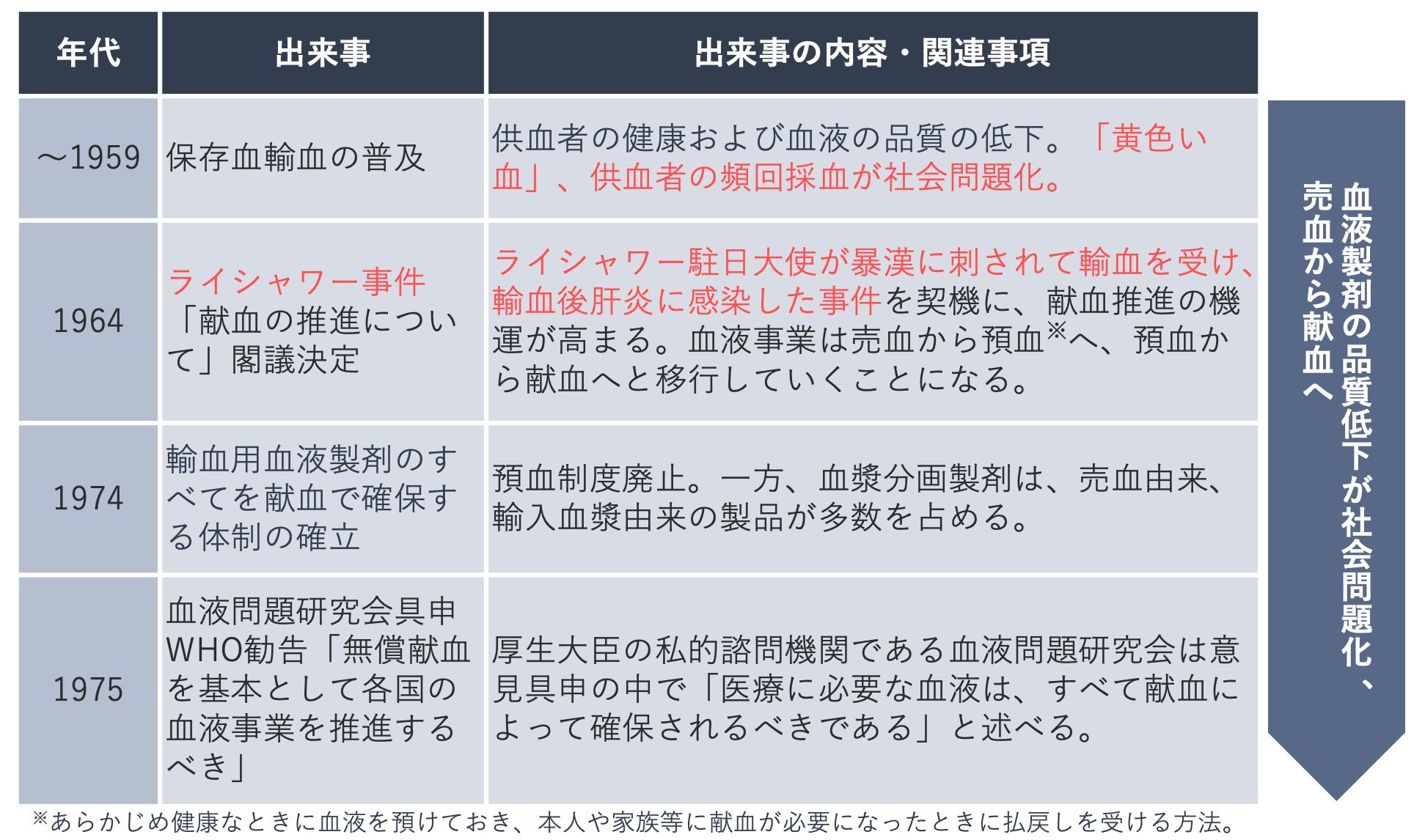
日本の血液事業のあゆみは、輸血後感染症とその背景にあった社会問題とを切り離すことはできません。
国内で輸血医療が始まったのは1919年とされています。当時は供血者と受血者が並び、注射器で採取した血液を感染症の検査を行わずそのまま受血者に輸血する、いわゆる「枕元輸血」が行われていました。
1948年、東大病院で発生した輸血による梅毒感染事件を契機にGHQが日本政府に対し輸血対策の確立を促し、1950年には日本で初の血液銀行(※)が設立、保存血液を利用した輸血が普及します。
※血液銀行:輸血用血液の採取、保存、供給等の業務を行う組織。民間の血液銀行と日本赤十字社血液銀行があった。民間の血液銀行は供血者に金銭を支払っていたが、日本赤十字社の血液銀行では当初から無償の献血を行っていた。
しかし、民間の血液銀行が血液を買い取ったことで献血者は減少していき、輸血用血液の原料は主に売血された血液となりました。当時は現在のような採血基準がなく、失業者や低所得の人たちなどが、赤血球が十分に回復する前に売血を繰り返したことから、輸血用血液は血漿ばかりが目立つ「黄色い血」と呼ばれました。また注射器の使い回しで肝炎に感染した麻薬常習者なども売血を行っており、感染症のリスクも高かったことから、輸血用血液の品質低下が社会問題となりました。
1964年、ライシャワー駐日米国大使が暴漢に刺され輸血を受け、輸血後肝炎に感染するという事件が発生しました。この事件をきっかけに輸血の安全性が一層求められるようになり、輸血用血液製剤の原料は売血から献血による確保へと移行が図られました。
1974年には献血による血液だけで輸血用血液製剤を製造する体制が整えられましたが、原料血漿は献血だけで確保することができず、血漿分画製剤の原料は依然、売血や輸入に頼っていました。
1980年代には、輸入した非加熱血液凝固因子製剤によって薬害エイズと薬害肝炎という甚大な被害をもたらしてしまったことから、血液製剤の国内自給の促進が求められました。
1990年には民間製薬会社による有料採血が中止され、1994年には血液凝固第Ⅷ因子製剤の国内自給の達成に至りました。
1997年の「血液行政の在り方に関する懇談会報告書」では、薬害エイズのような甚大な被害を再びうむことがないよう、これまでの血液事業の反省を踏まえた新たな法制度の整備の必要性が指摘されました。これを受けて2003年に薬事法と採供法(※)が改正され、現在の血液事業の基盤となる法体系へと整えられました。
※採供法:正式名称は「採血及び供血あつせん業取締法」。血液の適正利用、採血に伴う危害の防止、供血者の保護を図ることを目的に1956年に制定された法律。2003年に「安全な血液製剤の安定供給の確保等に関する法律」(いわゆる「血液法」)に改称された。
【参考】薬事法は2013年の一部改正により、2014年11月より「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(医薬品医療機器等法)に改称された。
血液製剤に関する安全対策の仕組み
現在の血液事業には、甚大な被害をもたらした薬害エイズと薬害肝炎への反省と、このような被害を二度と起こさないという決意が込められています。
血液事業は、「安全な血液製剤の安定供給の確保等に関する法律」(血液法)に則って、血液製剤の安全性の向上、献血による国内自給および安定供給の確保、適正な使用の推進、公正の確保および透明性の向上を基本理念に掲げ、各種取り組みが進められています。
血液法の基本理念
- 安全性の向上
- 献血による
・国内自給の原則
・安定供給の確保 - 適正使用の推進
- 血液事業の運営に係る公正の確保及び透明性の向上
厚生労働省「令和2年度血液事業報告」 より作成
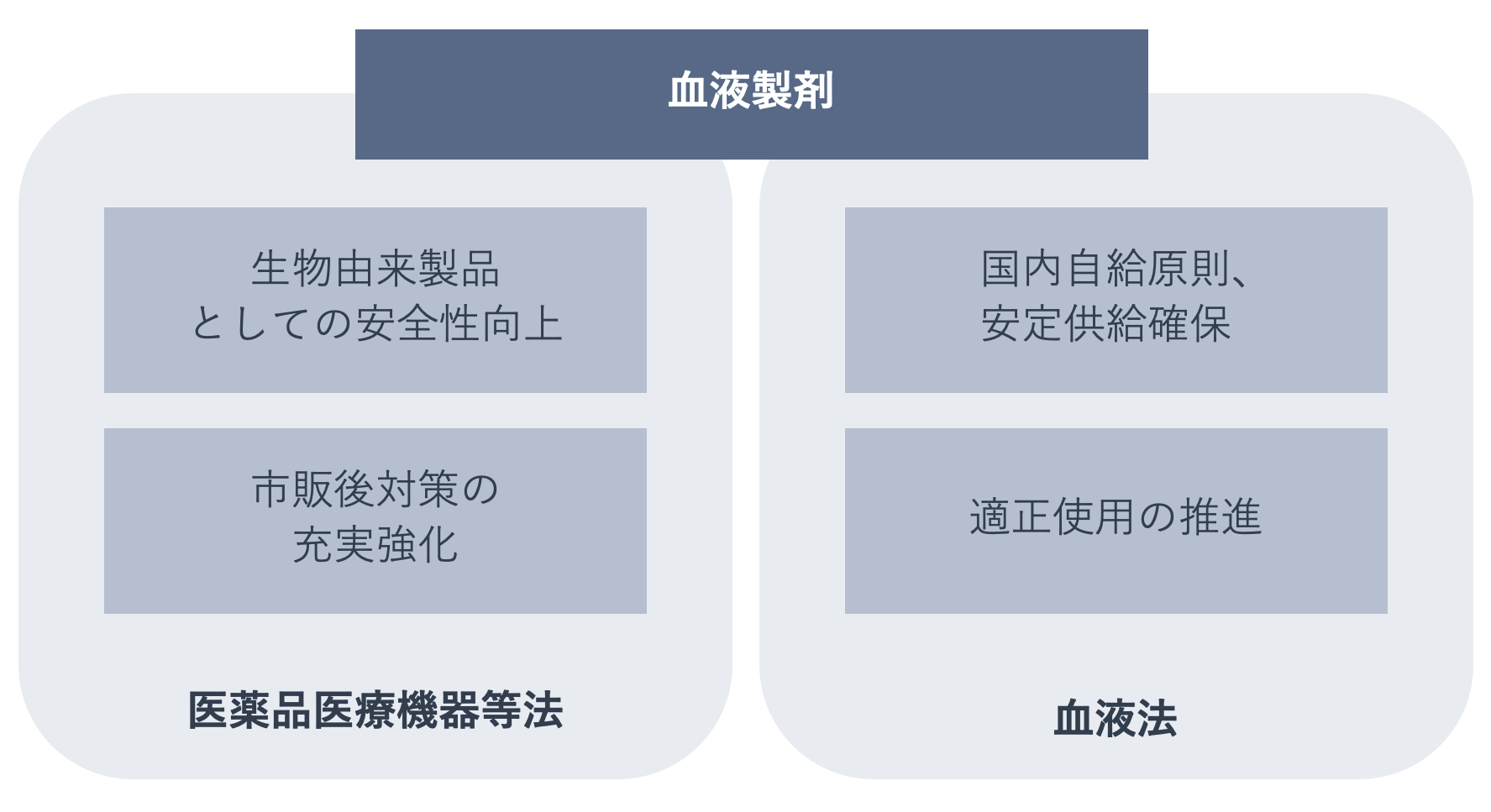
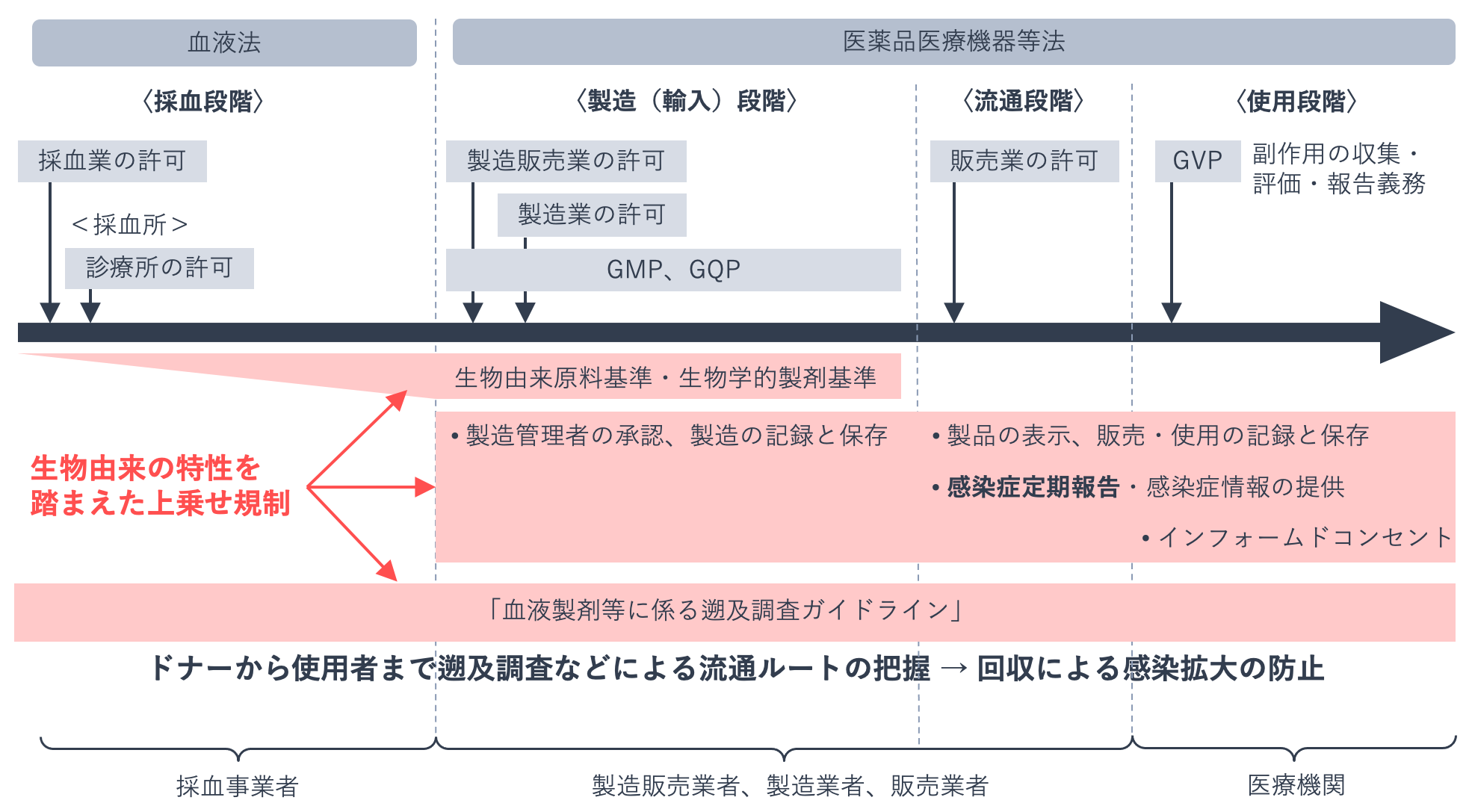
下の図は、血液製剤に関する医薬品医療機器等法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)と血液法の関係を表したものです。血液製剤は、安定供給と適正使用については血液法で、安全対策については医薬品医療機器等法で規制されています。
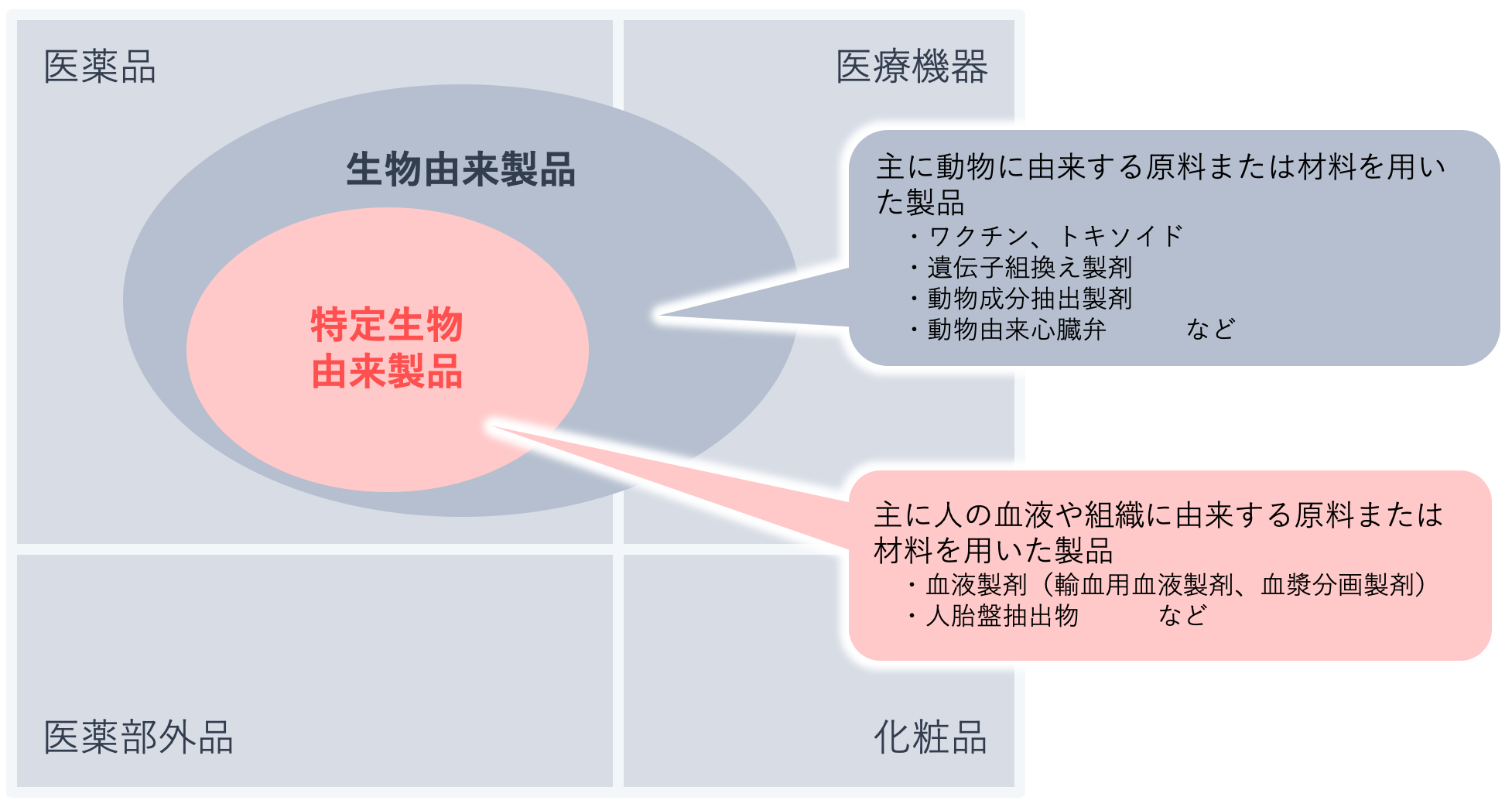
血液製剤は人の血液を原料とする医薬品であることから感染症のリスクがあり、保健衛生上特別の注意を要します。そのため医薬品医療機器等法において「特定生物由来製品」に指定され、品質管理や製造販売後安全管理には通常の医薬品よりも厳しい基準が設定されています。
さらに、受血者の安全を守るために、献血者の選択基準や病原体の検査に関する項目が医薬品医療機器等法に基づく生物由来原料基準などで規定されています。そのほか、流通段階では製品や添付文書への適切な表示、ドナー記録と販売記録の保管、感染症定期報告の義務が、使用段階では医療機関での患者への適切な説明(インフォームドコンセント)、使用記録の作成と保管、感染症発生時の情報提供が課せられるなど、通常の医薬品に対する規制に上乗せした安全対策体制が敷かれています。
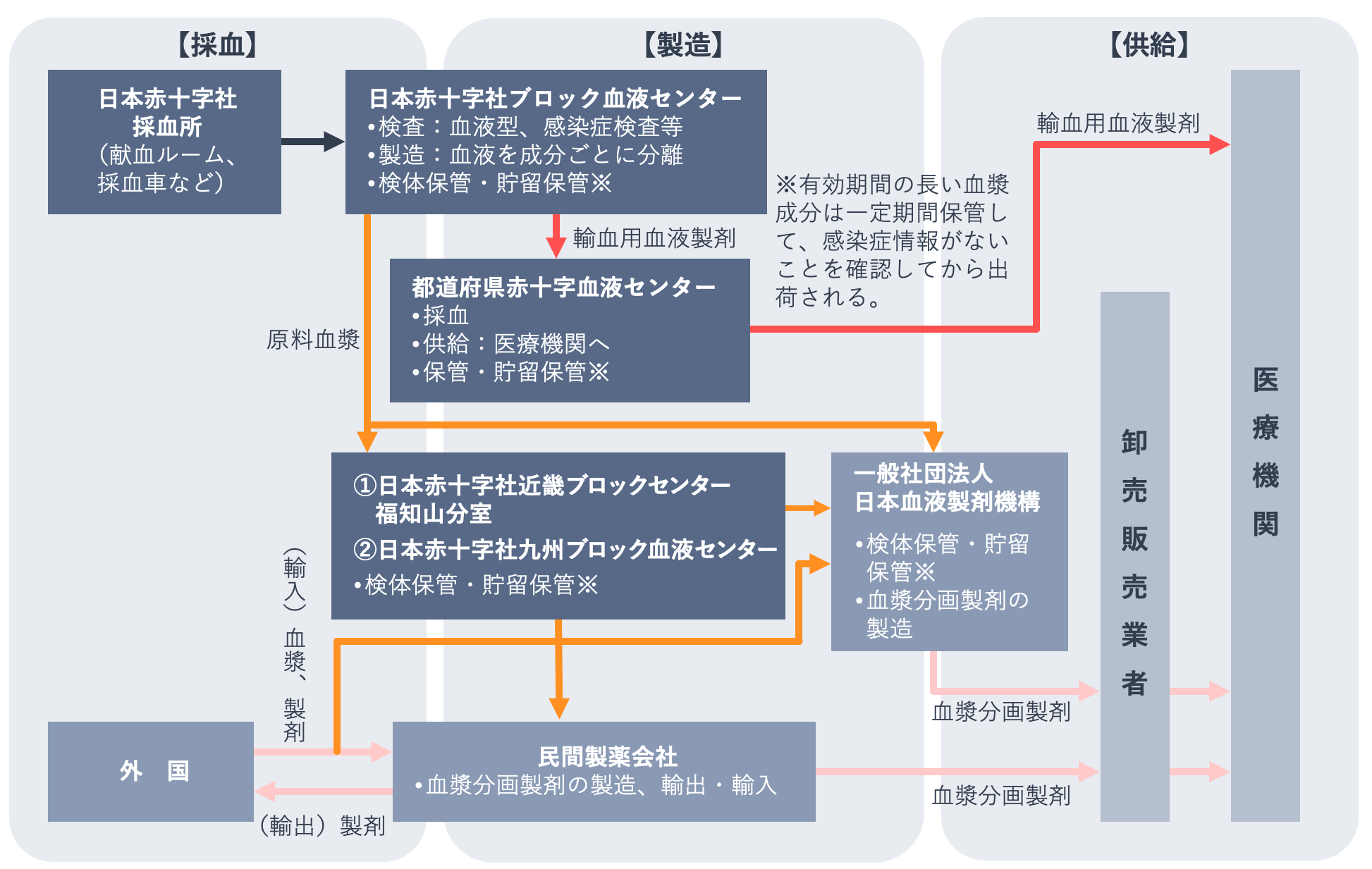
血液製剤供給までの流れ
下の図は、採血から血液製剤供給までの流れを示したものです。
献血は、国内唯一の採血事業者である日本赤十字社の採血所(献血ルーム、採血車など)で行われます。採取された血液は、同社のブロック血液センターにて血液の安全性が確認されたうえで、輸血用血液製剤や血漿分画製剤の原料である原料血漿に調製されます。その後、輸血用血液製剤は医療機関に直接供給され、原料血漿は一般社団法人日本血液製剤機構と民間の製薬企業で血漿分画製剤に加工・製造され、卸売販売業者を通して医療機関に供給されます。
献血から血液製剤が製造されるまでの安全対策
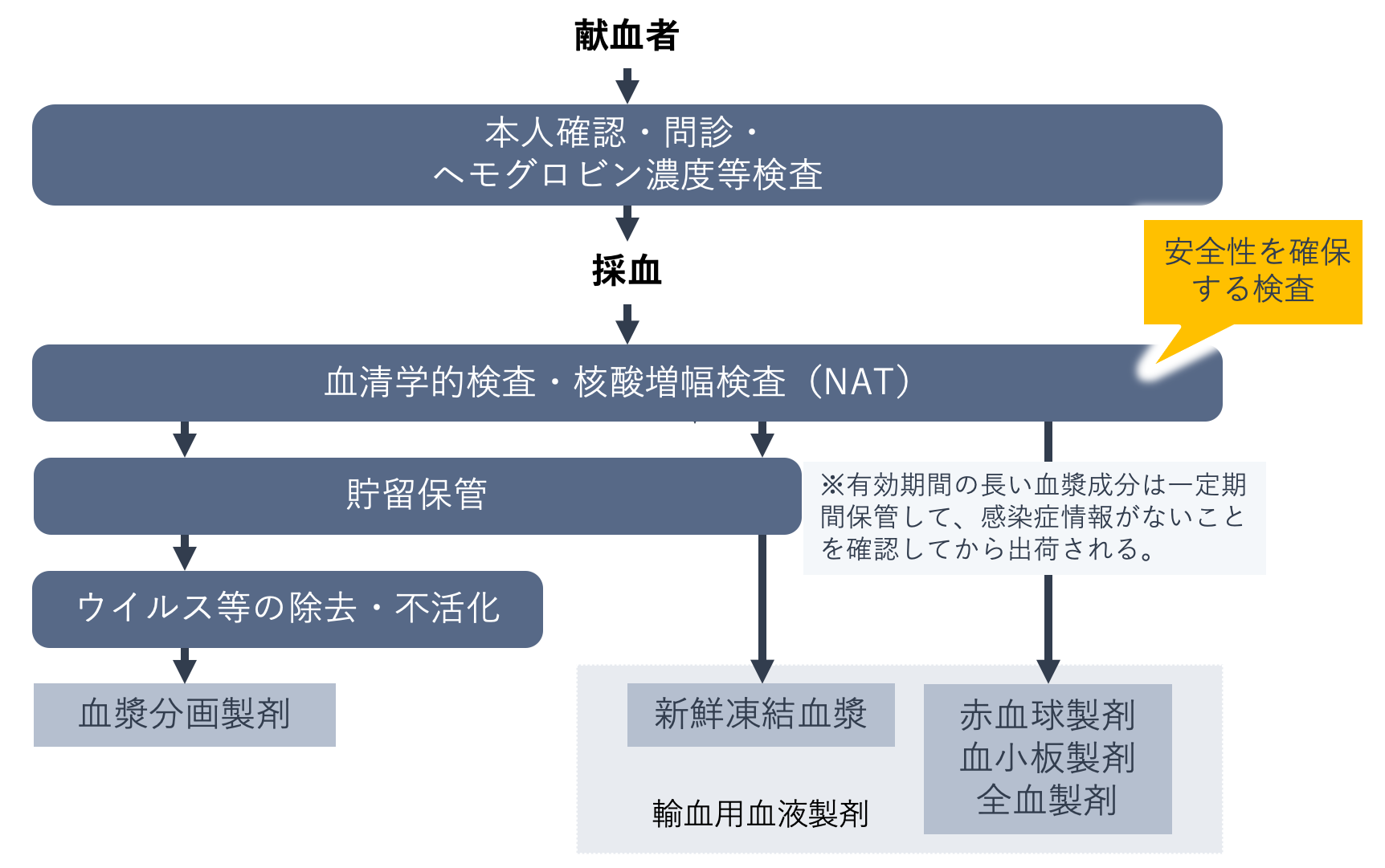
血液製剤は人から採取された血液を原料とすることから、血液を介して感染する病原体が混入するリスクがあります。そのため、献血の受入れから血液製剤が製造されるまでの間、複数の安全対策が講じられます。
献血受付時には公的証明書などによる本人確認が行われます。健康状態と採血基準に適合しているか確認する質問への回答後、回答内容に基づいて問診や血圧測定などが行われ、医師が採血の可否を判断します。この段階では、献血希望者の感染症などに関する既往歴や海外滞在歴、現在の健康状態を確認し、血液を介して感染する病原体への感染の可能性、血液製剤の安全性と有効性に支障をきたす医薬品の服用がないかなどが確認されます。
採血基準に適合していることが確認され採血された血液は、血液製剤としての安全性を確保する検査が行われ、適切と判断された血液だけが血液製剤の製造に用いられます。
血液製剤としての安全性を確保するために、下の表に示した感染症などに関する検査が行われています。
安全性に関する検査項目
| 検査項目 | 検査法 |
|---|---|
| 血液型 | ABOおよびRh検査 |
| B型肝炎ウイルス(HBV) | 抗原検査・抗体検査・NAT |
| C型肝炎ウイルス(HCV) | 抗体検査・NAT |
| ヒト免疫不全ウイルス(HIV) | 抗体検査・NAT |
| ヒトTリンパ球向性ウイルス1型(HTLV-1) | 抗体検査 |
| 梅毒 | 抗体検査 |
| 肝機能(ALT) | 酵素値の測定 |
| ヒトパルボウイルスB19(PVB19) | 抗原検査・NAT(分画の一部) |
厚生労働省「令和2年度血液事業報告」 より作成
抗原検査や抗体検査では体内に侵入した抗原やその抗原に対して産生される抗体を検出し、核酸増幅検査(NAT:Nucleic Acid Amplification Testing)では抗原の遺伝子を構成する核酸の一部を増幅して抗原の有無を検出します。
これらの検査には感度の高い試薬と機器が用いられるようになり、血液製剤による感染症の発症リスクは著しく低下しましたが、今なお感染初期には検査では検出できない期間(ウインドウ期)があります。さらに未知の病原体が出現する可能性があることなどから、血液製剤による感染リスクは現在もゼロではありません。
感染症報告と遡及調査
最後に、感染症報告と遡及調査についてみていきます。
副作用・感染症報告と因果関係の調査
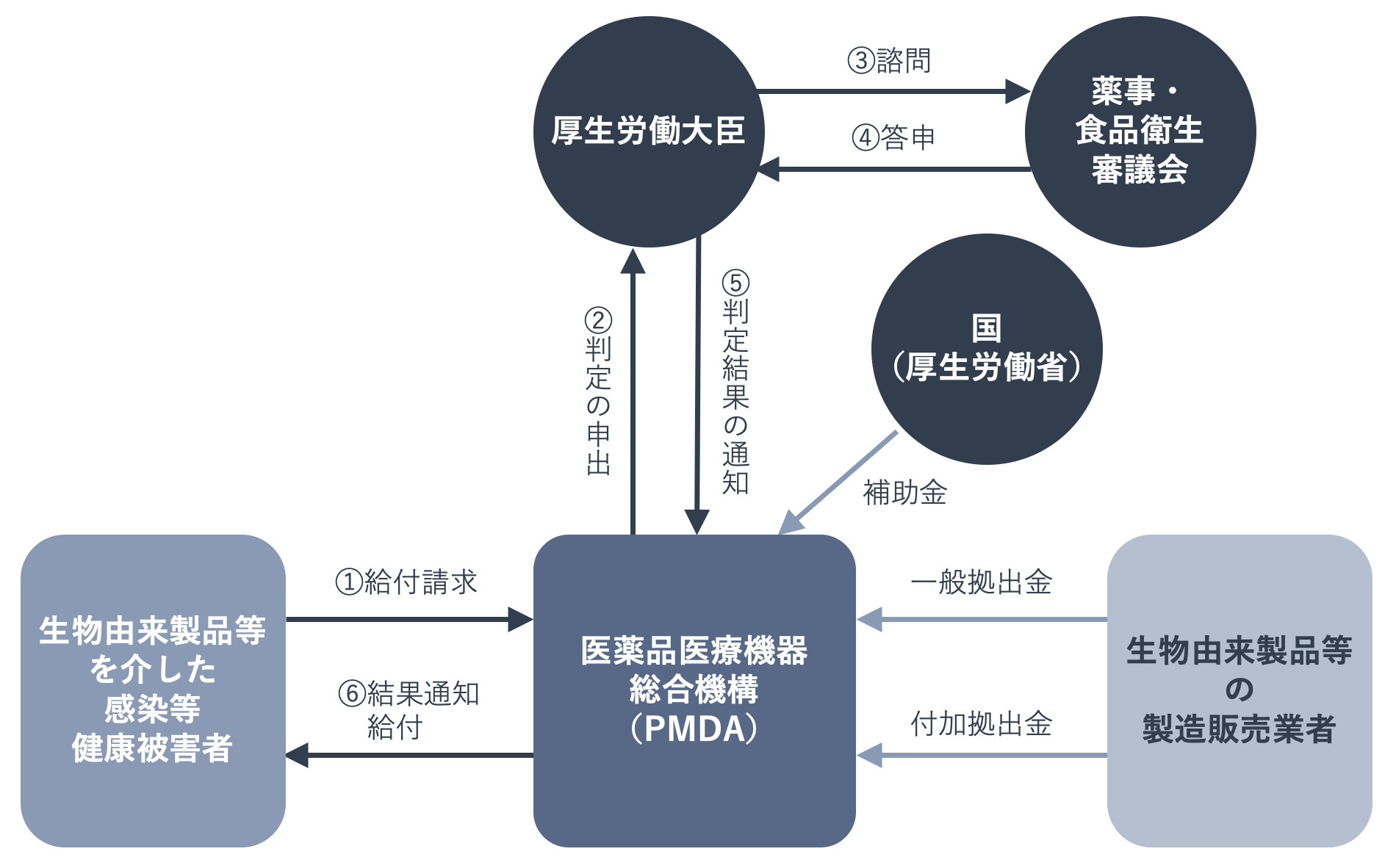
下の図に示したように、血液製剤を使用して副作用や感染症が発生した場合には、医療機関とその血液製剤の製造販売業者は、その旨を厚生労働省(厚生労働大臣)に報告することが義務づけられています。
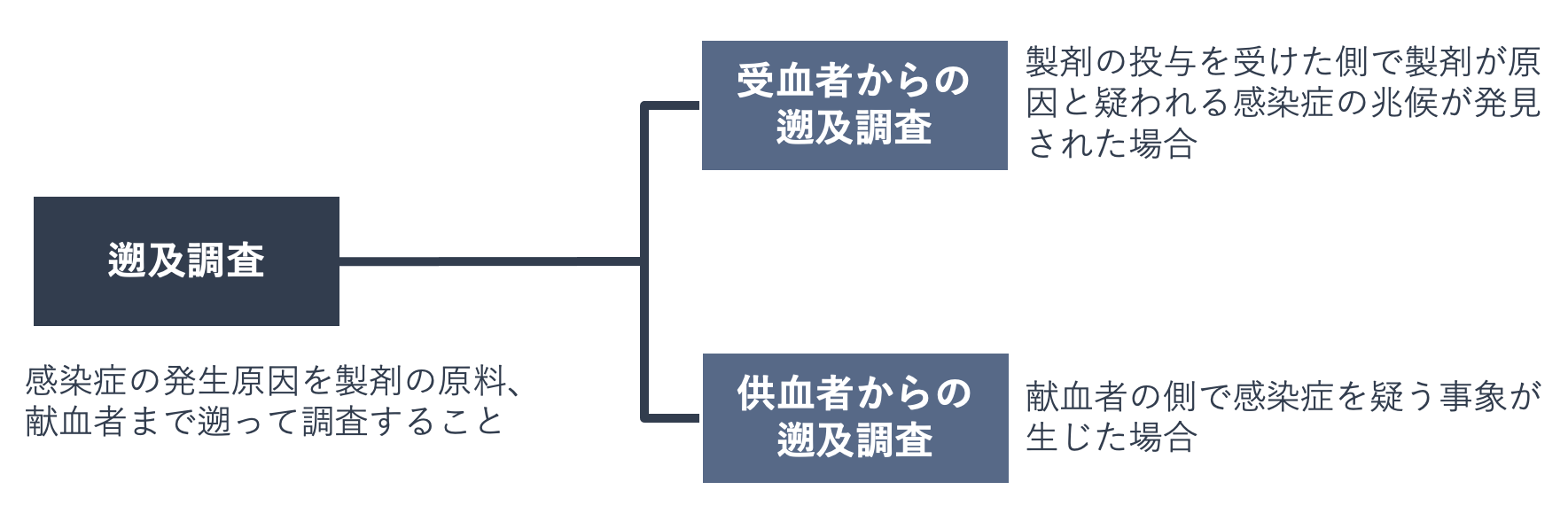
血液製剤を使用したことによる感染が疑われる場合には、使用された製剤による感染・感染疑いと、報告された献血者の感染症・感染症疑いとの間に因果関係があるかどうか調査が行われます。この調査は「遡及調査」と呼ばれ、感染症の発生原因がどこにあるのか、製剤の原料や献血者まで遡って調べます。
遡及調査には、医療機関からの情報に基づき行われる「受血者からの遡及調査」と、献血者側で感染症を疑う事象が生じた場合に行われる「供血者(献血者)からの遡及調査」があり、いずれの場合にも、個別NATやウエスタンブロット法、ウイルス遺伝子の塩基配列の解析などの確認検査が行われます。
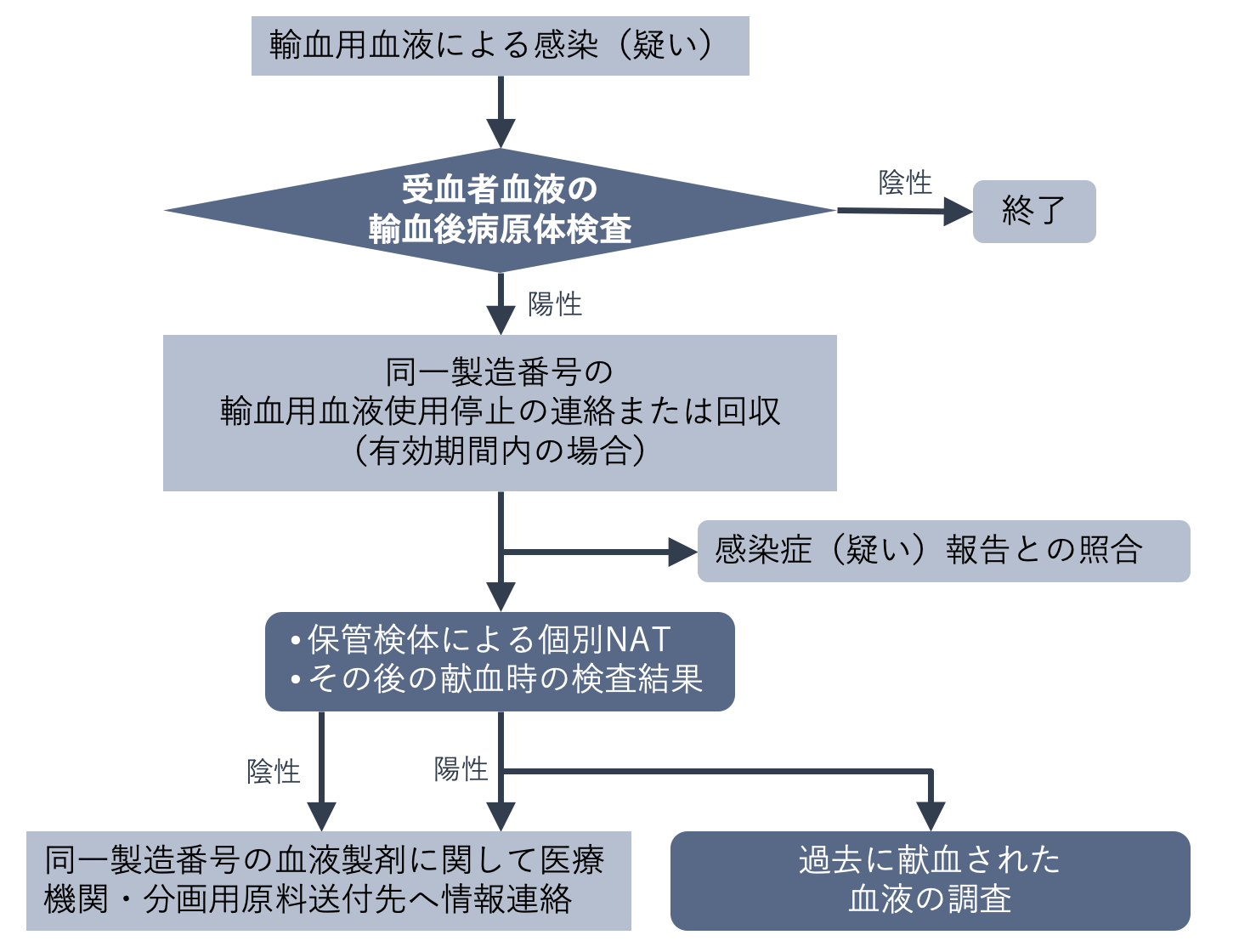
下の図は、受血者からの遡及調査の流れを示したものです。製造販売業者で保存されている検査検体の再検査や献血血液の調査などは、使用された製剤による感染・感染疑いと製剤の原料に因果関係があるかどうか、献血者まで遡って行われます。
供血者(献血者)からの遡及調査は、主に献血者が再び献血に訪れ採取された献血血液が感染症検査で陽性と判定された場合に行われます。この場合には、今回だけでなく、前回の献血に由来する製剤についても使用状況が調査されます。献血血液が未使用であれば回収し、病原体の混入が疑われる血液製剤を投与された患者がいた場合には、その患者に必要な検査を勧奨し、感染症の有無などが確認されます。
下の表は、主なウイルス種とウインドウ期を示したものですが、あくまで平均値であって、感染者の状態など、さまざまな要因により、ある程度変動します。
ウイルス種とウインドウ期
| ウイルス種 | ウインドウ期(平均期間) | ||
|---|---|---|---|
| 抗原・抗体検査 | 20プールNAT | 個別NAT | |
| HIV(ヒト免疫不全ウイルス) | 約19日 | 約13.5日 | 約5日 |
| HBV(B型肝炎ウイルス) | 約36日 | 約44日 | 約21日 |
| HCV(C型肝炎ウイルス) | 約65日 | 約24.5日 | 約3~5日 |
※HIVの場合は、ウイルス血症(感染後1か月以内)後の感染性ウインドウ期
厚生労働省「令和2年度血液事業報告」 より作成
血液製剤による感染症報告状況
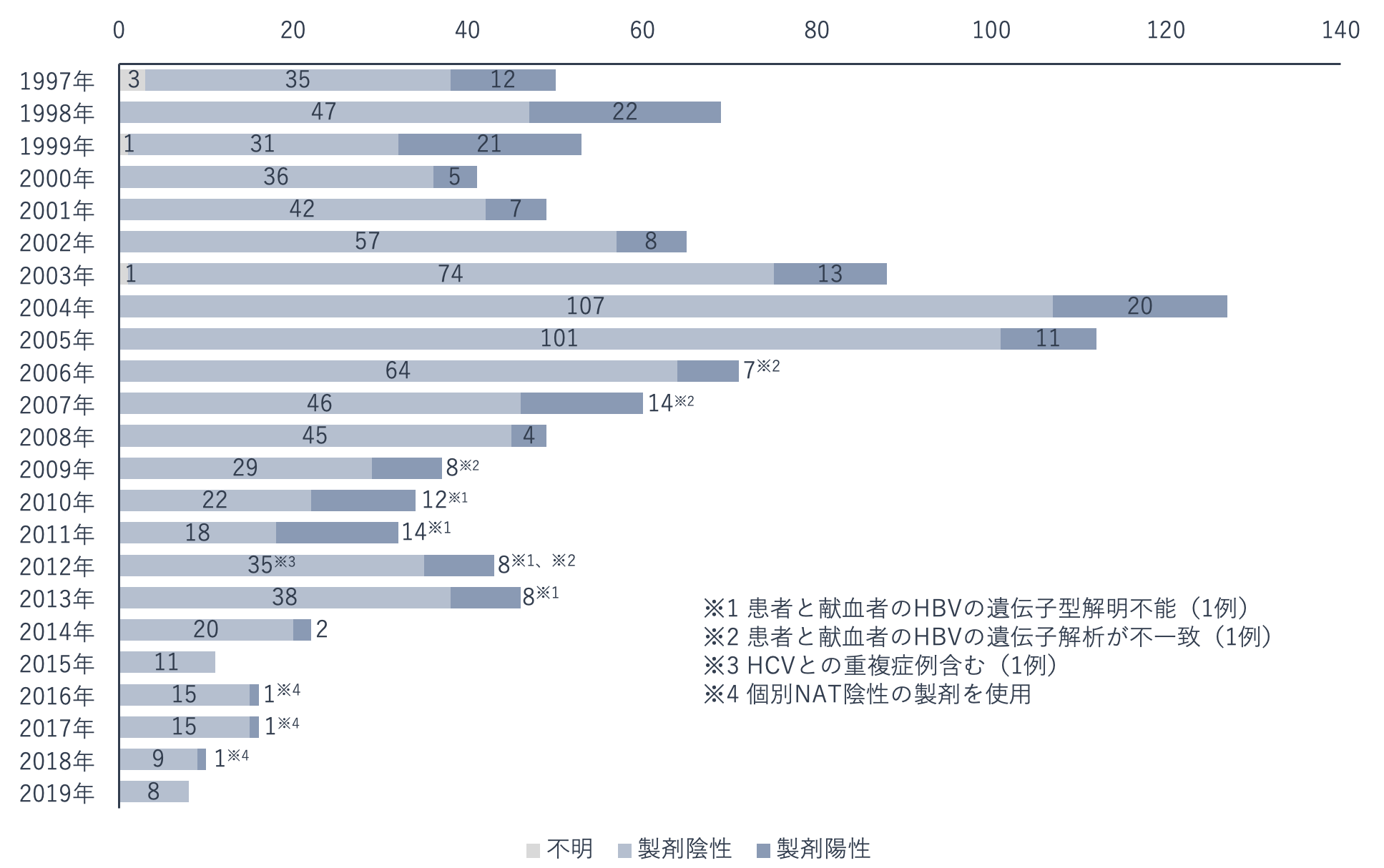
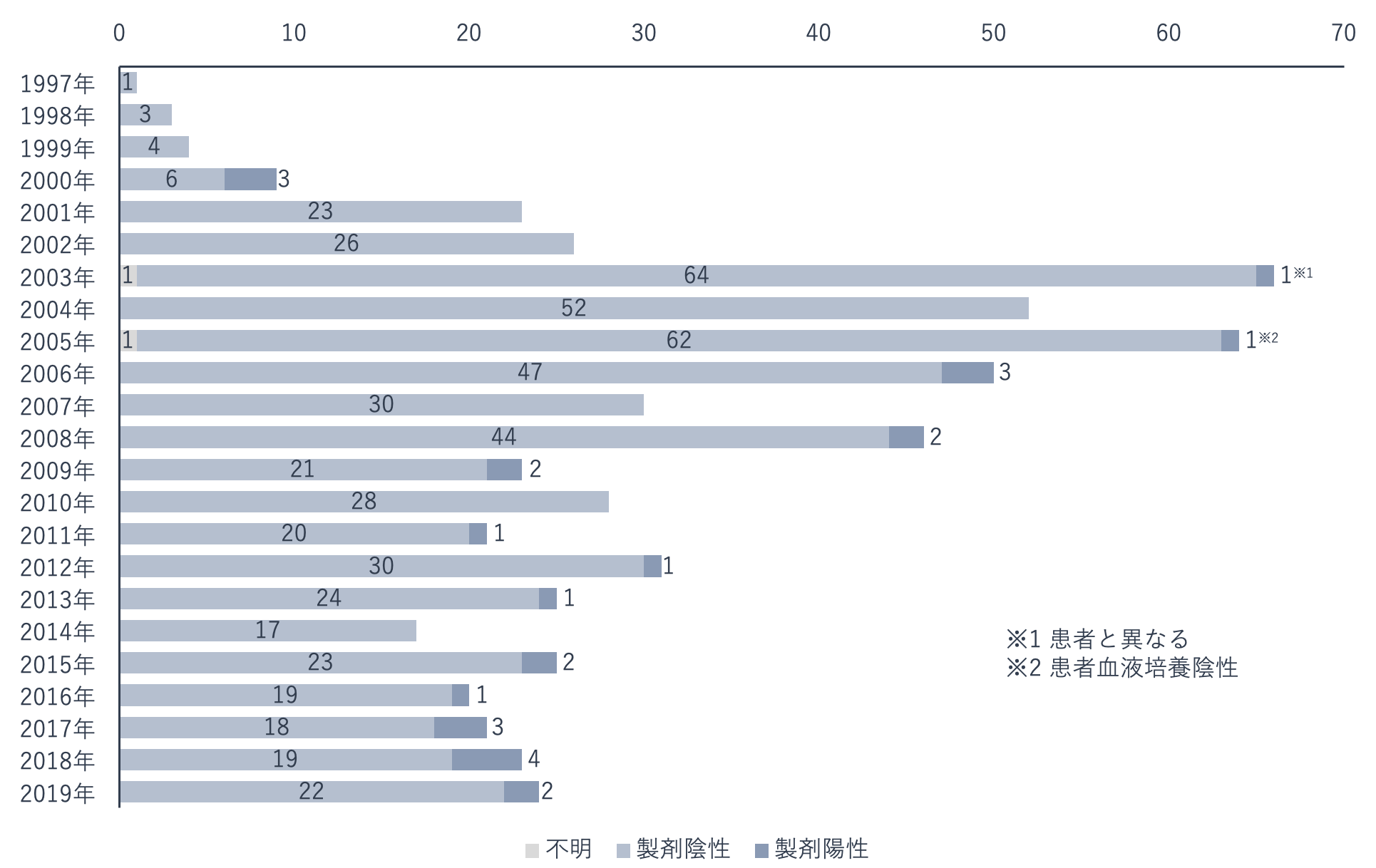
血漿分画製剤は、病原体の除去・不活化処理が行われることなどにより、1997年以降は感染が確認されていません。一方、輸血用血液製剤は感染事例が報告されています。
HBV感染については感染の可能性が考えられる事例が報告されていますが、検査の拡充、HBVの感染既往の献血者が排除されるなどの対策が取られ、件数は減少しています。
HCVとHIVの感染については、2013年までは感染または感染が疑われる事例の報告がありましたが、個別NATを導入した2014年以降はありません。
細菌の感染については、黄色ブドウ球菌、大腸菌の混入事例が報告されており、2017年には大腸菌が混入した血小板製剤を投与された患者が死亡する事例があったため、血小板製剤の使用上の注意が周知されました。
【参考】梅毒については感染事例の報告はない。
HEV(E型肝炎ウイルス)の感染については、感染が疑われる事例の報告が続いたため2020年8月からNATによる全数検査が実施されています。
HTLV-1(ヒトTリンパ球向性ウイルス1型)の感染については感染疑い事例の報告がありますが、因果関係は確認されていません。ヒトパルボウイルスB19の感染については感染が疑われる事例が報告されています。
【参考】2014年8月に国内感染事例が発生したデング熱については、献血時の問診などの強化や発生地域を訪問した人からの献血制限などによる献血血液の安全対策が講じられている。
感染被害の救済制度
血液製剤の安全性はこの数十年で大幅に改善しましたが、ウイルスのウインドウ期や未知の病原体の出現の可能性などにより、リスクは常にあります。最新の科学的な知見に基づいて安全対策が講じられたとしても、現在の技術では、残念ながら感染被害を完全になくすことはできません。
こうした背景から、生物由来製品感染等被害救済制度が創設され、血液製剤などの生物由来製品を適正に使用したにもかかわらず発生した感染などにより健康被害を受けた方には、医療費、医療手当、障害年金などが給付される体制が整備されています。
MRの皆さんへ
血液は、現代の最先端技術を結集させても、いまだ人工的に製造することができません。血液製剤の安定供給のためには、その原料である献血血液を安定的に、また高い安全性をもって、確保しなければなりません。
限られた企業でしか取扱いがないために、多くのMRはこれまで血液製剤について学ぶ機会が少なかったかもしれません。しかし、この講義を通してみてきたように、血液製剤を扱っている企業に所属していないMRにとっても、そして多くの国民にとっても、血液製剤は自身とつながりのあるものなのです。
血液製剤の安定的な供給と高い安全性の恒久的な確保は、医療のために、またすべての国民のために、必ず達成しなければならない課題であるといえるでしょう。
MRの皆さんへ
- 血液は人工的に製造することができない。血液製剤の安定供給のためには、原料である献血血液を安定的に、また高い安全性をもって、確保しなければならない。
- 血液製剤の安定的な供給と高い安全性の恒久的な確保は、医療のため、すべての国民のため、必ず達成しなければならない課題である。
出典
- 2021年3月 厚生労働省「令和2年度血液事業報告」第1章~第6章(統合版)
- 日本赤十字社ウェブサイト「輸血用血液製剤一覧」ページ(2021年12月アクセス)
- 厚生労働省ウェブサイト「血液事業の考え方の経緯」ページ(2021年12月アクセス)
- 2005年9月(2020年3月一部改正)厚生労働省「輸血療法の実施に関する指針」
- 2019年3月 厚生労働省「血液製剤の使用指針」
- 厚生労働省ウェブサイト 医療関係者のための改正薬事法・血液法説明資料「医薬品・医療機器の適正な使用により、より安心できる医療の提供を」総括(2021年12月アクセス)
- 厚生労働省ウェブサイト 医療関係者のための改正薬事法・血液法説明資料「医薬品・医療機器の適正な使用により、より安心できる医療の提供を」 ポイント1「医療関係者による、生物由来製品の安全性確保対策」(2021年12月アクセス)
- PMDAウェブサイト「生物由来製品感染等被害救済制度に関する業務」ページ(2021年12月アクセス)