この講義で伝えたいこと
2019年末に発生した新型コロナウイルス感染症に対し、2020年5月には、国内最初の治療薬「レムデシビル」が特例承認されました。この薬はもともとエボラウイルス感染症に対し開発されたものであることは一般の報道でも取りあげられ、既存の薬が別の疾病の薬になるという「育薬」の成果を、多くの人々が目の当たりにしました。
AI創薬など、新たな創薬技術がうまれる一方で、生活習慣病治療薬を中心とした低分子化合物の開発は、もう限界に達しているともいわれています。新薬開発の難易度が高まる現状において、医薬品の価値を高める「育薬」の重要性が増しています。
この講義では、育薬を医薬品ライフサイクルの視点からとらえ、患者さんや医薬関係者とともに「薬を育てるMR活動」のありかたを考えます。
本編の前に
本編をはじめる前に、独自に行ったアンケート調査の結果の紹介と、用語の確認をしておきます。
「育薬」の認知度調査
医療従事者と医薬品製造販売に関する仕事に従事している人を除く20歳以上の人に、「育薬」という言葉を聞いたことがあるかアンケート調査を行ったところ、聞いたことがないと回答した人が8割を超えていました。
育薬の成果が報道で取りあげられはしましたが、「育薬」という言葉はまだ、一般の人には浸透していないようです。
育薬」とは
製薬協(※)のウェブサイトでは、「育薬」を次のように定義しています。
育薬は、くすりが病院や医院で使われるようになってから、そこで得られた情報をもとに、くすりのより適正な使用やさまざまな改良、新薬の開発へと活かされることをいいます。
日本製薬工業協会ウェブサイト「くすりの情報Q&A」より
※製薬協:日本製薬工業協会。研究開発志向型の製薬企業による任意団体。1968年設立。2021年10月1日現在、73社が加盟。
臨床の現場に送り出された医薬品は、製造販売承認を取得するための治験データを蓄積し終えただけで、承認後に、未知の副作用や新たな用法、有効性が発見されることがあります。多くの人に使用されて得られた情報が、その医薬品の改良や、新たな医薬品の開発に活かされます。
製薬業界では、市販された医薬品を改良すること、別の新薬開発につなげることを「育薬」と呼んでいます。
医薬品ライフサイクルマネジメントと育薬
ここから、講義の本編をはじめます。まずは、医薬品ライフサイクルマネジメント(LCM)の観点から育薬を考えていきます。
医薬品のライフサイクルとは
マーケティング用語に「製品(プロダクト)ライフサイクル」というものがあります。これは、製品が市場に投入されてから撤退するまでの間を、売上・利益の観点から4つの段階(導入期・成長期・成熟期・衰退期)に分ける考え方で、それぞれの段階に応じた戦略を立てることで、売上を早期にピークの状態にしたり維持するためのマネジメントに用いられるものです。
製薬企業の製品である医薬品のライフサイクルを考えるときは、医薬品が他の産業製品と異なる特徴を持っていることを考慮しなければなりません。それは、製品化成功率がきわめて低く開発期間が長いこと、それに伴って開発費用が非常にかかることです。
そのためICH(※)の各種ガイドラインでは、医薬品のライフサイクルに開発段階を含めています。
※ICH:International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(医薬品規制調和国際会議)の略称。医薬品規制当局と製薬業界の代表者が協働し、医薬品規制に関するガイドラインを科学的・技術的な観点から作成する国際会議。
ライフサイクル:
薬食審査発第0628第1号通知別添「製剤開発に関するガイドライン」より
初期開発から市販を経て製造販売中止に至るまでの製品寿命の全過程。
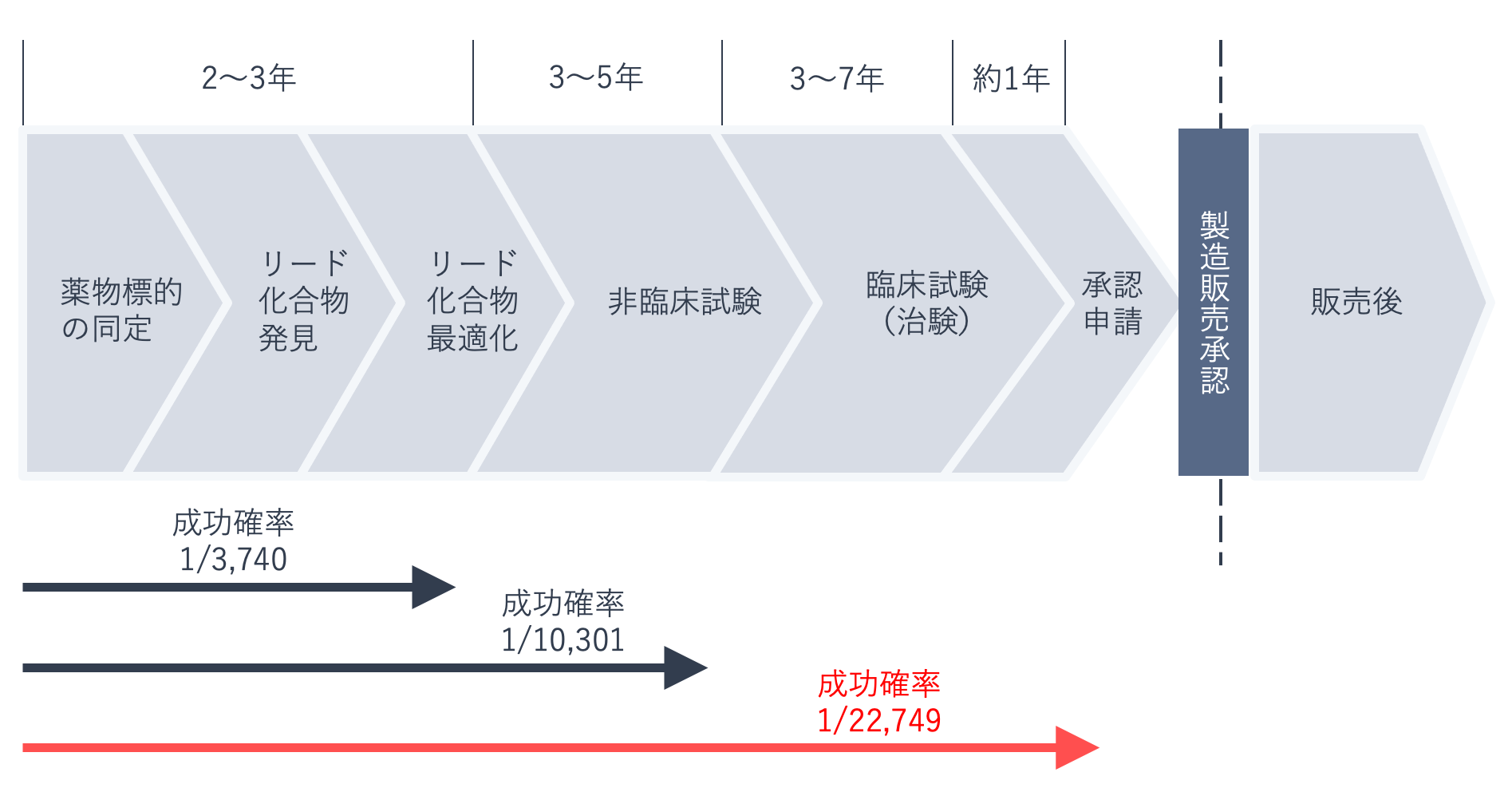
下の図に示したように、新薬候補の化合物が医薬品として発売される成功確率は現在、約2万3千分の1といわれています。ひとつの新薬を開発することはこれほど難しく、10年以上の時間と、数百億~数千億円規模の費用がかかります。ちなみに、20年ほど前の成功確率は約1万3千分の1でした。
低分子化合物の新薬開発が限界に近づきつつあり、バイオ医薬品などの高分子医薬品、さらに中分子医薬品、再生医療等製品、遺伝子治療薬など、治療手段(モダリティ)の多様化・複雑化により、創薬のハードルはますます高くなっています。新薬開発の成功率の低下は、裏を返せば、既存薬の価値を高めるという意味での「育薬」の重要性が増すことを意味します。
医薬品ライフサイクルと特許
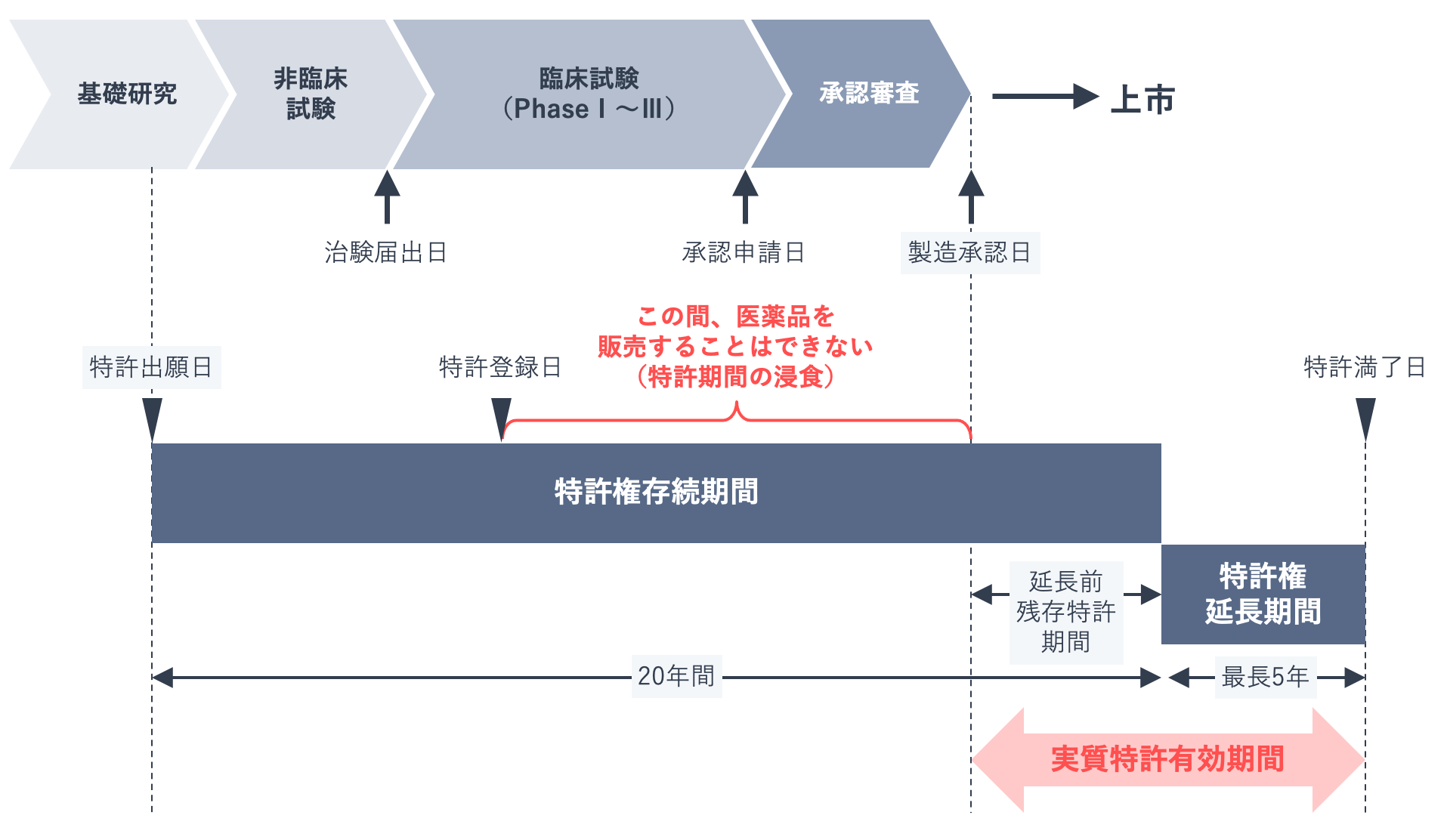
特許権も医薬品ライフサイクルを考えるのに重要な要素です。長い期間と莫大な費用をかけてやっと完成した医薬品の上市後の売上は、研究開発費を回収するための重要な期間です。そこで製薬企業は、市場を独占するために特許を取得します。
通常、特許を取得した発明は出願日から20年間特許権が保護され、その期間中は市場を独占できます。しかし医薬品は製造販売の承認を得てはじめて上市できるという特殊な製品であるため、下の図に示したように、特許が取得できても上市まで特許権を行使できない期間が発生します。そのため、最長5年間の特許期間の延長が認められています。
製造販売の承認を得てから、延長した特許期間が満了する日までが、実質的な特許有効期間となります。製薬企業はこの期間に、市場での売上やライセンス収入などによって研究開発コストを回収します。
しかし特許期間が終了すると、後発医薬品に置き換わるのが現在の医薬品市場です。そこで先発医薬品メーカーは、医薬品の基本特許である「物質特許」や「用途特許」だけでなく、「製剤特許」や「製法特許」も戦略的に取得することで、市場喪失の速度をマネジメントします。
マーケティング担当などは、適応追加、剤形変更なども上市前から計画し、研究開発費の回収戦略を実行していきます。こうした特許の面からみた適応追加、剤形変更も医薬品ライフサイクルマネジメント(LCM)としての「育薬」です。
後発医薬品メーカーは、先発品の基本特許の満了後、残存する用途特許期間などに抵触せずにシェアを獲得・拡大するための戦略を立てます。
マネジメントの立場で異なるライフサイクル
医薬品のライフサイクルは、どの立場からマネジメントするかによってフェーズの捉え方が異なります。
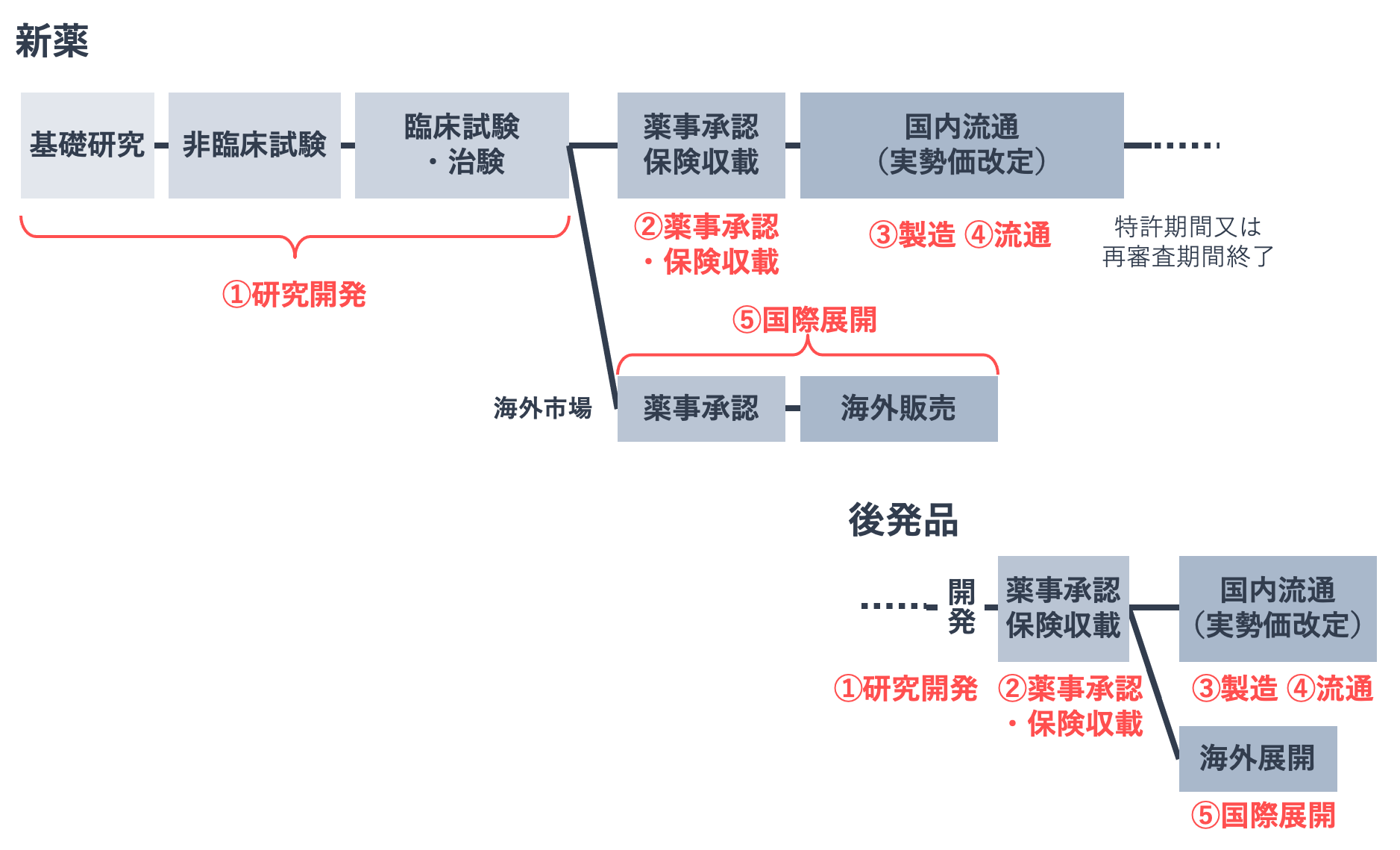
たとえば、国が医薬品産業政策を示した「医薬品産業ビジョン2021」では、医薬品ライフサイクルのフェーズを、①研究開発②薬事承認・保険収載③製造④流通⑤国際展開として、フェーズごとの施策を立てています。
産業としていかに育てていくか、それが国にとっての「育薬」のひとつの側面ということです。
効能・効果の追加
ここからは、医薬品に新たな価値を付加することになる、効能・効果の追加に注目します。
既存の有効成分に新たな価値を見出す
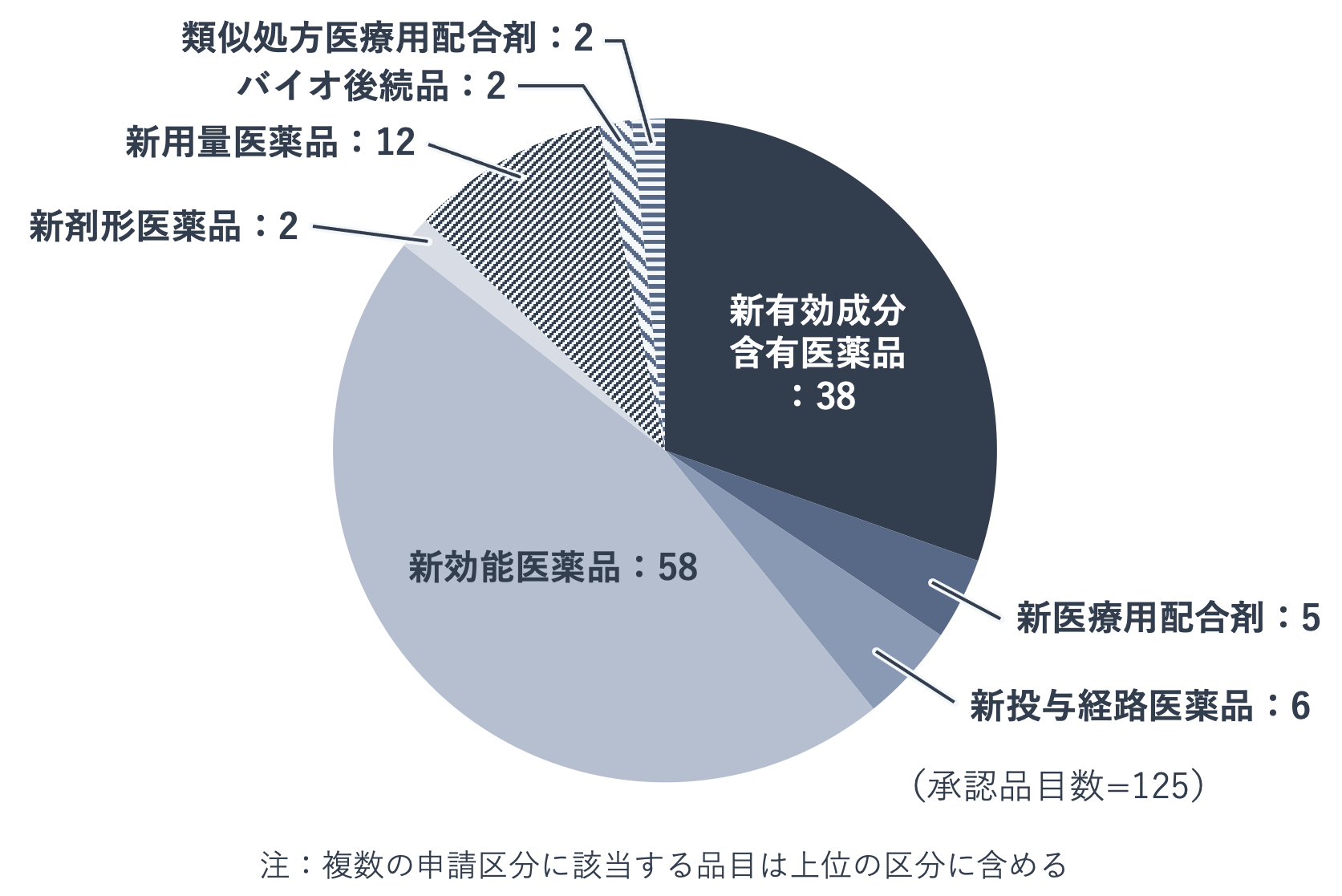
下の図は、2020年に日本で承認された新医薬品の申請区分別内訳を示したものです。承認された125品目のうち、新有効成分含有医薬品38品目を上回る58品目が、新効能医薬品でした。
新効能医薬品とは、既に承認されている医薬品と有効成分や投与経路は同一ですが、効能・効果が異なる新医薬品です。言い換えれば、既存の有効成分に新たな価値を見出した医薬品です。
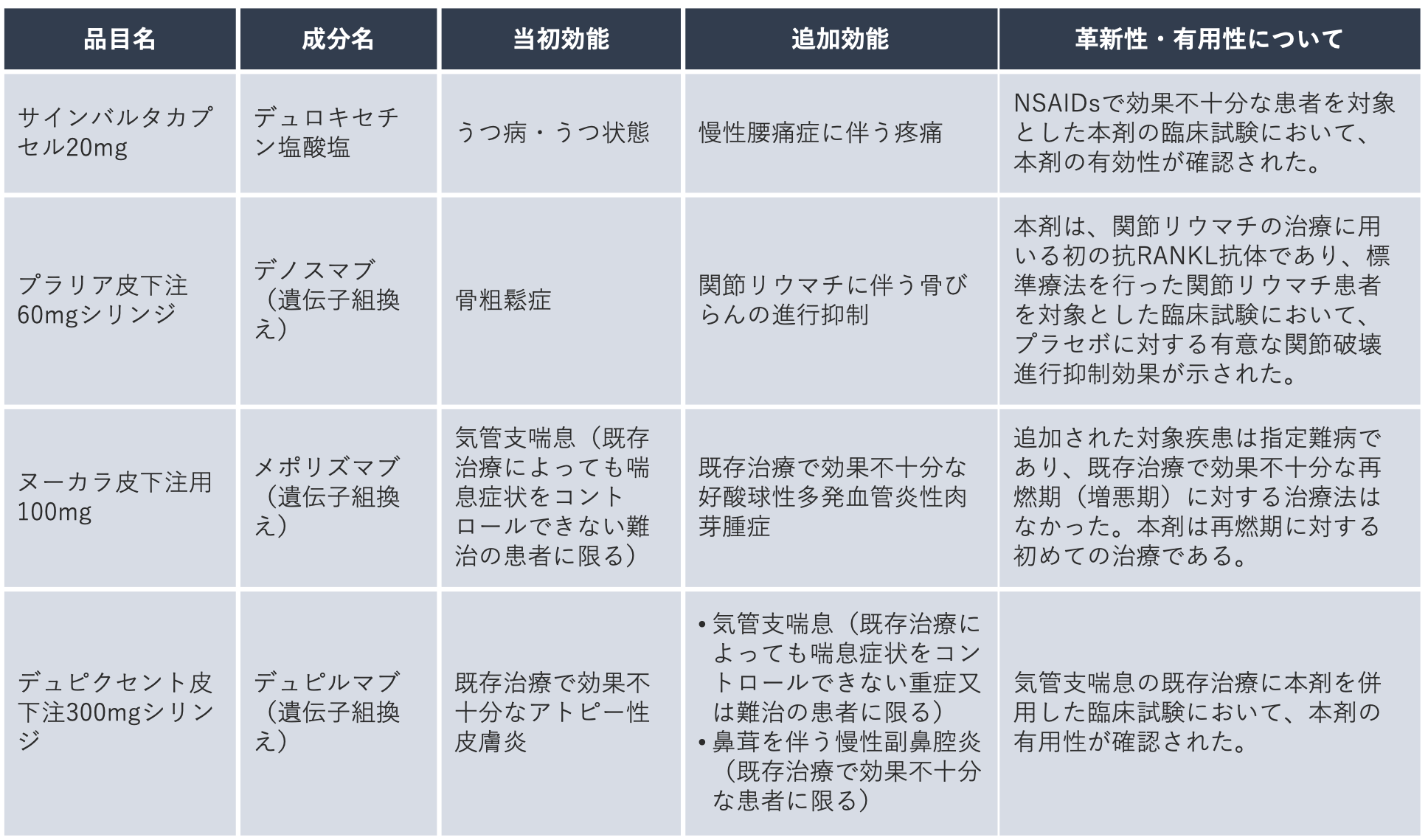
下の表は、薬価専門部会において、臨床的有用性が高いと考えられる効能・効果の追加の例として挙げられた品目です。
※薬価専門部会:薬価の価格算定ルールを審議する中医協(中央社会保険医療協議会。厚生労働大臣の諮問機関であり、厚生労働省下に設置される審議会のうちのひとつ)下の専門部会。
下の表は、2020年度・2021年度に承認された効能追加によって、希少疾病用医薬品に該当した医薬品です。
臨床的に有用な効能・効果の追加は、患者さんの治療選択肢を増やしたり、希少疾病用医薬品のようにアンメットメディカルニーズにこたえる医薬品となりえます。これは新薬開発が困難となりつつあるなか、非常に重要な「育薬」です。
このようなアンメットメディカルニーズにこたえる育薬には、ドラッグ・リポジショニングの手法が使われることがあります。
ドラッグ・リポジショニングによる育薬
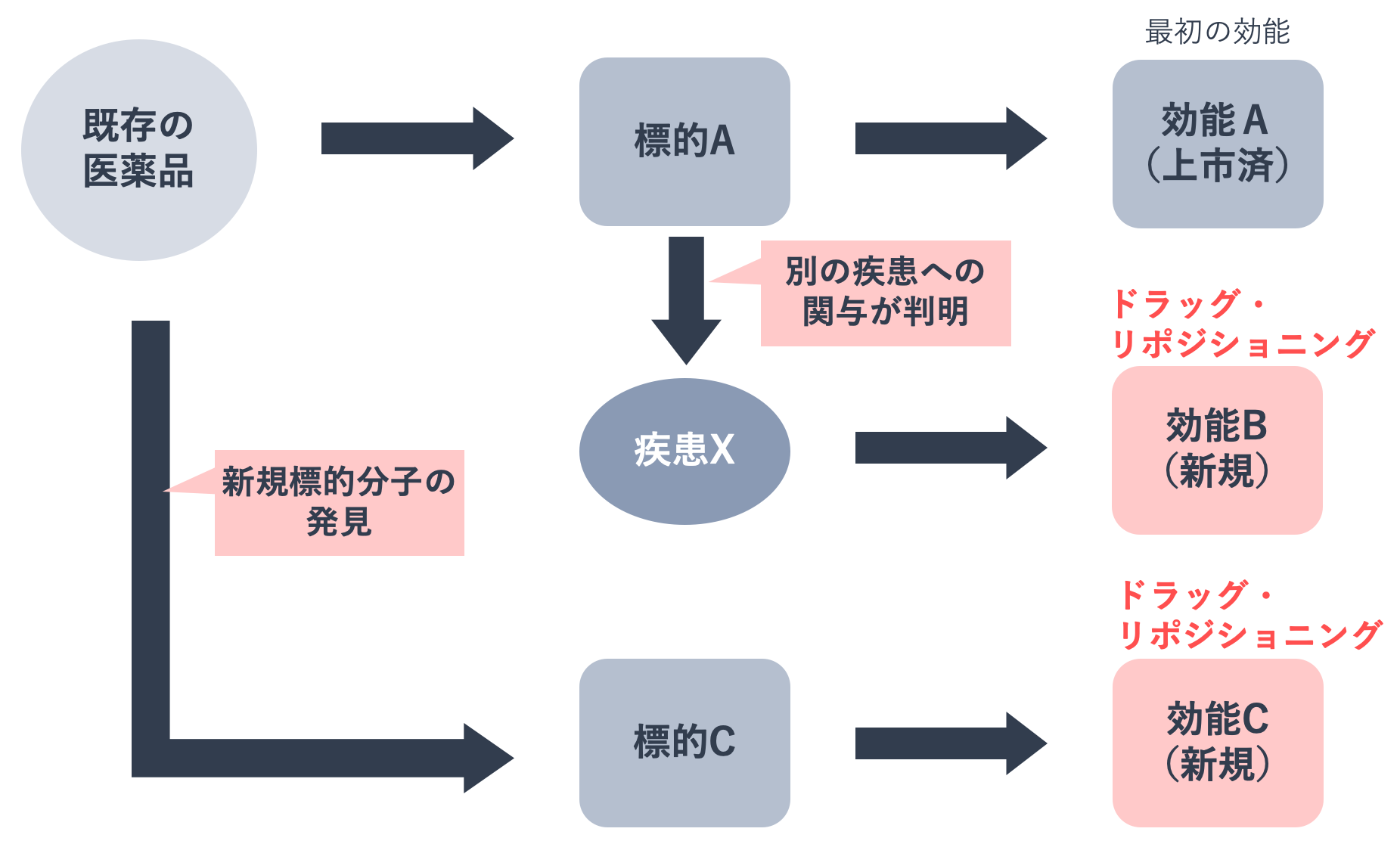
ドラッグ・リポジショニングとは、既に承認された医薬品や開発を中断した医薬品から、新たな効能を発見し、別の疾患の治療薬を開発する手法です。既存薬は安全性や体内動態などが確認されているため、非臨床試験や第Ⅰ相臨床試験を実施する必要がありません。そのため、いちから新薬を開発するのに比べ、開発リスクが低く、コストも抑えることができます。
ドラッグ・リポジショニングには2つのルートがあります。ひとつは、既存薬の主標的分子・作用機序が別の疾患へ関与していることが判明して新規効能へ展開するものです。もうひとつは、既存薬の新たな標的分子・作用機序を発見して新規効能を得るものです。
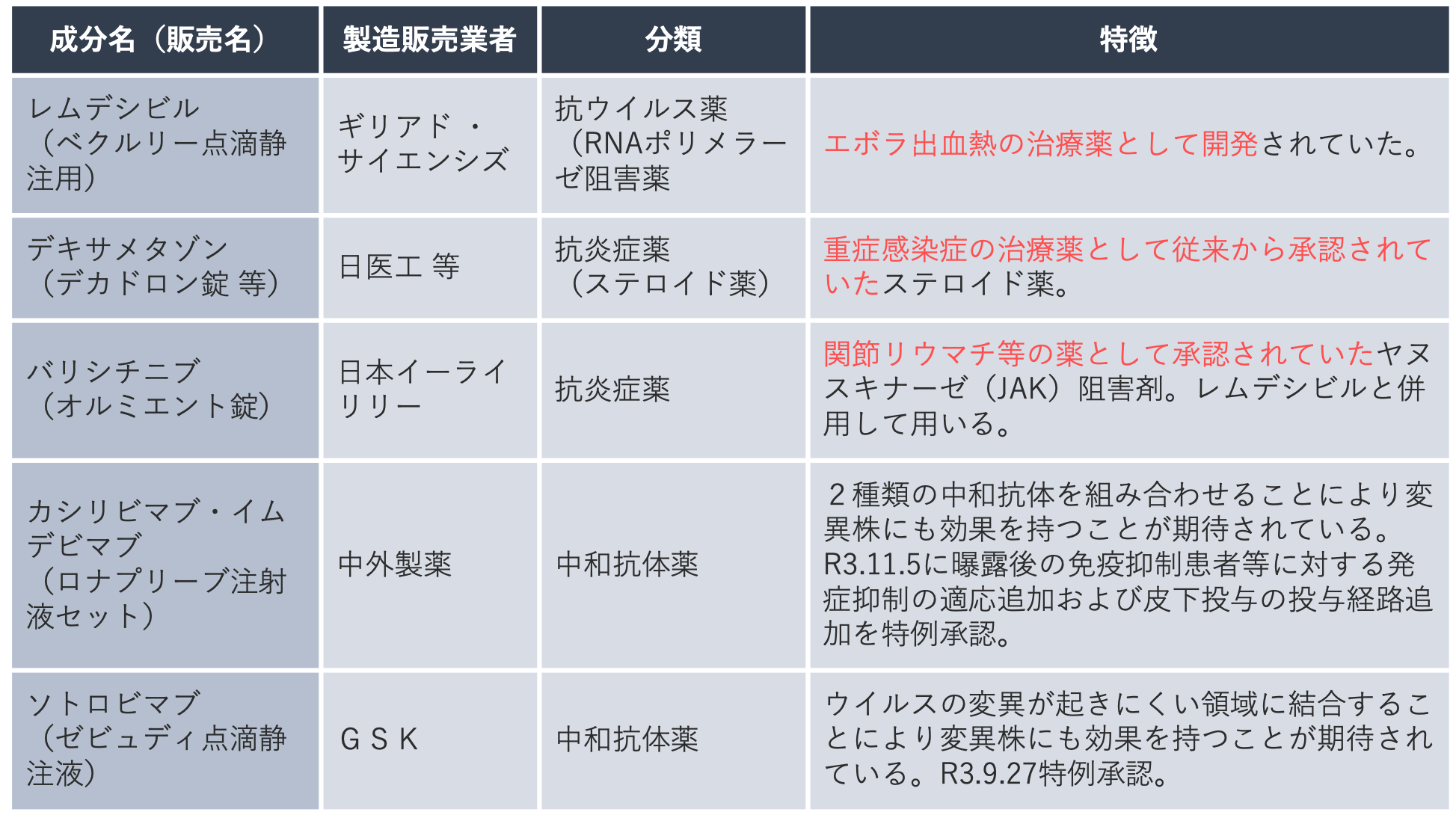
ドラッグ・リポジショニングの最近の事例としては、新型コロナウイルス感染症への有効性が既存薬から検討され、早期に治療薬として承認されたことがあげられます。
こちらは、2021年12月初旬時点での、承認済の治療薬の一覧です。
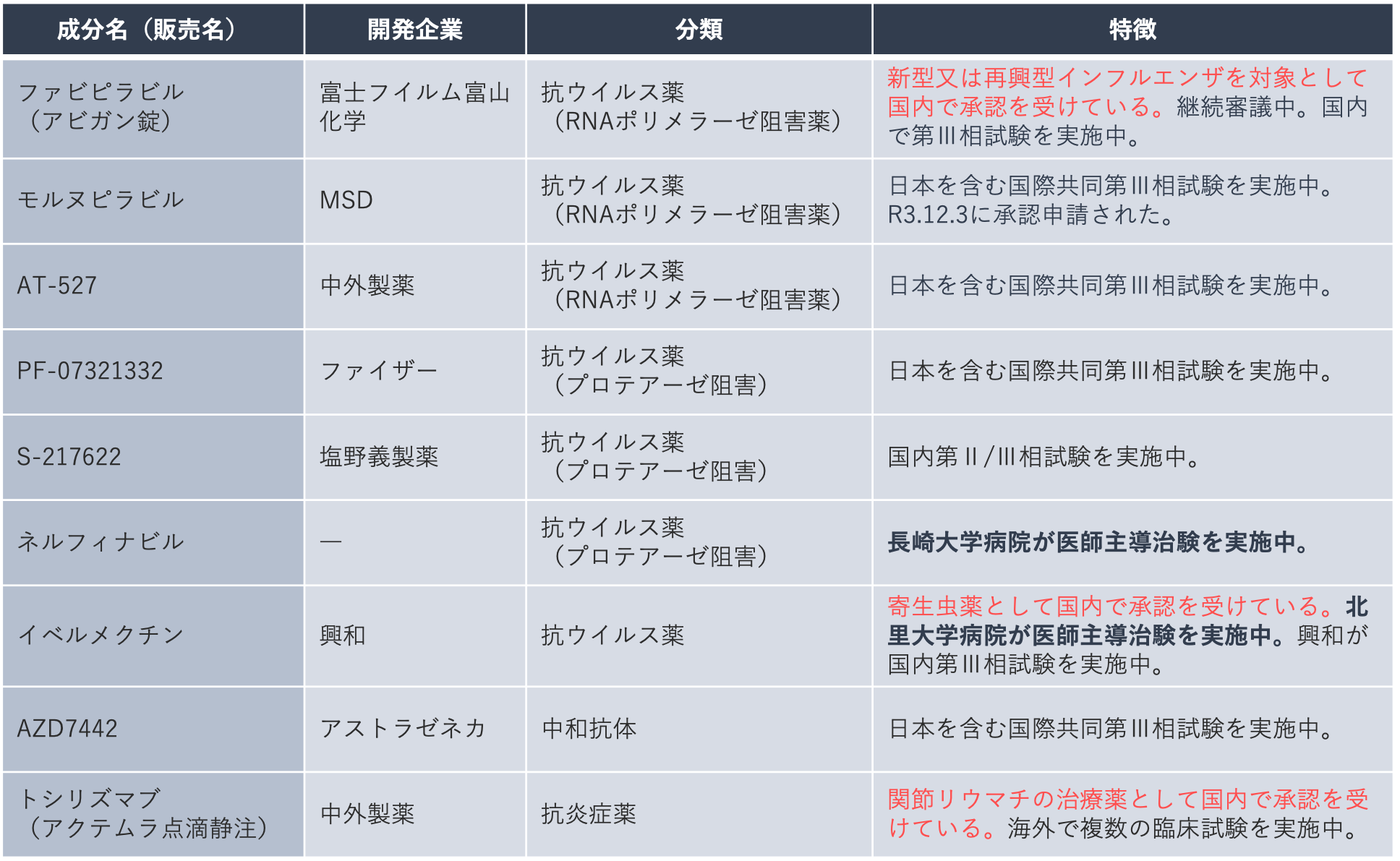
こちらは、開発中の治療薬の一覧です。このように、ドラッグ・リポジショニングは希少疾病や難病のほか、早期開発が急がれる疾病の治療薬開発へ期待がかかります。
上記開発中の治療薬のなかに、医師主導治験が実施されているものが見られます。医師主導治験とは、医師自ら治験を企画・立案し、医師が管理し実施する治験です。
医師にとっての「育薬」である医師主導治験
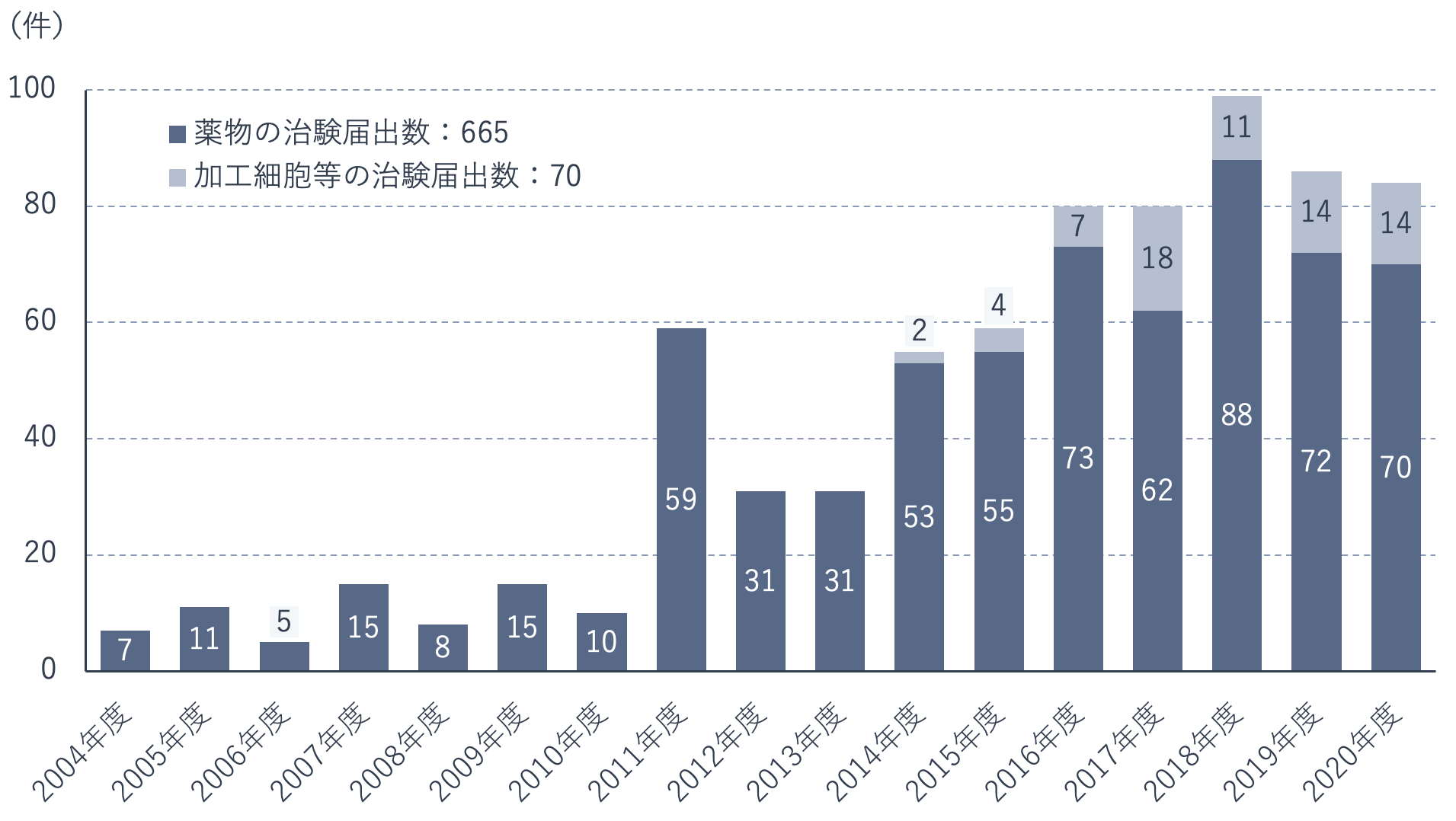
下の図は、薬物および加工細胞等の医師主導治験届出数の年次推移を示したものです。
2003年の医薬品医療機器等法改正により実施できるようになった医師主導治験は、届出数こそ年間100件に届かないものの、難病や希少がんを対象とするものが大部分を占めており、既存薬の適応拡大や最適な投与法の開発、併用薬の探索など、薬の潜在能力を引き出すうえで大きな役割を果たしています。
医師主導治験は、医師にとっての「育薬」活動のひとつといえるでしょう。
MRにとっての育薬
ここからは、MRにとっての「育薬」とは何かを考えます。
MR活動は育薬活動そのもの
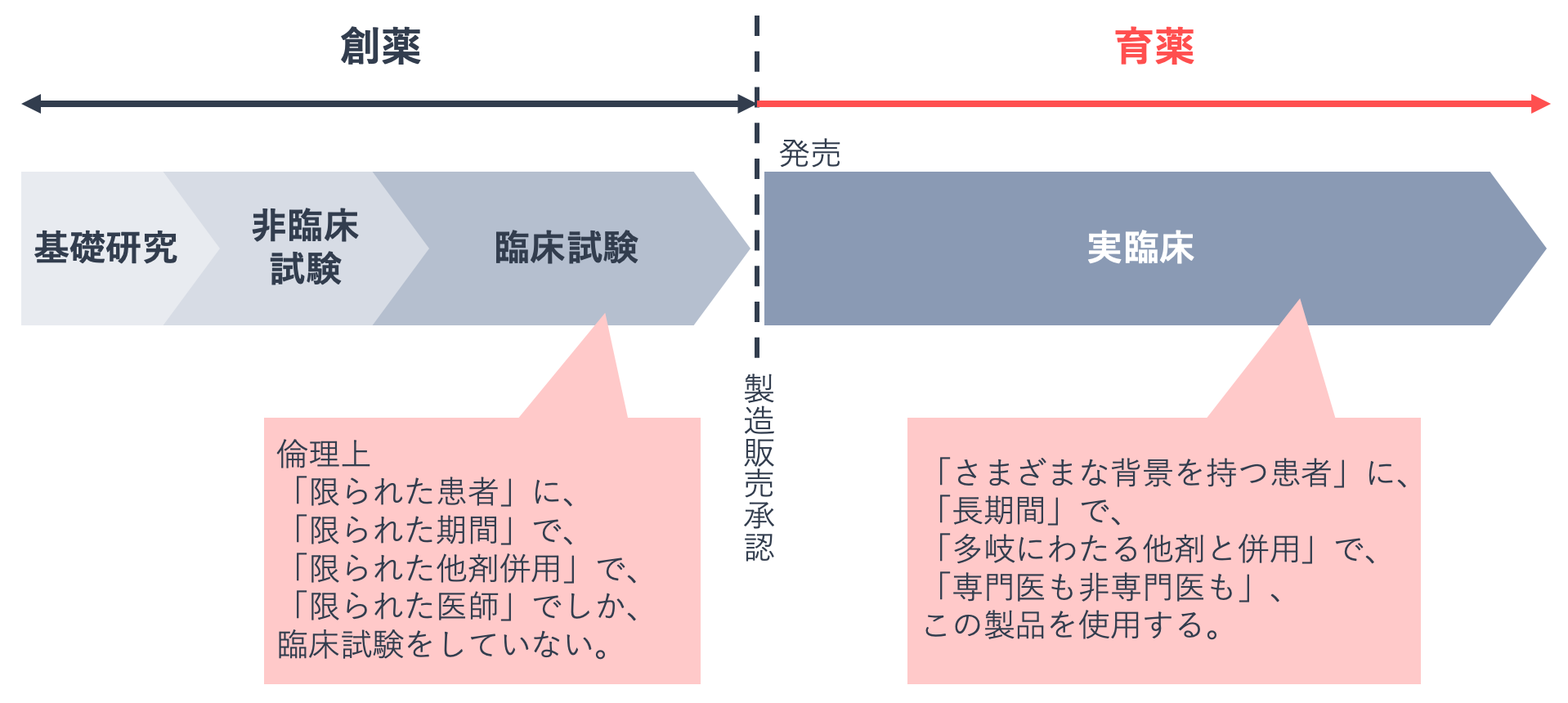
医薬品は発売時に100%完成された製品とはいえません。創薬段階では多くの制約のもとでの使用であることが、そのゆえんです。そのため、上市前にその医薬品の完璧な情報を得ることはできません。
上市された医薬品は、創薬段階にあった使用制約がほとんどなくなります。実臨床では、さまざまな背景を持つ患者さんに、長期間、多岐にわたる他剤と併用して、専門医・非専門医を問わず、使用することになります。
医薬品は、実臨床での有効性と安全性についての情報が蓄積されてから、真の評価を受けることになります。この情報の収集・解析とフィードバックを繰り返すことが、医薬品の評価を高めることになります。こうした一連のプロセスが育薬です。
では、誰が育薬に関する情報の収集とフィードバックを担うのでしょうか。それはMRにほかならず、MRこそが育薬の主役といえます。
厚生労働省令であるGVP(Good Vigilance Practice:医薬品等の製造販売後安全管理の基準)では「医薬情報担当者」を、「医薬品の適正な使用に資するために、医療関係者を訪問すること等により安全管理情報を収集し、提供することを主な業務として行う者」と規定しています。
「医薬情報担当者」とは、医薬品の適正な使用に資するために、医療関係者を訪問すること等により安全管理情報を収集し、提供することを主な業務として行う者をいう。
GVP省令より(赤字:編集部)
GVPではMRの主な業務として、「提供」よりも「収集」を先に記載していることに注目してください。皆さんはMR活動として医薬品情報の「提供」に比重を置いてはいないでしょうか。医薬品情報の「収集」は非常に重要なMR活動、育薬活動であることを、改めて心に留めてください。
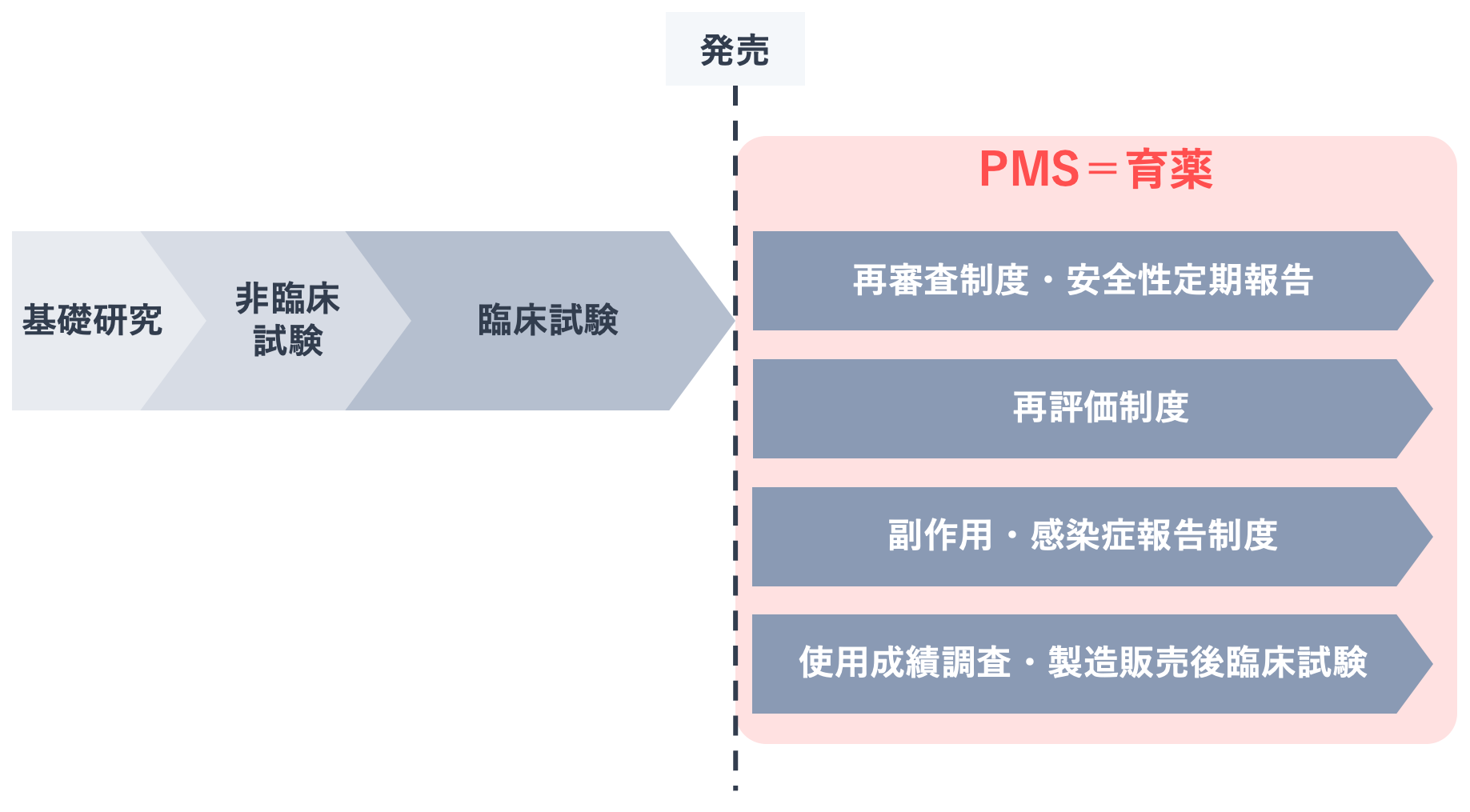
育薬に不可欠なものが、上市後に行う医薬品の安全性・有効性を確認する活動であるPMS(Post Marketing Surveillance)です。
PMSの3つの制度である新医薬品の再審査制度および安全性定期報告、再評価制度、副作用・感染症報告制度、それから再審査に関わる使用成績調査や、製造販売後臨床試験、これらすべてが育薬であり、MRの業務そのものです。
MRは医師・薬剤師をはじめとする医療関係者を通して、患者さんに使用された医薬品の副作用などの安全性情報や、使用感、有効性など医薬品に関するさまざまな情報を収集します。そしてその情報を自社にフィードバックすることで、育薬につながります。このようにPMSは、育薬の根幹をなすものです。
MRの皆さんへ
最後に、製薬企業で臨床開発職に就く方からMRの皆さんにいただいたメッセージを紹介します。
臨床開発職からMRへのメッセージ
「MRは、どうしても担当製品の売上ばかり気にしてしまいます。それは製薬企業が営利企業である以上、研究開発費を回収して次の開発資金を獲得しなければならず、企業によって差はあるものの、そのミッションをMRにも負わせているからです。そのためMRはマーケティングが用意する戦略を重視して、医療関係者と面談するときは、1例でも多く自社製品を使用してもらうことが目標になってしまいます。
しかし医薬品を育てるためには、安全性や有効性に関わる情報を、臨床の現場から吸いあげなくてはいけません。医薬品が育てば多くの患者さんに価値のあるものとなり、売上は自然と増加するものです。患者さんや医療者からの声は、適応追加や剤形変更などの開発にも役立ちます。そのためにもMRは医学と薬学の知識を増やし、情報収集能力を向上させることに努めてほしいです。」

もっと医薬品を育てる情報を集めてほしい
- 医薬品を育てるためには、安全性や有効性に関わる情報を、臨床の現場から吸いあげなくてはいけない。
- 医薬品が育てば多くの患者さんに価値のあるものとなり、売上は自然と増加する。
- 患者さんや医療者からの声は、適応追加や剤形変更などの開発にも役立つ。
- 医学と薬学の知識を増やし、情報収集能力を向上させることに努めてほしい。
編集部取材より
「医薬品を育てるために必要な情報は、安全性や有効性に関わる情報だけではありません。錠剤がよいのか口腔内崩壊錠がよいのかといった剤形に関する情報や、バイアルの冷所保存が面倒であるとか投与量を調節するのが大変だという医療者の声、品質に関係する情報などももっと収集して部門内で問題にしてほしいと思います。
実際に服用する患者さんからの、飲みやすさや保管方法についての意見は重要な情報です。ちょっとしたことでも次の開発への参考となります。これは患者さんと直接対話する医療者だから聞き出せる貴重な情報です。MRの皆さんは患者さんと直接話ができないぶん、患者さんの声を聞く医療者からしっかりと情報収集し、開発者にフィードバックしてください。」

剤形や品質に関する情報も集めてほしい
- 剤形に関する情報など、医療者の声、品質に関係する情報などももっと収集して部門内で問題にしてほしい。
- 患者さんからの、飲みやすさや保管方法についての意見は重要な情報であり、これは患者さんと直接対話する医療者だから聞き出せる貴重な情報。
- MRの皆さんは、患者さんの声を聞く医療者からしっかりと情報収集し、開発者にフィードバックしてほしい。
編集部取材より
「MRは担当製品の適応疾患にしか興味を持たない傾向があります。しかし医療現場には、アンメットメディカルニーズを収集できる機会があります。それは医師が何気なく呟く話です。治療薬のない希少疾患の話や、原因や疾患名がわからない症状、こんな医薬品があったらという話など、医療現場には医薬品開発のシーズとなりえるニーズがあります。
医師が呟くさまざまな情報はすべて貴重な情報だと考えて、医療現場から拾いあげ、開発者に届けてほしいと思います。」

医師が話す治療の情報がほしい
- 医療現場には、アンメットメディカルニーズを収集できる機会がある。
- 医療現場には医薬品開発のシーズとなり得るニーズがある。
- 医師が呟くさまざまな情報はすべて貴重な情報だと考えて、医療現場から拾いあげ、開発者に届けてほしい。
編集部取材より
「育薬」は製薬企業のみで行えるものではありません。医療関係者からの情報収集や患者さんの声が重要です。MRと医療関係者のスムーズな連携と、患者さんの協力があってはじめて成立します。
これまで、MRは売上やシェア、採用件数などを求められてきましたが、令和の時代はMRの評価方法も変わりつつあります。これからは、先発品、後発品にかかわらず、自社の大切な製品を、患者さんにとってより価値あるものに育てることができるMRが求められる時代となるでしょう。
MRの皆さんへ
- 「育薬」は製薬企業のみで行えるものではない。MRと医療関係者のスムーズな連携と、患者さんの協力があってはじめて成立する。
- 令和の時代はMRの評価方法も変わりつつある。大切な製品を、患者さんにとってより価値あるものに育てることができるMRが求められる時代となる。
出典
- 日本製薬工業協会ウェブサイト「くすりの情報Q&A」ページ(2021年12月アクセス)
- 2010年6月28日 薬食審査発第0628第1号通知別添「製剤開発に関するガイドライン」
- 2021年11月5日 中央社会保険医療協議会 薬価専門部会(第182回)資料1-1
- 2015年3月27日 国家戦略特区ワーキンググループ 特許庁ヒアリング配布資料
- 2021年5月17日 第4回革新的医薬品創出のための官民対話 資料2
- 2021年3月 医薬産業政策研究所 政策研ニュースNo.62「日本で承認された新医薬品とその審査期間-2020年承認実績と過去10年の動向調査-」
- 2021年10月20日 中央社会保険医療協議会 薬価専門部会(第181回)資料1-1
- 2012年3月 医薬産業政策研究所 政策研ニュース No.35
- 厚生労働省ウェブサイト掲載資料「承認済の新型コロナウイルス治療薬及び現在開発中の主な新型コロナウイルス治療薬(令和3年12月3日現在)」
- 公益社団法人日本医師会 治験促進センターウェブサイト「医師主導治験とは」ページ掲載資料「医師主導治験の治験計画届数」 (2021年12月アクセス)
- 2017年 メディカルエデュケーション編集部編「MR育薬学」 SCICUS
- 医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令