この講義で伝えたいこと
2021年は特に後発医薬品で大規模な供給不安が生じています。
2021年3月、厚生労働省は「安定確保医薬品」として506成分の医薬品を選定しました。この措置の背景にも医薬品の供給不安があります。MRの皆さんは昨今の医薬品供給不安をどのように受け止めているでしょうか。
この講義をきっかけに、医薬品の安定供給という製薬企業が社会に対し担う責務を再認識し、医薬品供給不足に患者志向をもって向き合うMRのありかた、活動について考えてみましょう。
本編の前に
本編をはじめる前に、独自に行ったアンケート調査の結果を紹介します。
医薬品供給不足の経験についてのアンケート調査
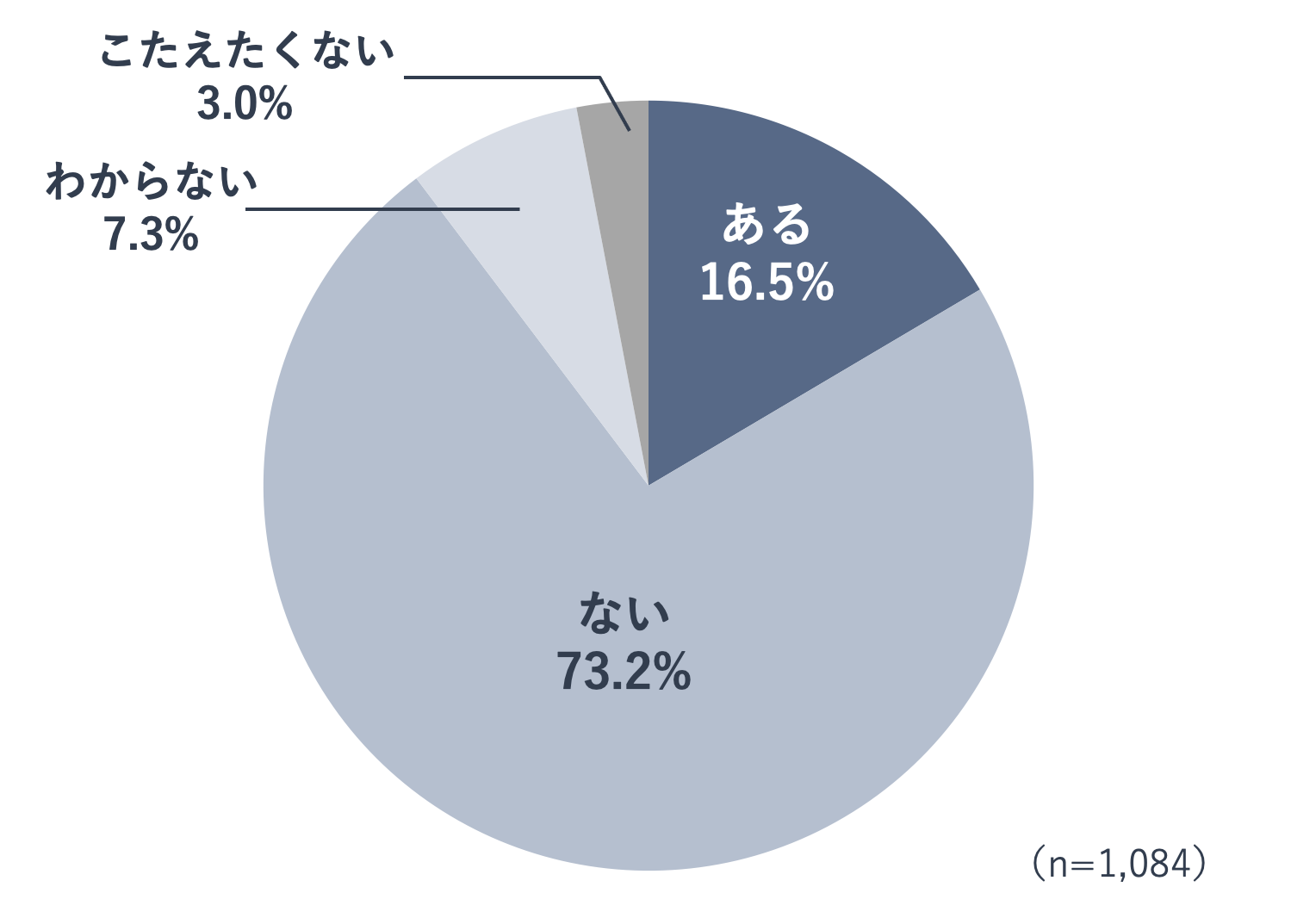
アンケート調査を実施した2021年10月現在、いまだ多くの医薬品が供給不足の状態です。
年齢性別や職業を問わず20歳以上の一般の方へ、「医師から処方される薬で、いつも服用している薬や希望する薬が手に入らずに、代わりの薬を服用することになった経験はありますか。」と質問したところ、16.5%の人が「ある」と回答しました。MRの皆さんはこの数字をどう捉えるでしょうか。
安定確保医薬品の選定と背景
ここから、講義の本編をはじめます。まずは、安定確保医薬品の選定とその背景についてみていきます。
「安定確保医薬品」とは
2021年3月、厚生労働省は、「安定確保医薬品」として506成分(内用薬:216成分、注射薬:244成分、外用薬:46成分)の医薬品を選定、公表しました。
「安定確保医薬品」とは、以下のように定義されています。
安定確保医薬品とは、日本医学会傘下の主たる学会の各専門領域において、医療上必要不可欠であって、汎用され、安定確保が求められる医薬品として提案されたもので、我が国の安全保障上、国民の生命を守るため、切れ目のない医療供給のために必要で、安定確保について特に配慮が必要とされる医薬品を言う。
「医療用医薬品の安定確保策に関する関係者会議 取りまとめ」より(赤字:編集部)
医薬品の安定供給の責務は各製造販売業者にあるものの、重要な医薬品については国も安定供給のための取り組みに、より積極的な関与が必要であるとの考えのもと、厚生労働省下の専門会議(「医療用医薬品の安定確保策に関する関係者会議」)での協議を経て、安定確保医薬品は選定されました。
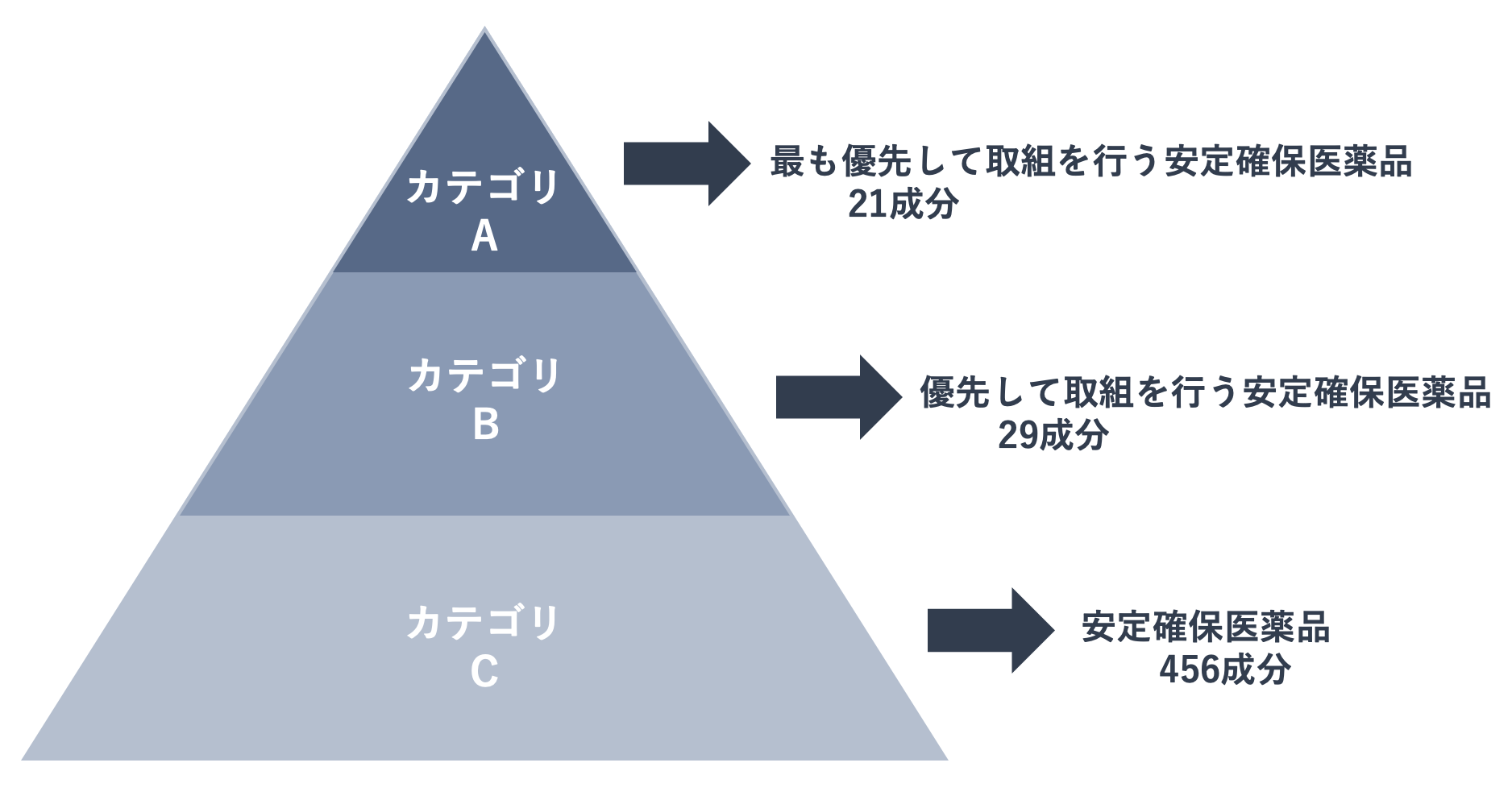
安定確保医薬品は、対象疾患の重篤性、代替薬の有無などによる対策の必要度に応じて、「最も優先して取組を行う安定確保医薬品(カテゴリA)」、「優先して取組を行う安定確保医薬品(カテゴリB)」、「安定確保医薬品(カテゴリC)」の3つのカテゴリに分類されており、カテゴリAに21成分、カテゴリBに29成分、カテゴリCに456成分が選定されています。
【参考】血液製剤やワクチンは一般の医薬品とは生産や流通などの性質が異なっており、需給や流通、情報不足に対する取り組みがそれぞれで行われていることから、安定確保医薬品の枠組みの対象外となっている。
下の表は安定確保医薬品の選定基準を示したものです。対象疾病の重篤性、代替薬・代替療法の有無、多くの患者が服用(使用)していること、製造の状況・サプライチェーンの各要素で、合致する項目が多いものから優先して、カテゴリA、カテゴリB、カテゴリCへ分類されました。
安定確保医薬品の選定基準
| 要素 | 項目 |
|---|---|
| 対象疾病の重篤性 |
|
| 代替薬・代替療法の有無 |
|
| 多くの患者が服用(使用)していること |
|
| 製造の状況・サプライチェーン |
|
医療用医薬品の安定確保策に関する関係者会議(第5回)資料 より編集部作成
「最も優先して取組を行う安定確保医薬品(カテゴリA)」の21成分はこちらです。ワルファリンカリウム、シクロスポリンのほか、バンコマイシンなどの抗菌薬が選定されています。
最も優先して取組を行う安定確保医薬品(カテゴリA)の21成分
| 内注外 | 成分 | 適応等 |
|---|---|---|
| 内 | ワルファリン | 抗凝固剤 |
| 内 | シクロスポリン | 免疫抑制剤 |
| 内 | タクロリムス | 免疫抑制剤 |
| 注 | プロポフォール | 麻酔、鎮痛剤 |
| 注 | ミダゾラム | 麻酔導入、鎮静剤 |
| 注 | ロクロニウム | 筋弛緩剤 |
| 注 | ドパミン | 急性循環不全 |
| 注 | アルガトロバン | 抗凝固剤 |
| 注 | フルマゼニル | 鎮静解除、呼吸抑制改善 |
| 注 | アドレナリン | ショック時の補助治療 |
| 注 | ノルアドレナリン | ショック時の補助治療 |
| 注 | スガマデクス | 筋弛緩状態からの回復 |
| 注 | メトトレキサート | 抗がん剤、抗リウマチ |
| 注 | バンコマイシン | 抗菌薬 |
| 注 | アンピシリン・スルバクタム | 抗菌薬 |
| 注 | セファゾリン | 抗菌薬 |
| 注 | セフメタゾール | 抗菌薬 |
| 注 | タゾバクタム・ピペラシリン | 抗菌薬 |
| 注 | メロペネム | 抗菌薬 |
| 外 | アセトアミノフェン(坐剤) | 解熱鎮痛剤 |
| 外 | トロンビン | 止血剤 |
厚生労働省「安定確保医薬品リスト」 より改変作成
【参考】 「優先して取組を行う安定確保医薬品(カテゴリB)」、「安定確保医薬品(カテゴリC)」に選定された医薬品も、「安定確保医薬品リスト」から自身でチェックしてみましょう。
「安定確保医薬品」選定の背景
「安定確保医薬品」選定のきっかけとなったのは、2019年に長期にわたって供給不足となったセファゾリン注射剤の供給不安事案です。セファゾリンは、おもに黄色ブドウ球菌感染症の治療と、外科手術の創感染予防に一般的に使用されている医薬品です。
市場の約60%のシェアを占めていた日医工社において、海外で製造する原薬に関するトラブルが原因でセファゾリンが製造できない事態となり、日医工社は2019年3月に出荷調整を行いました。これにより他の製造販売業者も影響を受け、同注射剤やその代替薬についても出荷調整を行う事態へと発展しました。厚生労働省は代替薬リストを作成し周知しましたが、セファゾリンは術後感染予防の標準薬でもあるため、手術の延期など、臨床現場は対応に苦慮することとなりました。
セファゾリン注射剤の供給不安事案の経緯
| 2018年 9月 | 環境規制対応のため、セファゾリン注射剤(日医工社)の原薬原材料を製造する中国の製造所から原材料の出荷が滞る |
| 10月 | その後の製造を行うイタリアの原薬製造所から入荷した同注射剤の原薬に異物が検出 |
| 2019年 1月 | 当該原薬製造所から入荷した原薬の多くが異物混入により受入れ試験が不合格 |
| 3月 | 日医工社が、安定供給に支障を来す旨の案内を医療機関等に対し開始。他の製造販売業者も同注射剤やその代替薬について出荷調整(既存の納入施設を優先し新規注文を断る出荷制限)を開始 厚生労働省が、日医工に対して早急な供給再開に努めるよう指導。代替薬の製造販売業者に対して生産増強等も依頼。医師会、薬剤師会等の関係団体に対し、同注射剤の代替薬リストを周知する事務連絡を発出 |
| 9月 | 厚生労働省において、セファゾリン注射剤やその代替薬の供給を調整する枠組みを開始 |
| 11月 | 供給再開 |
医療用医薬品の安定確保策に関する関係者会議(第1回)資料 より作成
この事案をきっかけに、医療者から医療上必要不可欠な医薬品の安定的な確保を求める強い要請が寄せられ、医薬品の安定確保策について議論する関係者会議が設置されることになったのです。
【参考】2019年はセファゾリンのほか、ラニチジン(一般名ラニチジン塩酸塩。胃潰瘍、十二指腸潰瘍、逆流性食道炎等の治療薬として発売から30年以上も汎用されてきたロングセラーのH2受容体拮抗薬)の供給不足事案も発生した。原薬とこれを含む製剤から微量の発がん性物質NDMA(N-ニトロソジメチルアミン)が検出されたというFDA(アメリカ食品医薬品局)およびEMA(欧州医薬品庁)からの発表を受け、国内すべての製造販売業者がラニチジンを自主回収したことによるものであった。
近年、ハエや製造機器の破片など異物混入による自主回収、予想を大幅に上回る需要に製造が追いつかず行われた出荷調整など、さまざまな要因により供給不安に陥る事案が発生しています。また、下の表に示したように、2020年、2021年は新型コロナウイルス感染症の拡大という非常事態により、中国やインドなど海外で原薬の製造が停止したり輸出が停滞した影響で、国内での安定供給に支障が生じました。
新型コロナウイルス感染症流行に関連する供給不安事案の例
| 品目名 | 事案の概要 |
|---|---|
| プロポフォール静注1% 20mL「マルイシ」、 同1%50mL「マルイシ」 ほか |
|
| バルサルタン錠 20mg/40mg/80mg/ 160mg「アメル」 |
|
| デカドロン錠0.5mg、4mg |
|
中央社会保険医療協議会 薬価専門部会(第182回)資料 より作成
【参考】特にプロポフォールとデカドロン錠(デキサメタゾン経口製剤)は医療上必要性の高い医薬品であるため、安定供給までの対応について厚生労働省は事務連絡を発出した。
・2021年5月14日付け事務連絡「プロポフォール製剤が安定供給されるまでの対応について(周知依頼)」
・2021年8月27日付け事務連絡「デキサメタゾン製剤の安定供給について」
・2021年9月9日付け事務連絡「デキサメタゾン製剤が安定供給されるまでの必要な患者への優先的な使用等の対応への協力について」
医薬品の安定確保のために
下の図は、医薬品の安定確保を阻害する要因を示した図です。
医薬品の供給不安が生じる要因は外的(海外)要因と内的(国内)要因に分けられ、外的要因には、原薬工場のある国での事故や災害、環境規制の強化などによる工場の生産停止や、有害な不純物の混入といった品質問題があります。
内的要因には、製造キャパシティ不足や負の連鎖などがあります。製造キャパシティ不足は、薬価の引き下げなどでの採算性の低下により設備投資が難しくなることが一因となります。ある医薬品で回収や供給不安が生じた場合、各社で製造計画があるため急激な需要増に対応した急な増産はできず、ひとつの医薬品の供給不安が別の医薬品の供給不安を引き起こすという負の連鎖が生じます。
こうした要因を踏まえ、「医療用医薬品の安定確保策に関する関係者会議」では、医薬品の安定確保が困難となる背景として、以下のように整理されました。
医薬品の安定確保が困難となる背景
- 海外製造依存等によるリスク、サプライチェーンが複数化されていないことによるリスク
- 原料物資や原薬調達のコスト
- 日本と海外の薬事規制・手続の違い
- 供給不安の情報の共有不足
「医療用医薬品の安定確保策に関する関係者会議取りまとめ」 より編集部作成
たとえば①については、原薬やその原料物質の製造が海外に過度に依存している場合、その国の状況・情勢に供給が左右されるリスクが高いことが指摘されています。また、国内での製造であっても、限られた企業しか供給できない場合、サプライチェーンに関するリスクとなります。
④については、各地域での供給と在庫の状態を即時に捉えることが難しく、ひとたび供給不安が生じると、医療機関や薬局で在庫確保のための過剰発注につながり、在庫偏在や品薄状態に拍車がかかることなどが指摘されています。
医薬品の安定確保のために、こうした問題をクリアすべく製薬企業は各々、自主的な取り組みを実施していますが、個別の企業での取り組み、阻害要因の解決には限界があります。
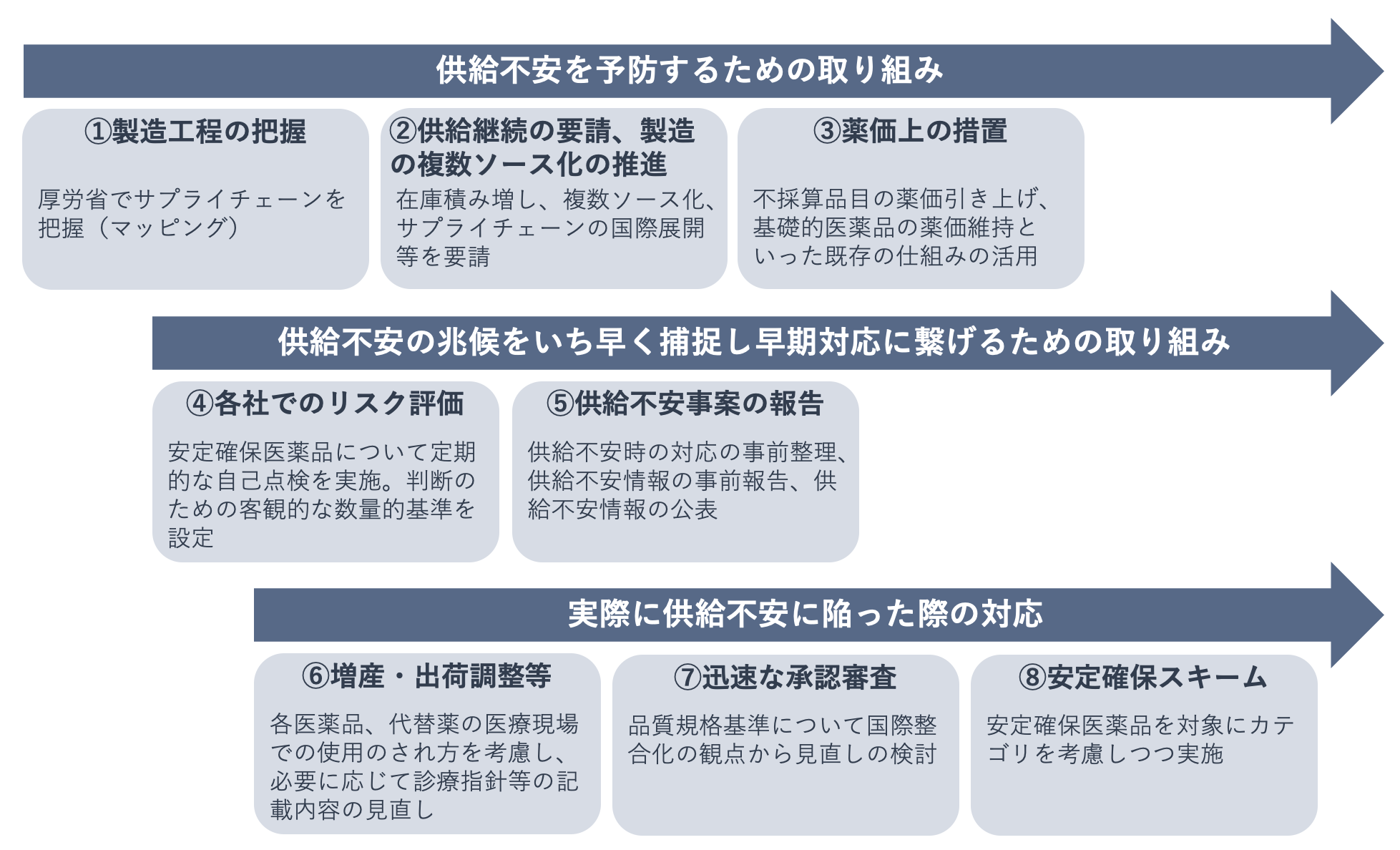
そのため、医療上特に重要な「安定確保医薬品」については、安定確保を図るために国がどのような介入をすべきかが検討され、供給不安を予防するための取り組み、供給不安の兆候の早期捕捉・早期対応のための取り組み、供給不安に陥った際の対応について、今後の取り組みが掲げられました。
⑧の安定確保スキームについては策定が完了しており、2021年5月に厚生労働省から日本製薬団体連合会に通知されています。
【参考】2021年5月28日付け 医政経発0528第1号通知「医療用医薬品の供給不足が生じる場合の対応スキームについて」
供給不安を引き起こすGMP違反
ここからは、医薬品の供給不安を引き起こすさまざまな要因のうち、GMP違反に注目します。
医薬品の品質を確保するためのGMP
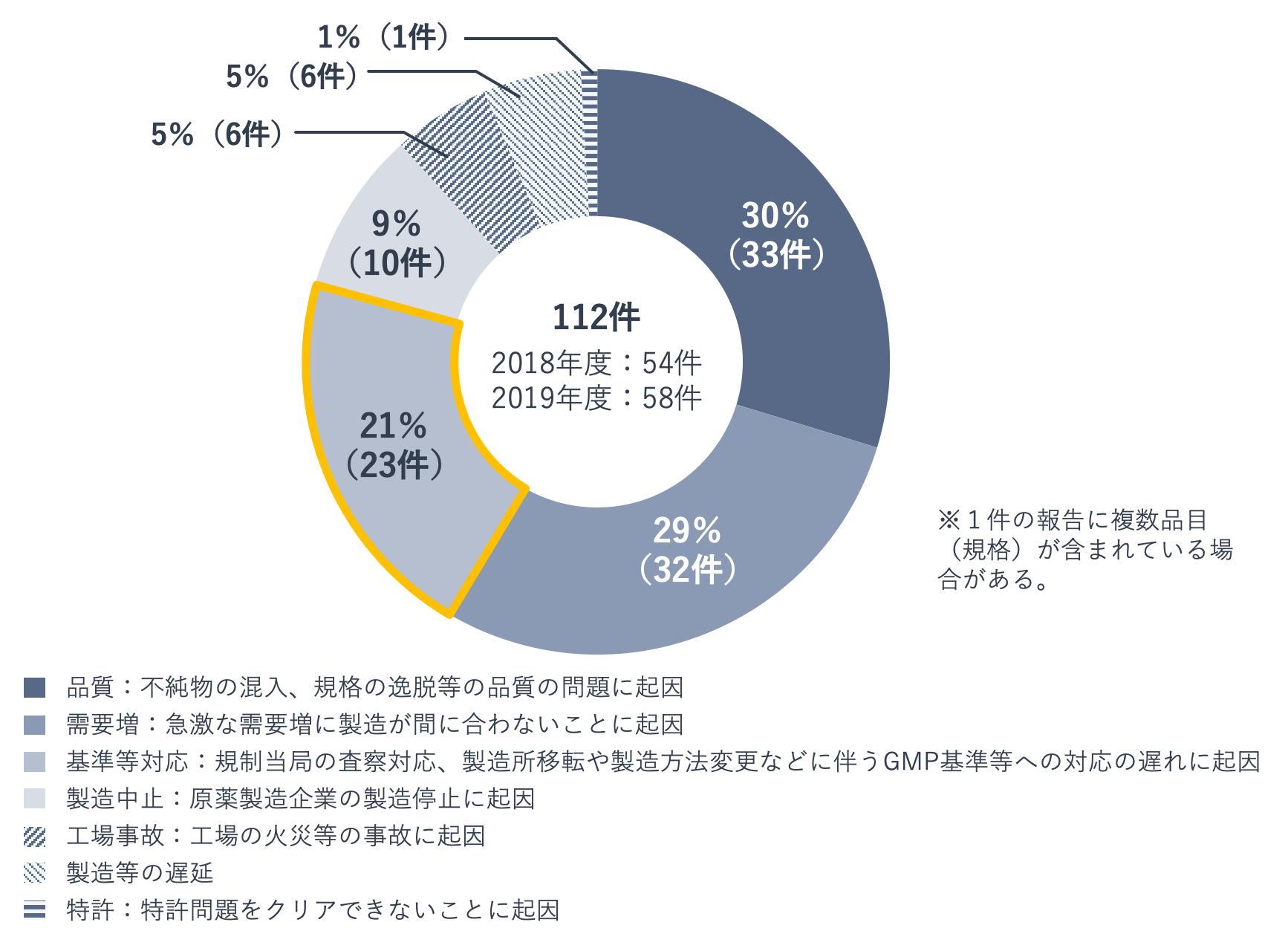
下の図は、2018年4月から2019年1月末にかけて、製薬企業から自主的に厚生労働省に報告があった供給不安・欠品に陥った事案(出荷調整などを実施したもの)を、原因別に集計したものです。GMP基準などへの対応の遅れが原因となった事案は、不純物の混入や規格の逸脱といった品質問題、急激な需要増に次ぐ件数でした。
ちなみに、供給不安や欠品は後発医薬品に特有の問題と認識している人が多いかもしれませんが、決してそうではありません。上記調査の事案112件を先発医薬品・後発医薬品別にみると、先発医薬品の事案は38件(全体の34%)あります。
ここで医薬品の適切な製造・販売・流通に関する法規制を振り返ってみましょう。
医薬品を流通させるには、品目ごとに、厚生労働大臣から製造販売を行う承認を受ける必要があります。製造販売の承認を受けるには、その医薬品の品質や有効性・安全性が医薬品として適当であると認められることに加え、その医薬品の製造販売を行う者が「製造販売業」の許可を受けていること、その医薬品の製造を行う製造所が「製造業」の許可を受けていること、製造所での製造管理・品質管理の方法が厚生労働省令で定める基準に適合していること、これらの要件をすべて満たさなければなりません(医薬品医療機器等法第十四条)。この、製造所が遵守しなければならない製造管理・品質管理の方法の基準が、GMP(Good Manufacturing Practice:医薬品及び医薬部外品の製造管理及び品質管理の基準)です。
また、GMPは、医薬品の製造販売の承認後も、製造業者が遵守するべき事項として要求されているものです(医薬品医療機器等法第十八条)。
つまりGMPは、医薬品の製造販売承認を得るために、また承認を継続するために、製造所が遵守しなければならない事項を定めたもの、ということです。
【参考】
GQP(Good Quality Practice):医薬品等の品質管理の基準
GVP(Good Vigilance Practice):医薬品等の製造販売後安全管理の基準
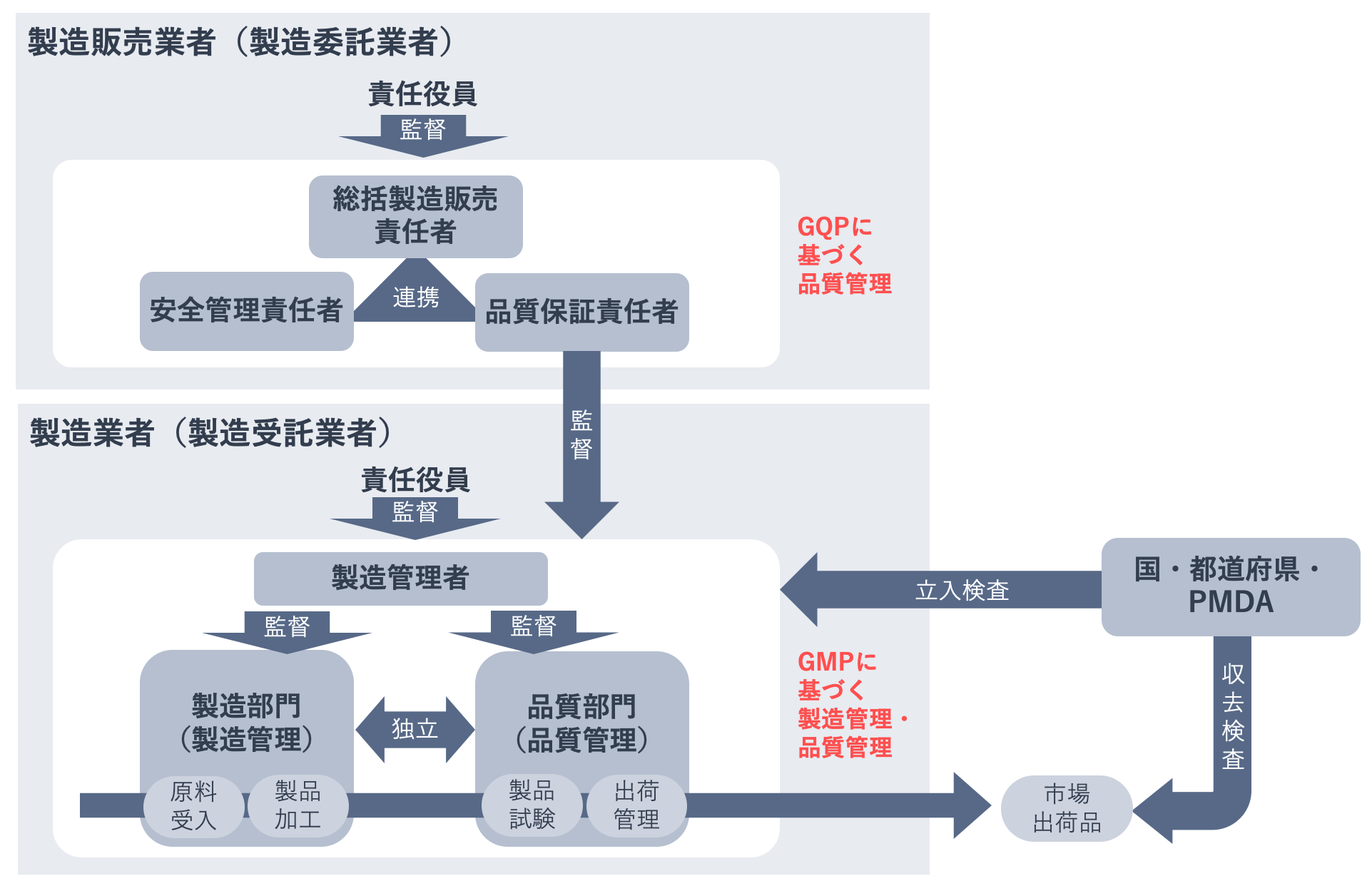
下の図は、製造販売業者と製造業者による医薬品の製造管理・品質管理の体制をあらわした図です。製造所はGMPに基づく製造管理・品質管理を行わなければなりませんが、製造販売業者は製品の品質を確保するために、GQPに基づき製造業者の管理監督を行わなければなりません。
製造販売業者は、自らの工場を製造所とせず、他の企業に製造を委託する場合があります。そのため、医薬品によっては、製造販売業者と製造業者が異なることがあります。製造販売業者は、他の企業であっても、製造業者の管理監督責任があります。
下の表は、具体的にどのような事項がGMPに定められているかを示したものです。まず大原則として、製造業者は、製造販売の承認を受けた事項(承認事項)に従って、承認書のとおりに医薬品を製造しなければなりません。そのうえでGMPには、作業内容の明確化と記録として、製造方法や製品の規格、試験方法などを記載した「製品標準書」を作成すること、衛生管理手順、製造工程、原料や製品の管理手順などを記載する「手順書」を作成することなどが定められています。
GMPでの主な要求事項
| 人員組織の確立 |
|
|---|---|
| 構造設備の完備 |
|
| 作業内容の明確化と記録 |
|
| 管理業務の実施 |
|
医療用医薬品の安定確保策に関する関係者会議(第1回)資料 より作成
医薬品の製造販売業者は、医薬品の承認前に、製造所がGMP基準に適合しているかどうかの調査(「製造販売承認前適合性調査」という)と、医薬品の承認後も5年毎にGMP適合性調査(「製造販売承認後等適合性調査」という)を受ける必要があります。これらの調査は書面または実地で行われます。
また、都道府県およびPMDAは、必要に際し、製造所に立ち入り、構造設備や帳簿書類などを立入検査することができます。
近年多発している医薬品の品質に関わる違反事案
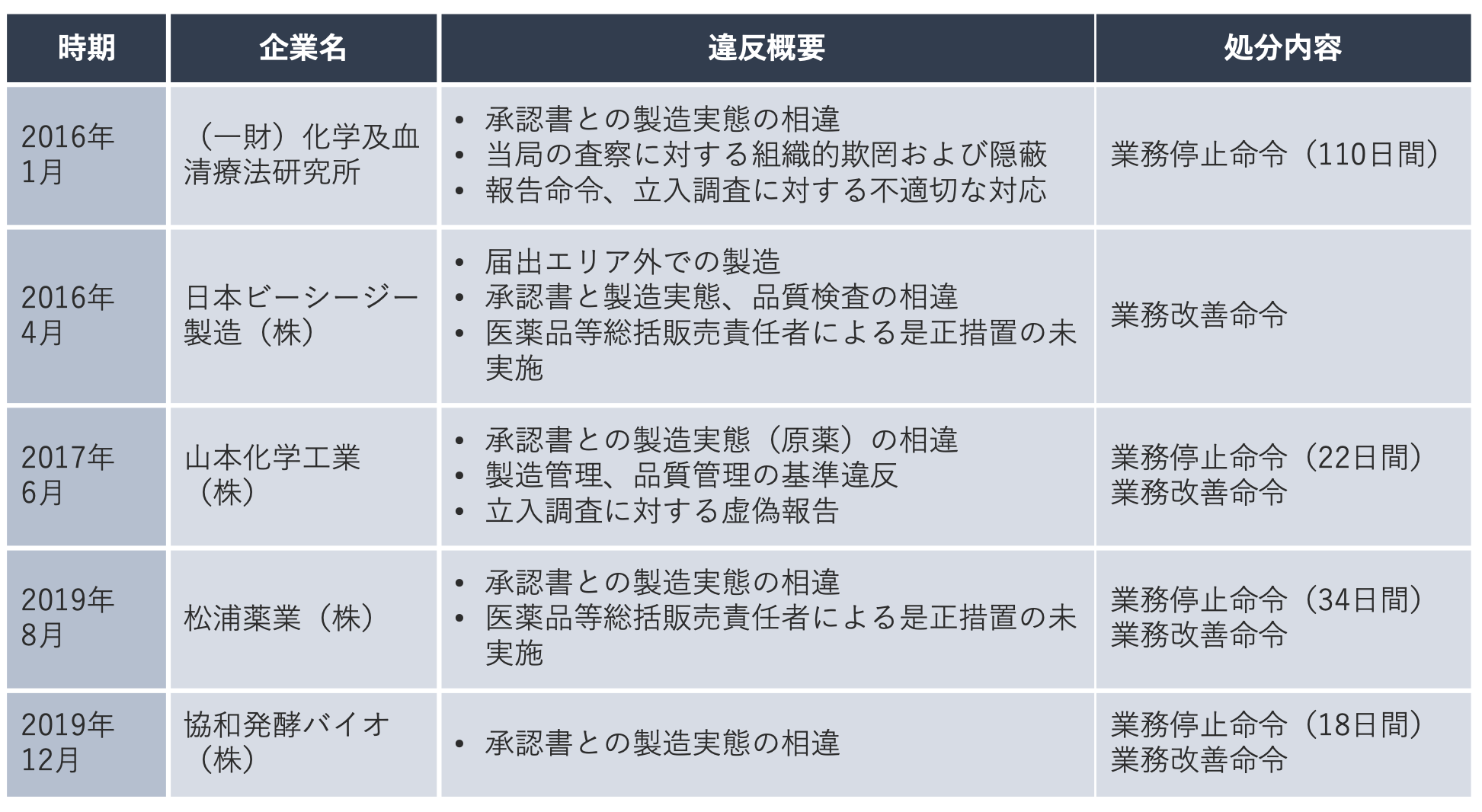
各種調査の結果、承認書と製造実態が異なることが判明した事案や、立入調査に対して虚偽報告や不適切な対応を行った事案がこれまで度々起こっています。下の表は、近年発生したGMP違反に関連した行政処分事案をまとめたものです。特に2016年に発生した化血研の事案では、長年にわたるGMP違反と、組織的な隠蔽事実が悪質であると問題視され、当時最長となる110日間の業務停止命令を受けました。
化血研の事案を受けて厚生労働省は、承認を得た全医薬品の製造販売業者に対して、承認書どおり製造されているか一斉点検を行うよう指示を出したり、都道府県に対して製造業者への無通告検査の実施を要請するなど、法令遵守の監視を強化しました。
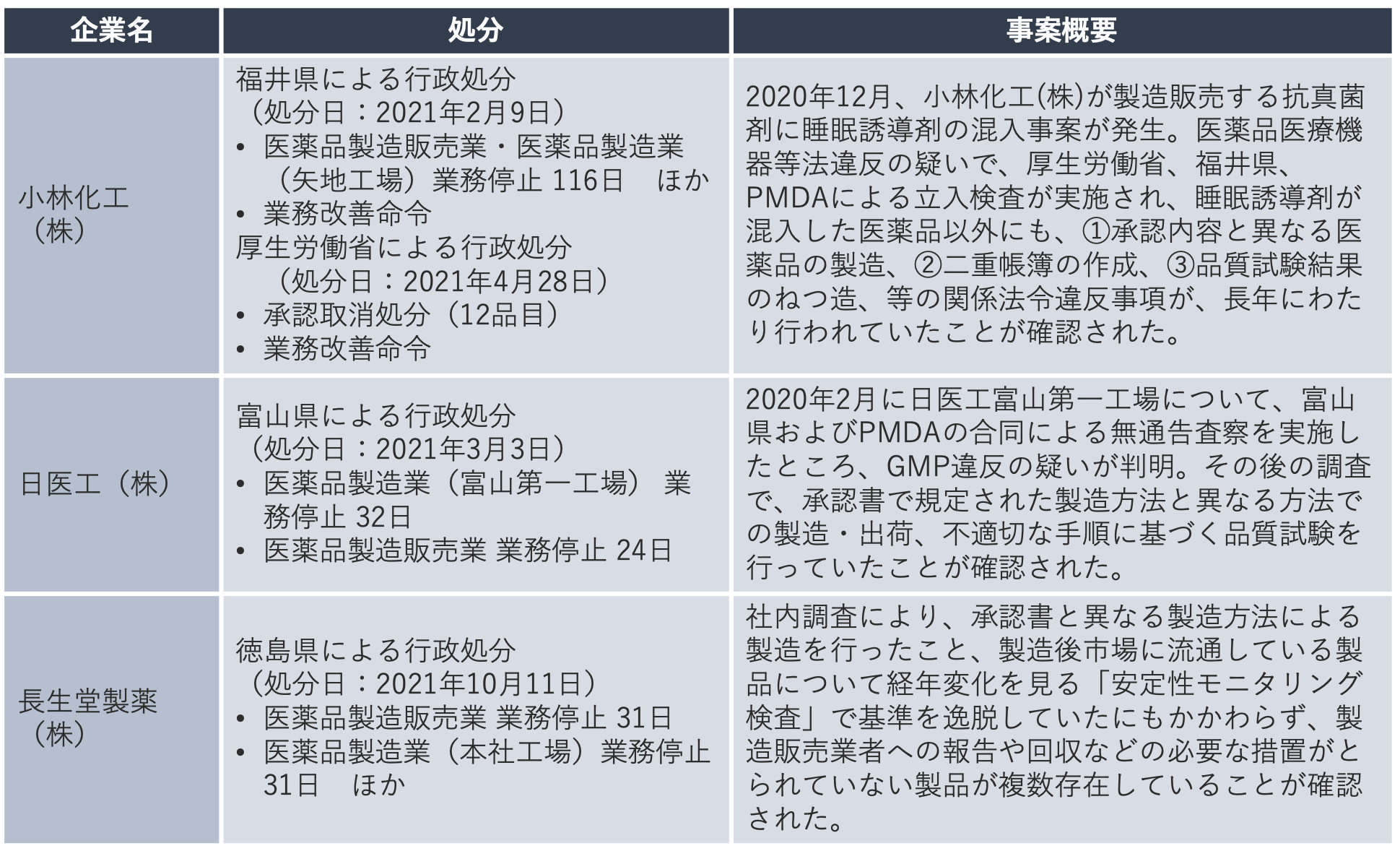
しかし2021年、後発医薬品メーカー3社が業務停止の行政処分を受けるという事態になっています。特に、小林化工の抗真菌剤への睡眠誘導剤混入事案では、自動車事故や転倒を起こして救急搬送や入院された方も出るなど、245名もの方から健康被害が報告されました。厚生労働省、福井県、PMDAによる立入検査の結果、睡眠誘導剤が混入した医薬品以外にも関係法令の違反事例が長年にわたり行われていたことが確認され、過去最も長い期間となる116日の業務停止処分、また12品目が承認取消処分となりました。
大手後発医薬品メーカーである日医工の製造所でもGMP違反が判明し、これを契機に日医工は社内調査により総点検を実施。承認書で規定された製造方法と異なる方法で製造されたなど問題が発覚した品目が次々に自主回収となる事態に発展しました。
【参考】小林化工の事案での健康被害:当該ロットを処方・調剤された患者344人に対し、直ちに服用中止の連絡を行い、該当ロットの回収に着手。2021年3月29日時点で245人から健康被害(ふらつき、めまい、意識消失、強い眠気などのほか、これに伴う自動車事故や転倒(車両運転時の事故38人、救急搬送・入院41人)が報告されている。また、因果関係不明であるが2人の死亡事例が報告されている。
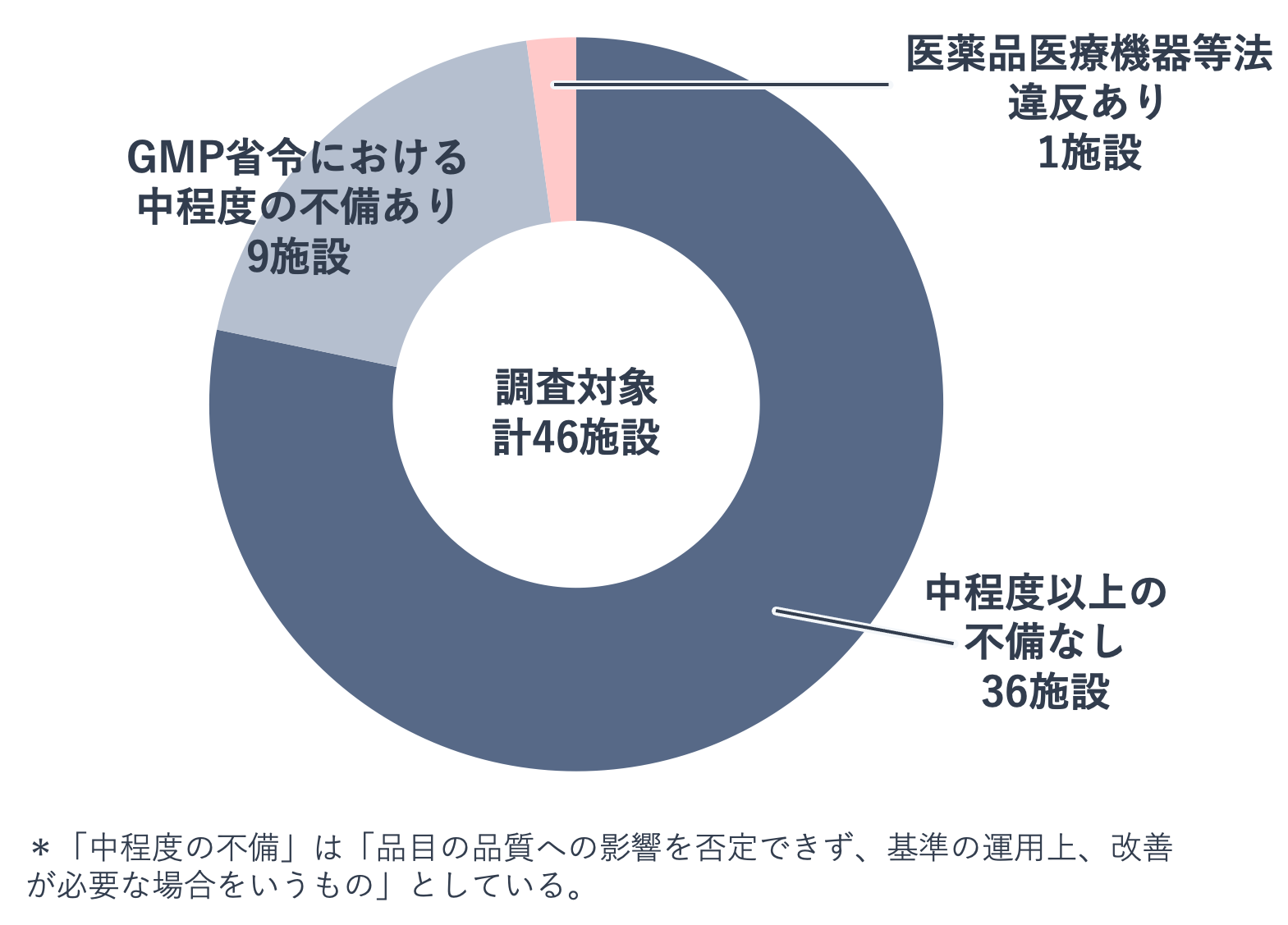
後発医薬品メーカーの品質問題を受け、厚生労働省は2021年7月、全国規模で製造業者への無通告立入検査を実施しました。調査対象は、沖縄県を除く各都道府県で後発医薬品製造所を中心に各1か所選定した計46施設(うち後発医薬品製造所32施設。その他原薬製造所、一般用医薬品製造所等14施設。)です。
立入検査の結果、1施設で承認書と異なる方法で製造した品目が確認されました。さらに、品質管理の不備などGMP基準に適合していない施設が9施設も確認されました。
法または承認事項に違反する医薬品は、製造販売業者が自主回収することとなっています。GMP違反があった場合などすぐに供給が再開できない場合には出荷停止や出荷調整が生じ、代替薬を含めた供給不安が生じることになります。
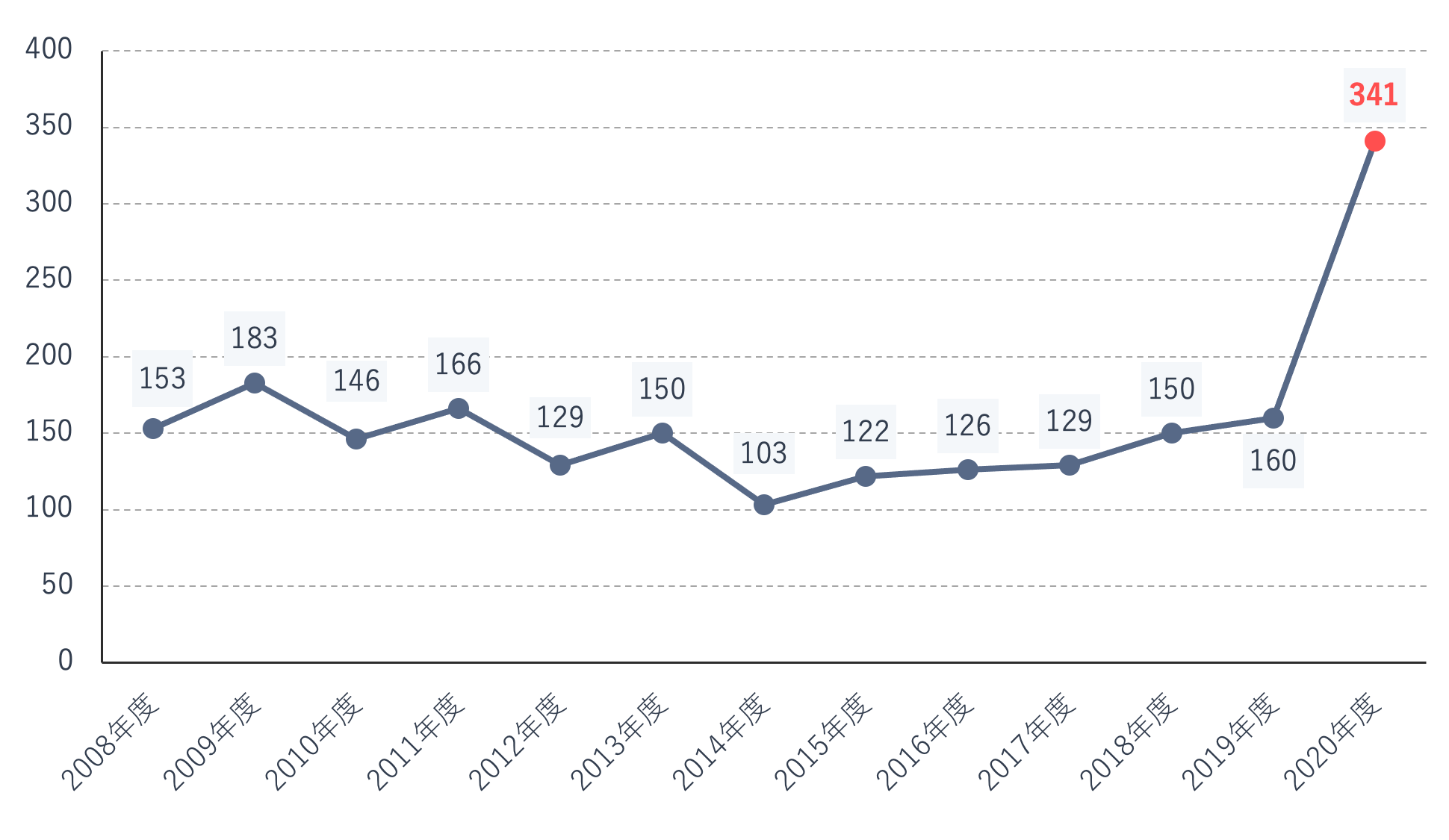
2010年度~2019年度の間は、1年間の医薬品回収件数は平均138件ですが、小林化工や日医工の事案が発生した2020年度の回収件数は341件に跳ね上がっています。
日医工の回収は2021年度に入っても次々と生じており、2020年度と同等もしくはそれ以上の回収件数となることが予測されます。
近年の医薬品の品質に関わる違反事例を重く受け止めた厚生労働省は、再発防止の観点から、業務停止命令などの行政処分を行う際に用いていた処分基準を見直して新たな基準を制定し、2021年8月から施行しました。行政処分の要件を明確化、厳格化した新基準では、業務停止日数の上限がこれまで「概ね110日」であったところ、「180日」に引き上げられています。
ここでMRの皆さんが注目すべきは、医療機関等への違反内容の情報提供が適切であったかが、行政処分の実施にあたって考慮される要素に含まれていることです。
行政処分基準改正のポイント
●行政処分の実施にあたり、以下の要素を基本事項として判断する
- 違反態様:違反態様の悪質性を違反事実ごとに検討
- 結果の重大性:保健衛生上の危害発生、医療機関の診療行為への影響の程度
- 有責性:役員または責任者による違反行為への認識、組織的な行為か、隠蔽の有無等
●上記の基本事項に加え、以下の要素を考慮
- 違主たる違反以外にも複数の法令違反があるか
- 医薬品の品質、安全性に対する国民からの信頼が失墜させられたか
- 違反内容の医療機関等への情報提供や、回収等措置が適切であったか
- 過去に医薬品医療機器等法違反による処分歴があったか
●業務停止日数の上限
概ね110日から180日に引き上げ
厚生労働省報道発表資料 より作成
供給不足時のMRの情報提供
最後に、医薬品の供給不足が生じた際の情報提供について考えます。
供給不安時に医療現場はどんな情報を求めているか
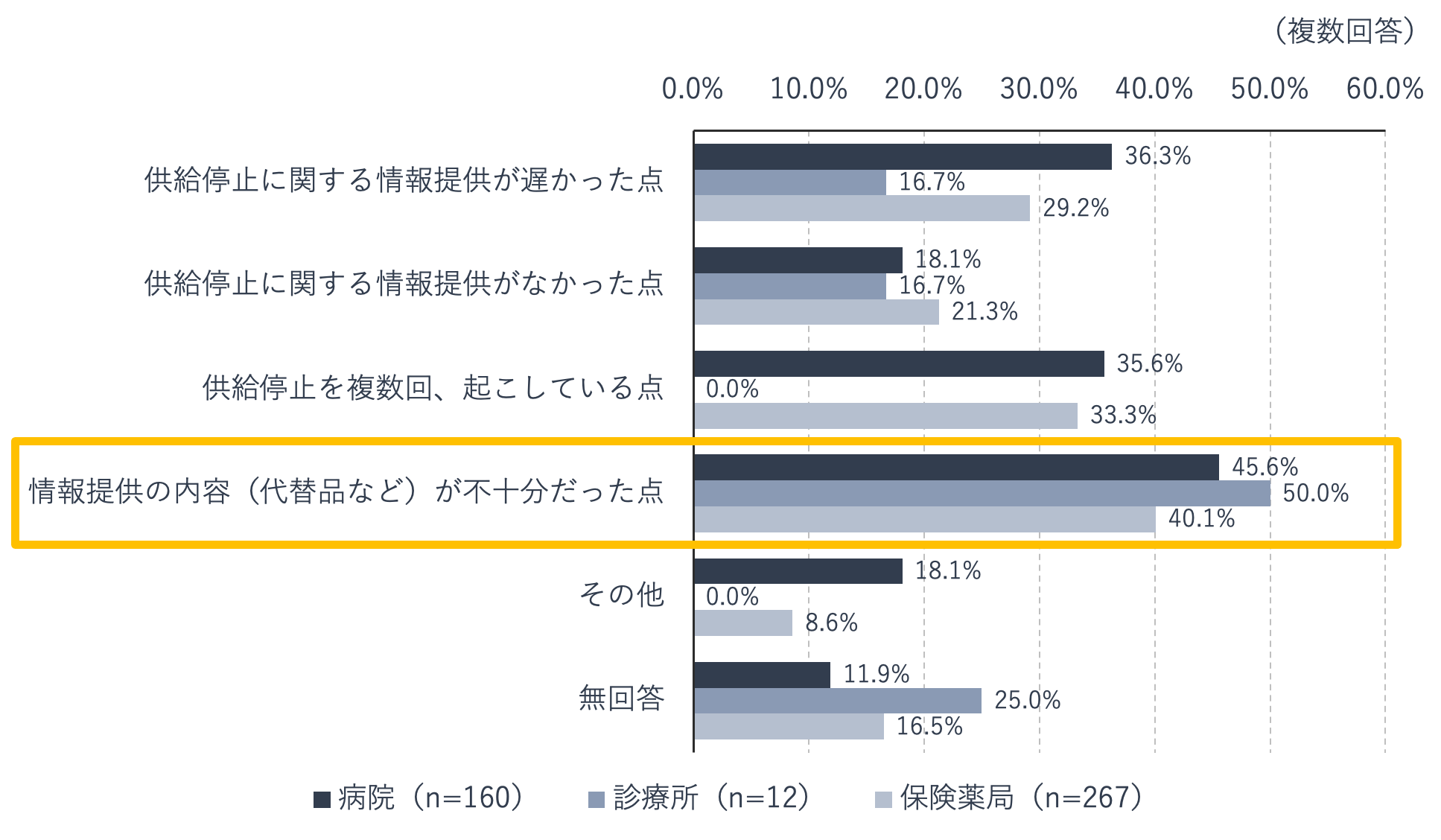
後発医薬品に関する医療機関・薬局への調査によると、2019年度に供給停止(メーカーが製造中止し出荷されなくなったことと定義)となった後発医薬品があったと回答した医療機関・薬局に対して、供給停止時のメーカーの対応についての評価を尋ねたところ、対応を評価する(「十分評価している」「どちらかといえば評価している」)と回答した施設は、病院では22%(n=209)、診療所では33.3%(n=21)、薬局では24.8%(n=371)でした。
それ以外の回答(「どちらともいえない」「どちらかといえば評価していない」「全く評価していない」「その他」「無回答」)を選択した施設へ、供給停止時のメーカーの対応への不満点を尋ねた結果が下の図です。病院、診療所、薬局のいずれも、代替品など情報提供の内容が不十分だった点が、最も多く選択されています。
【参考】厚生労働省医政局経済課 委託事業「後発医薬品使用促進ロードマップに関する調査」
調査対象:全国の病院の中から無作為抽出した1,500施設(有効回答数305(有効回答率20.3%))、全国の一般診療所の中から無作為抽出した2,000施設(有効回答数461(有効回答率23.1%))、全国の保険薬局の中から無作為抽出した2,500施設(有効回答数776(有効回答率 31.0%))。
調査実施時期:2021年1月26日~2021年2月17日
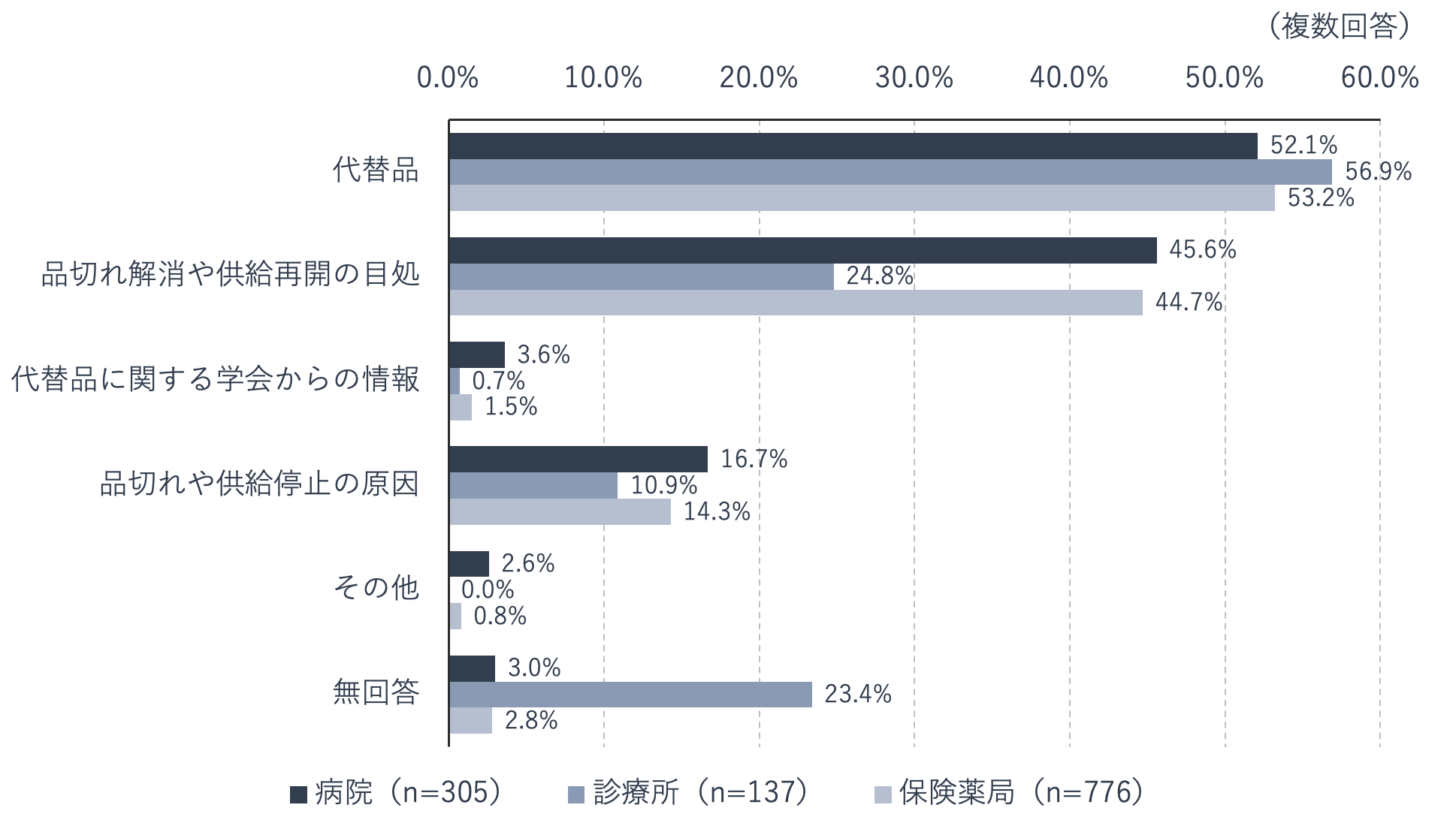
後発医薬品の供給停止や品切れが発生した場合に必要な情報を尋ねたところ、病院、診療所、薬局のいずれも「代替品」が最も多かったものの、「品切れ解消や供給再開の目途」も病院で45.6%、薬局で44.7%の施設が選択しています。また「品切れや供給停止の原因」といった詳細な情報を求める施設も一定割合みられます。
厚生労働省は、回収・欠品・出荷調整などによって医療機関・薬局で必要な量の医薬品が供給できない場合、またはできない恐れがある場合など、供給不足が判明した際には、速やかに、その医薬品を取り扱う医療機関・薬局・卸に対して、以下に記載する事項について情報提供を行うよう、製薬関連団体(日本製薬団体連合会、日本ジェネリック医薬品販社協会など)へ通知を発出しています。
供給不足が判明した際に医療機関等へ提供する事項
- 供給不足の原因となる回収・欠品・出荷調整等の理由と供給不足が解消する見込みの時期(供給不足の始期、調整方法、生産再開の見通し、通常の安定供給が確保できる時期等)に関する情報
- 必要に応じて関係学会と相談のうえ、優先して対応すべき疾患など供給の優先順位に関する情報※
※ 複数の効能・効果を有する場合に優先して対応すべき疾患や、代替薬の入手可能性・代替療法の実施可能性などを考慮し、医療上の必要性を踏まえた優先順位の設定等 - 供給不足が解消されるまでの対応策(代替薬・代替療法等、代替薬の製造販売業者や卸売販売業者との供給調整等)に関する情報※※
※※ 必要に応じて関係学会と調整し、その調整状況や診療ガイドラインでの位置づけを併記すること - 医療機関・薬局および卸売販売業者からの照会に対応する窓口に関する情報
医政経発1218第1号 より作成(下線:編集部)
やはり、代替薬の情報や生産再開の見通し、通常の安定供給が確保できる時期などの情報提供が求められています。なお通知には、②③の供給不足状態での対応策について情報提供に時間を要する場合は、速報として①④を提供すること、とあります。
薬局薬剤師インタビュー
医薬品供給不足について薬局薬剤師さんにインタビューを行いました。以下のお話から、医薬品供給不足が生じた際のMR活動のあり方を考えてみましょう。

「私の薬局では医薬品供給不足の対応でMRさんから連絡や訪問を受けたことはありません。
医薬品の回収がある場合、当薬局ではほとんど、卸さんが製品のロット番号照合などから回収までやってくださいます。当薬局は卸さんによる迅速なサポートで成り立っているといっても過言ではありません。しかし、製造中止などがあった場合、いつ製造が再開されるのか、いつ供給再開されるのかなど、卸さんのもとにも情報が届いておらず、製薬メーカーのウェブサイトを調べてもわからないことがあります。担当のMRさんもわからず、どこに問い合わせればよいかわからないことさえあります。
卸さん、製薬メーカーのMRさん、薬局、この三者で丁寧な情報共有を行い、バランスの取れた三角形の連携ができあがれば、卸さんの負担も軽減され、薬局でもMRさんの存在を意識するようになるのではと思います。」
薬局薬剤師への取材より
医薬品の安定供給の重要性を考える
2021年9月に厚生労働省が策定・公表した「医薬品産業ビジョン2021」には、医薬品製造販売業者は、品質確保と安定供給について最終責任を負う主体であると明記されています。
製造販売業者は、品質確保と安定供給について最終責任を負う主体であり、他社であっても製造所の実態を把握し、適切な GQPで製品が製造されているかを管理監督できるもののみが製造販売業者となるべきである。そして、当該製造販売業者の管理監督の下、GMPを遵守できる企業が製造業者として製造管理・品質管理に努めるべきである。
厚生労働省「医薬品産業ビジョン2021」より(赤字:編集部)
先ほど紹介した医療機関へのアンケート調査結果や、薬局薬剤師さんのお話にあったように、医薬品の供給不安が生じた際にMRがじゅうぶんな情報提供を行わないことは、製造販売業者として責務を果たしていると言えるでしょうか。
そもそも、医薬品の安定供給はどうして重要なのか、「医薬品産業ビジョン2021」に記載された下記の文章を読み、その重要性を改めて考えてみてください。
医薬品は、疾病の脅威から健康・生命を守る手段である。安定した品質の医薬品の存在は国民の日々の安心感の醸成につながっており、その欠品は社会全体の不安を招くとともに、実際に健康面の被害が想定される。その供給の断絶はすなわち国民の危険を意味し、医薬品の安定供給は重要な視点である。
厚生労働省「医薬品産業ビジョン2021」より
MRの皆さんへ
先発医薬品やスペシャリティ領域では、供給不安を経験したMRは少ないかもしれません。その結果、ここ数年の異常事態とも言える大規模な医薬品供給不安について、他社のこと、自分には関係ないこと、という態度になってはいないでしょうか。
医薬品の供給問題には複雑な背景が絡み合っており、いち企業ですべての課題を解決することは困難です。しかし、医薬品の品質確保、安定供給に国をあげて取り組みはじめたいま、製薬業界の一員として、無関心な態度でいてよいでしょうか。製薬企業を代表して医療者と向き合う職種として、患者さんのために働く者として、この問題を真剣に考えるMRが求められています。
MRの皆さんへ
- ここ数年の異常事態とも言える大規模な医薬品供給不安について、他社のこと、自分には関係ないこと、という態度になってはいないか。
- 医薬品の品質確保、安定供給に国をあげて取り組みはじめたいま、製薬企業を代表して医療者と向き合う職種として、患者さんのために働く者として、この問題を真剣に考えるMRが求められている。
出典
- 2020年9月 医療用医薬品の安定確保策に関する関係者会議 取りまとめ
- 2021年3月26日(6月1日修正版)安定確保医薬品リスト
- 2021年3月26日 医療用医薬品の安定確保策に関する関係者会議(第5回)資料1-2(3)
- 2020年3月27日 医療用医薬品の安定確保策に関する関係者会議(第1回)資料2
- 2021年11月5日 中央社会保険医療協議会 薬価専門部会(第182回)資料2
- 2020年6月26日 医療用医薬品の安定確保策に関する関係者会議(第2回)資料5
- 2020年9月 医療用医薬品の安定確保策に関する関係者会議 取りまとめ概要
- 2021年9月16日 第5回医薬品等行政評価・監視委員会資料1
- 2021年7月28日 薬生監麻発0728第5号
- 2020年度全国薬務主管課長会議資料
- 2021年8月31日 厚生労働省報道発表資料
- 2021年7月9日 令和3年度第1回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会資料5-1
- 2021年6月25日 厚生労働省報道発表資料
- 令和2年度 後発医薬品使用促進ロードマップに関する調査報告書
- 2020年12月18日 医政経発1218第3号通知
- 2021年9月13日 厚生労働省「医薬品産業ビジョン 2021~医療と経済の発展を両立させ、安全安心な暮らしを実現する医薬品産業政策へ~」