この講義で伝えたいこと
皆さんは、上記のイラストはどのようなシーンを描いたものか、わかるでしょうか?
1999(平成11)年8月24日、厚生労働省は正面玄関前に、薬害を再発させない決意を刻んだ「誓いの碑」を設置しました。全国薬害被害者団体連絡協議会は毎年8月24日を「薬害根絶デー」とし、厚生労働省や文部科学省への要望書提出や、誓いの碑の前でのリレートークなど、薬害根絶のための活動を行っています。上記のイラストは、誓いの碑の前で、厚生労働大臣が薬害被害者から要望書を受け取るシーンを描いたものです。
薬害は過去のもの、終わったことではなく、薬害を再び発生させないための取り組みは現在も続いています。医薬品の品質や有効性・安全性の確保、医薬品による危害の発生と拡大防止のために、薬事制度が改正されることもそのひとつです。
医薬品の安全管理情報の収集・提供を業務とするMRにとって、薬害の歴史を知ることは、何より大切な学びであるといえます。この講義を通して、医薬品安全対策の意義をその成り立ちの背景から理解し、安全性監視活動とリスク最小化活動に取り組む重要性を再確認してください。
本編の前に
本編をはじめる前に、独自に行ったアンケート調査の結果の紹介と、基本的な用語の確認をしておきます。
薬害についての認知度調査
皆さんに質問です。
ジフテリア予防接種禍事件、ペニシリンによるショック死事件、サリドマイド事件、キノホルムによるスモン事件、アンプル入り風邪薬によるショック死事件、クロロキン事件、薬害エイズ事件、ソリブジン事件、薬害肝炎事件、ヒト乾燥硬膜によるクロイツフェルト・ヤコブ病事件。このなかで、知っている、もしくは聞いたことがある薬害をすべて選んでください。
医療従事者と医薬品の製造販売に関する仕事に従事する人を除く20歳以上の方を対象に同じ質問をしました。性別・年代の偏りなく回答を集計した結果がこちらです。
一般の方の認知度が最も高かったのは「薬害エイズ」で51.4%でしたが、回答を年代別にみると、20歳代では16.2%でした。薬害エイズは1980年代に起こった事件です。訴訟は1996年に和解し当時は大きなニュースになりましたが、今から20年以上前のこととなり、物心がつく以前の出来事だった人も多いのでしょう。そして大半の人は、その後の報道や学校教育のなかで薬害エイズを知る機会がなかったと推察されます。
ここに挙げたほとんどの薬害が、年齢層が若くなるにつれて認知度が下がっていました。
「誓いの碑」に刻まれたことば
「誓いの碑」は、厚生省(当時)が「薬害エイズ事件」を反省し、医薬品による悲惨な被害を再び発生させることのないよう、その決意を銘記したものです。
誓いの碑
命の尊さを心に刻みサリドマイド、スモン、HIV感染のような医薬品による悲惨な被害を再び発生させることのないよう医薬品の安全性・有効性の確保に最善の努力を重ねていくことをここに銘記する
千数百名もの感染者を出した「薬害エイズ」事件
このような事件の発生を反省しこの碑を建立した平成11年8月 厚生省
厚生労働省ウェブサイトより
碑に刻まれた「サリドマイド」、「スモン」、「HIV感染」という薬害について、あなたはどれだけ理解していますか?
薬害の歴史
ここから、講義の本編をはじめます。
まずは、昭和から平成にかけての、薬害の歴史をみていきましょう。
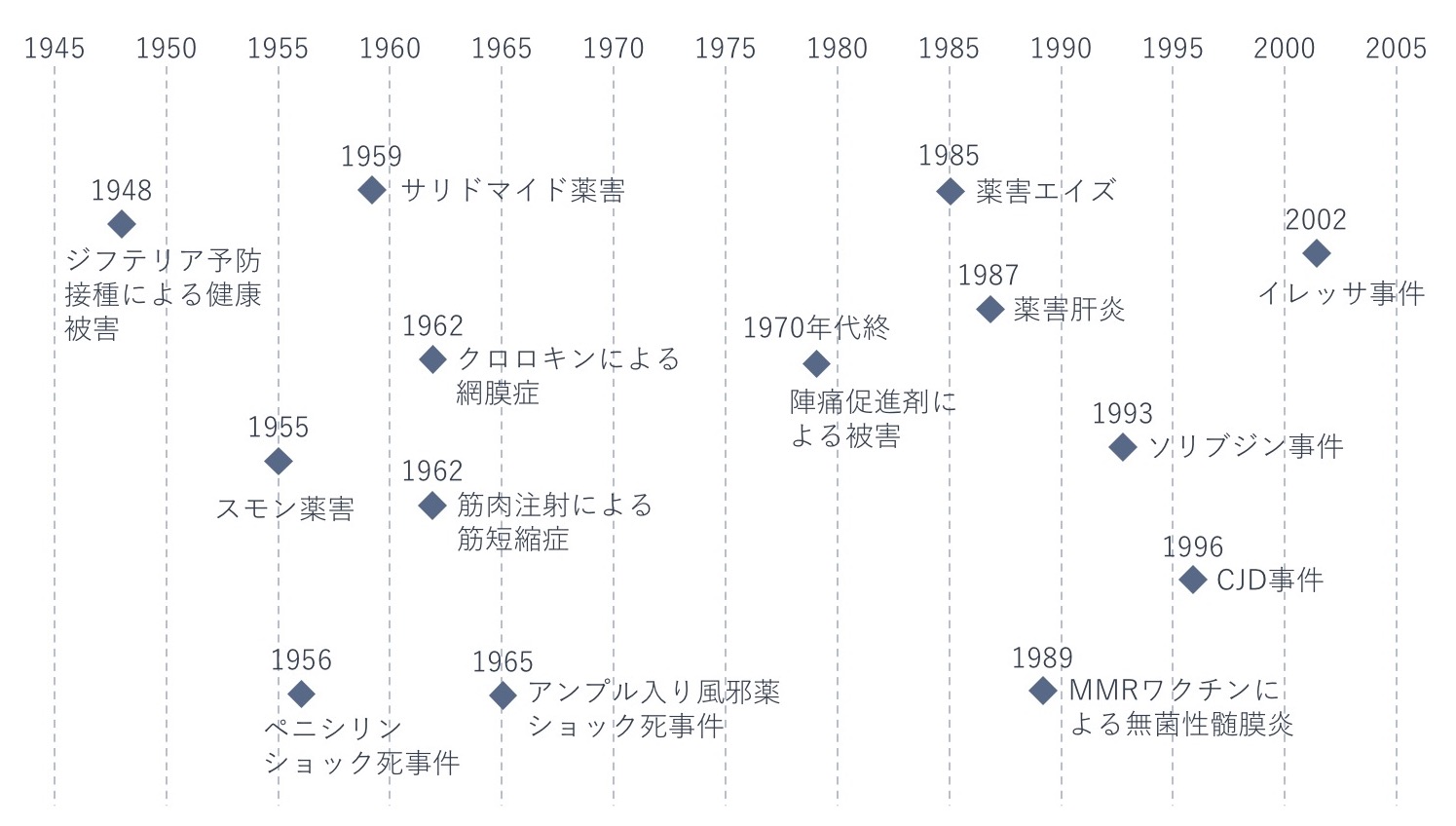
昭和から平成にかけて数多く発生した薬害
下の図は、昭和から平成にかけて発生した薬害を年表にしたものです。日本で被害が報告された時期を発生した年としています。そのため、報告以前から被害者が出ていた薬害もあります。図に挙げた薬害は主なものであり、このほかにも薬害とされている事件があります。
【注】薬害として扱うかどうかは、主張する人の立場や発表する場所などの要因によって、必ずしも一致するものではない。
現在、これらの薬害事件の発生当時を知る現役MRは少ないと推察します。薬害事件の当事者製薬企業は吸収合併などで社名がなくなっている企業も多く、いまのMRにとって薬害は、遥か昔の事件に風化しつつあるのではないでしょうか。
図に示した薬害はすべて詳しく取りあげたいところですが、いくつかの薬害に絞って、概要と主な経過をみていきます。
スモン薬害
スモン(SMON)とは、亜急性脊髄視神経症(Subacute Myelo-Optico Neuropathy)の頭文字をとったもので、神経症状による歩行困難などに加え、視力障害を伴うなど、全身に影響が及び患者さんに耐えがたい苦痛を与える難治性の疾患です。
原因はキノホルムという古くから使われていた医薬品で、1989年にスイスで開発された外用殺菌剤でした。1920年代からは腸内の殺菌を目的にアメーバ赤痢の治療薬として内服されるようになり、日本では1939年に劇薬指定が取り消され、日本薬局方に収載されています。その後、徐々に適応を拡大し、整腸剤として非常によく使われたほか、市販薬にもキノホルムを含有するものが多くありました。
日本では1955年頃からスモン患者の発生が報告され、1969年に発生数がピークになりましたが、限定された地域での集団発生であったことから風土病や伝染病と疑われ、患者さんは身体的なつらさに加え、差別や偏見など、社会的にも苦しい思いをしました。
スモン患者さんには緑色便や緑色舌苔がみられることは知られていましたが、1970年になって、緑色の物質がキノホルムと鉄のキレート化合物であることが明らかとなったこと、キノホルムの使用量とスモン発病率の相関関係が示されたことから、厚生省(当時)はキノホルムの販売中止、使用中止措置をとり、患者の発生は止まりました。
スモン薬害の特筆すべき点は、被害者数が非常に多い点はもちろん、使用方法や使用量などの変化に対し「古くから使われていた薬剤である」ことは安全性の担保とならないことがわかった点です。
サリドマイド薬害
サリドマイド薬害は、同時期に発生したスモン薬害とともに、日本の薬事制度の根幹を揺るがした薬害であり、現在の薬事制度導入のきっかけともなった薬害といわれています。
1950年代後半から1960年代にかけて、妊婦が服用した医薬品が原因で、四肢奇形などの重い障害を負った子供が次々と生まれました。これがサリドマイド薬害です。
サリドマイドによる子供への作用として、重症の四肢の欠損症(無肢症、アザラシ肢症、奇肢症、母指三指節症)、耳の障害(難聴、無耳症、小耳症)などがみられます。これらはサリドマイド胎芽症と呼ばれます。また、心臓や消化器系のさまざまな部位で異常が起こることも知られています。
サリドマイドは当初、てんかんの治療薬として開発されましたが、鎮静催眠作用があることが明らかとなり、1957年10月に当時の西ドイツで鎮静催眠剤として販売が開始され、ヨーロッパ諸国でも販売されました。日本での販売開始は1958年1月です。当時、つわりに苦しむ妊婦に愛用されていました。
1961年11月に西ドイツのレンツ博士が、四肢奇形をもって生まれた子供と母親のサリドマイド服用との因果関係を発表したところ、西ドイツの製造販売企業は9日間で製品を回収、10日後にはヨーロッパ各地で製造・販売中止となりました。
しかし日本では因果関係不明としたために、レンツ博士の警告から出荷停止まで半年、回収まで10か月も経過し、他の国より多くの被害を出してしまいました。日本での認定被害者数は309人ですが、これは出生した被害者数です。死産などを含む推定被害者数は約1,000人とも1,200人ともいわれています。
【参考】サリドマイドはその後、多発性骨髄腫に対する有効性が明らかとなり、日本では2008年に「再発又は難治性の多発性骨髄腫」を適応症として承認された。
薬害エイズ
薬害エイズは、アメリカで採血された血液を原料として製造された非加熱の血液凝固因子製剤(非加熱製剤)の投与を受けた血友病患者さんなどが、製剤に混入していたHIVに感染し、エイズ(AIDS)を発症した事件です。
血友病とは血液凝固因子の先天的な欠損または活性低下がみられる遺伝性疾患です。いったん出血してしまうと血が止まりにくいため、日常生活にも注意が必要です。治療には不足している血液凝固因子を注射投与して補充します。
非加熱製剤によるHIV感染の薬害被害は世界的に起こりましたが、日本では加熱製剤の承認が遅れたことに加え、非加熱製剤の回収が遅れたことで、日本の血友病患者のうちHIVに感染した患者は約4割とも半数ともいわれています。
薬害エイズは「誓いの碑」が建てられたきっかけとなった事件ですが、1989年に提訴された訴訟は和解まで7年かかり、被害者の要望であったこの碑の建立も厚生省(当時)にはなかなか受け入れられず、和解から3年の月日を要しました。
薬害肝炎
薬害肝炎は、出産時の大量出血などで止血剤としてフィブリノゲン製剤(※)、非加熱性の血液凝固因子製剤の投与を受けたことで、多くの母親や手術を受けた患者がC型肝炎ウイルス(HCV)に感染した事件です。C型肝炎ウイルスに感染すると、慢性肝炎、肝硬変、肝がんと進行することがあります。
薬害エイズと同じくウイルスが混入した血液製剤により引き起こされた薬害ですが、薬害エイズでは原因薬剤の投与が主に血友病という限定された疾患の患者であったところ、薬害肝炎では使用対象者が広く、被害者数は少なくとも1万人を超えると推計されています。
薬害肝炎訴訟は2002年の提訴から長く争われましたが、2007年末に当時の福田康夫総理が被害者救済を表明し、2008年1月に薬害肝炎救済法(※)が成立、国と原告の間で紛争解決のための基本合意書が締結されました。
※フィブリノゲン製剤:フィブリノゲンとは血液凝固因子のひとつ。フィブリノゲン製剤は原料血漿からフィブリノゲンを高純度に分離精製し、その精製物を凍結乾燥したもの。
※薬害肝炎救済法:正式名称は「特定フィブリノゲン製剤及び特定血液凝固第IX因子製剤によるC型肝炎感染被害者を救済するための給付金の支給に関する特別措置法」。
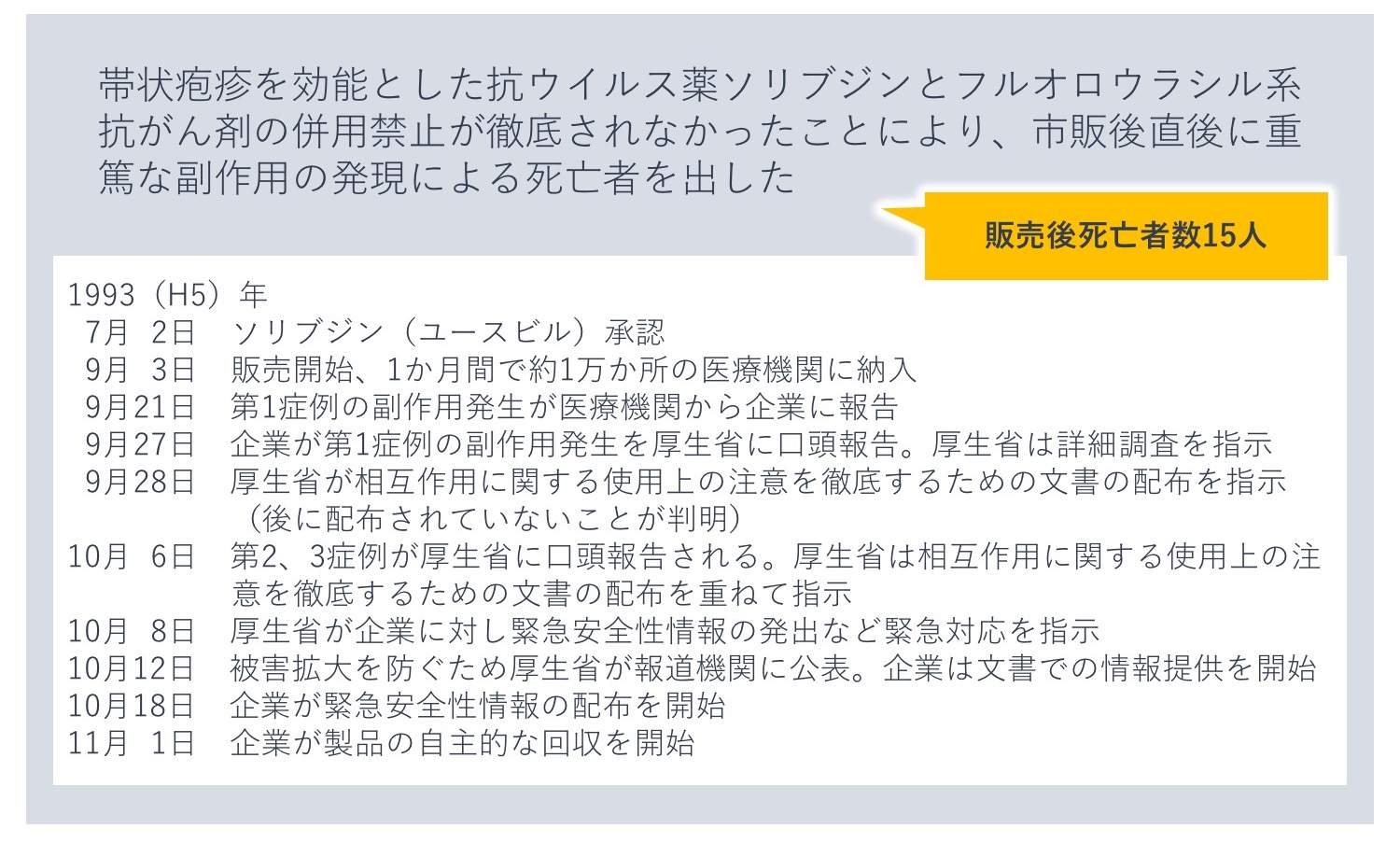
ソリブジン事件
1993年に発生したソリブジン事件は、帯状疱疹を効能とした抗ウイルス薬として発売されたソリブジンとフルオロウラシル系抗がん剤との併用により、15人が死亡した事件です。
ソリブジン事件はこれまでの単剤での薬害とは異なり、フルオロウラシル系抗がん剤と併用することで、薬物相互作用により抗がん剤の副作用が強く発現してしまったものでした。第Ⅱ相試験で死亡例が発生し、第Ⅲ相試験前の併用毒性試験ではすべてのラットが死亡していたため、ソリブジンとフルオロウラシル系抗がん剤との併用の危険性は承認審査段階で認識されており、添付文書の「使用上の注意」に相互作用として記載されていました。しかし、売り上げへの影響をおそれ注意喚起が消極的であったこと、また医療機関への周知が徹底されなかったことにより、不適正使用が起こり死亡例を出してしまったのです。
既知の副作用の周知が徹底されていなかったという問題点のほか、製造販売企業の対応が迅速でなかった点も問題となりました。医療機関から第1症例の副作用発生が企業に報告されてから厚生省への報告に6日もかかっていること、厚生省から注意喚起の文書配布指示が出ていたにもかかわらず配布されていなかったことなどが後に判明しました。
CJD事件(ヒト乾燥硬膜によるクロイツフェルト・ヤコブ病事件)
クロイツフェルト・ヤコブ病(CJD)は100万人に1人の割合で孤発性、または家族性に生じる希少疾患で、脳組織が海綿状に変性してしまい、脳機能障害を引き起こします。発病より3〜7か月で無動性無言状態に陥り、1〜2年で死に至るといわれており、現在も治療法は開発されていません。
ヒト乾燥硬膜によるCJD事件は、脳外科手術で病原体に汚染されたヒト乾燥硬膜の移植を受けた患者がその後CJDを発症した事件です。原因となったヒト乾燥硬膜はドイツからの輸入品で、日本では1973年に輸入承認されました。法規制上は医療機器(当時は医療用具と呼ばれていた)となります。
1987年にアメリカで第1症例が報告され、FDAは安全警告を出していますが、日本ではヒト乾燥硬膜移植手術が継続されました。1997年になりWHOが硬膜を使用しないよう勧告したことを受け、国が回収命令を出すまで、その使用は中止されませんでした。
CJDの潜伏期間はこれまでの平均では12年ですが、最長約31年の報告もあり、近年発症した被害患者さんも存在します。
「薬害」とは
そもそも、「薬害」とはどのような事象を指すのでしょうか。
たとえば、何人以上の被害者が出れば薬害、訴訟を経て製薬企業や国の責任が認められれば薬害、などの基準が存在するわけではなく、公式見解としての定義はありません。
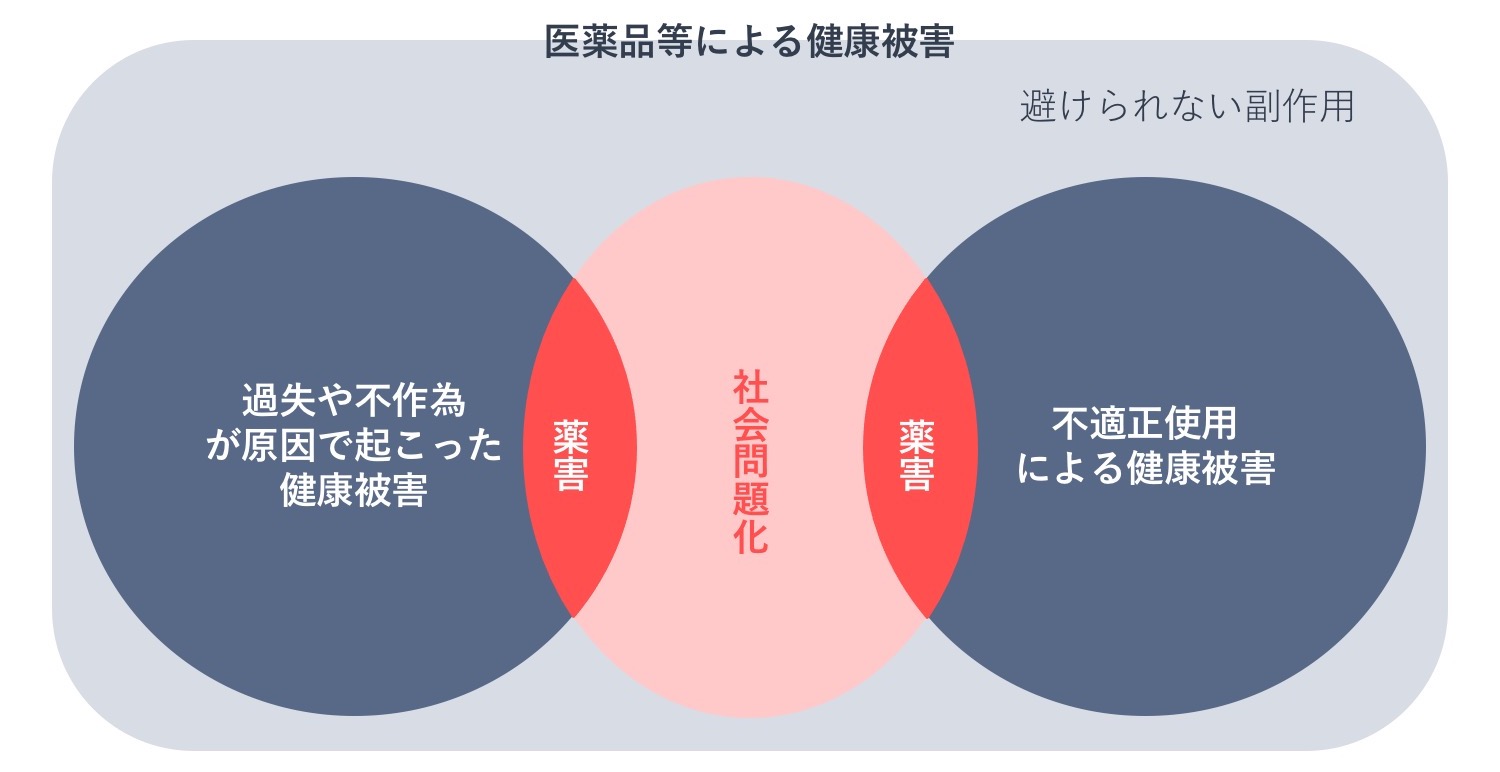
ここでは、医薬品医療機器レギュラトリーサイエンス財団の元理事長・故土井脩(どいおさむ)氏が提唱した薬害の定義を紹介します。下の図をみてください。
まず、医薬品による健康被害には、避けられない副作用があります。これは適正使用しても防ぐことができない健康被害で、たとえば各種薬剤によるスティーヴンス・ジョンソン症候群(SJS)や中毒性表皮壊死症(TEN)、抗がん剤による副作用などが挙げられます。
避けられない副作用ではない健康被害には、不適正使用による健康被害と、企業、行政、医療機関などの過失や不作為(あえて積極的な行為をしないこと)などが原因で起こった健康被害があります。不適正使用による健康被害は、医療過誤や医療事故として捉えられます。たとえば、定期的な肝機能検査が義務づけられているにもかかわらず実施されなかったために起こった重篤な肝機能障害や骨髄抑制などの個人レベルの被害です。被害が個人レベルを超えて広範囲で、表面化し、社会問題化したものが一般的に薬害として扱われます。また、企業、行政、医療機関などの過失や不作為などが原因で起こった健康被害のうち、表面化し、社会問題化したものが一般的に薬害として扱われます。
この分類からわかるのは、「社会問題化」が「薬害」の鍵となっているということです。
「MRテキスト」でも、医薬品の安全確保を図るべき関係者の過失や不作為により被害が拡大した場合や、医薬品による重大な健康被害が社会問題になるほど拡大した場合を、「薬害」としています。
医薬品の安全確保を図るべき関係者がその担うべき役割を的確に果たさなかったために被害が拡大した場合,単なる副作用被害でなく「薬害」と呼ぶ.
「MRテキスト2018 MR総論」より
医薬品による重大な健康被害が社会問題になるほど拡大する現象を薬害という.
「MRテキスト2018 医薬品情報」より
ここでは、被害の「拡大」もキーポイントになっています。
先ほど詳しくみてきたスモン薬害、サリドマイド薬害、薬害エイズ、薬害肝炎、ソリブジン事件、CJD事件のすべてにおいて、製薬企業や国の対応の遅れが被害を拡大させてしまったと考えられます。
薬害が促した薬事行政の見直し
ここからは、薬害と日本の薬事行政の見直しについてみていきます。
安全対策の背景に薬害あり
これまで多くの薬害が発生し、多くの被害者を生んできたことをみてきました。医薬品産業の発展とともに薬害が頻発した1950年代、60年代は現在のような医薬品安全対策がまだ整っておらず、薬事行政は薬害が発生するたび、その教訓から見直されてきました。医薬品の安全対策の変遷は、繰り返されてきた薬害の歴史を反映しているといえます。また、医薬品の副作用で健康被害を受けた人を救済する被害救済制度も、薬害をきっかけに整備されてきました。
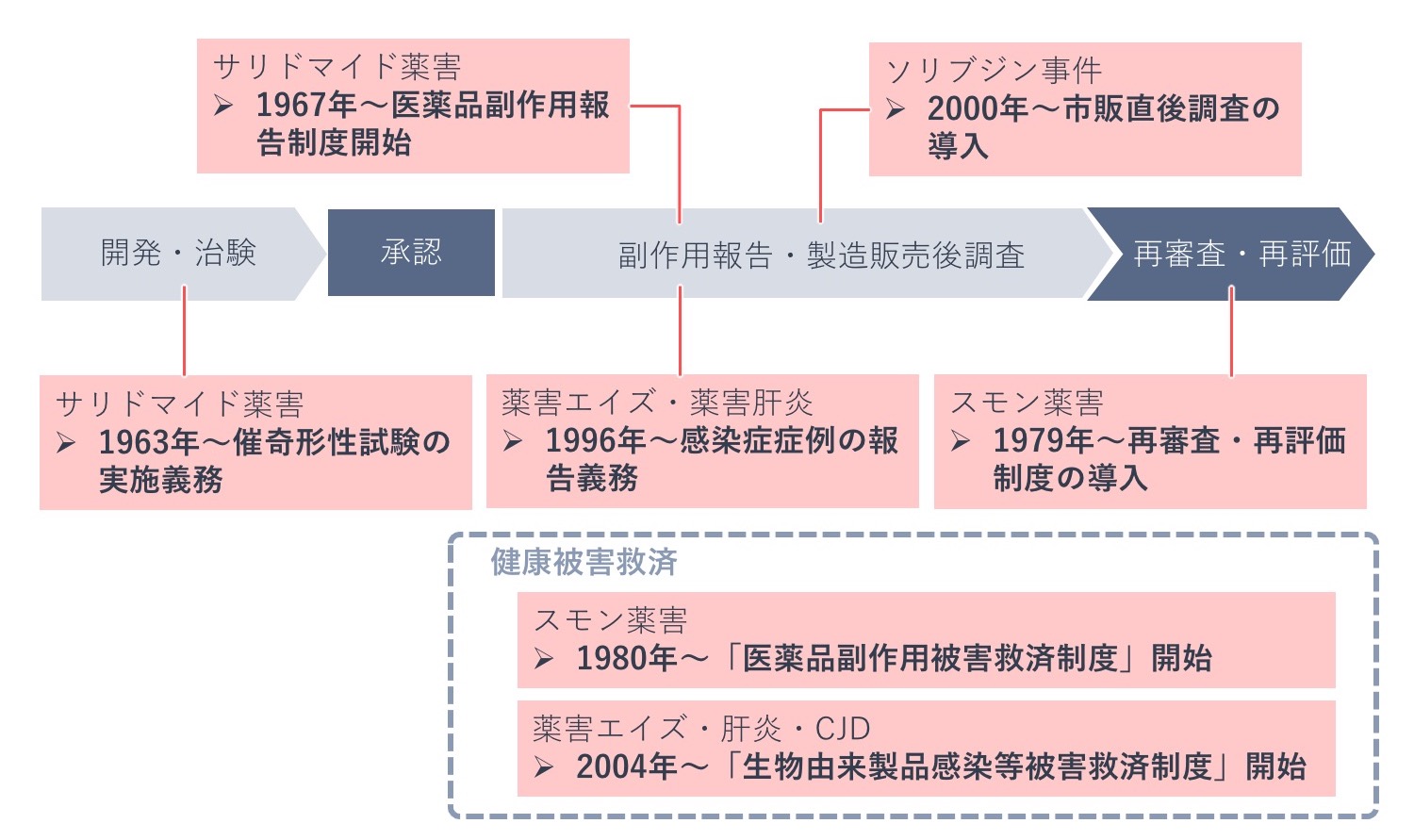
下の図は、医薬品の開発から市販後の各段階で現在敷かれている医薬品安全対策規制のうち、薬害をきっかけに制度化された代表的なものを示した図です。
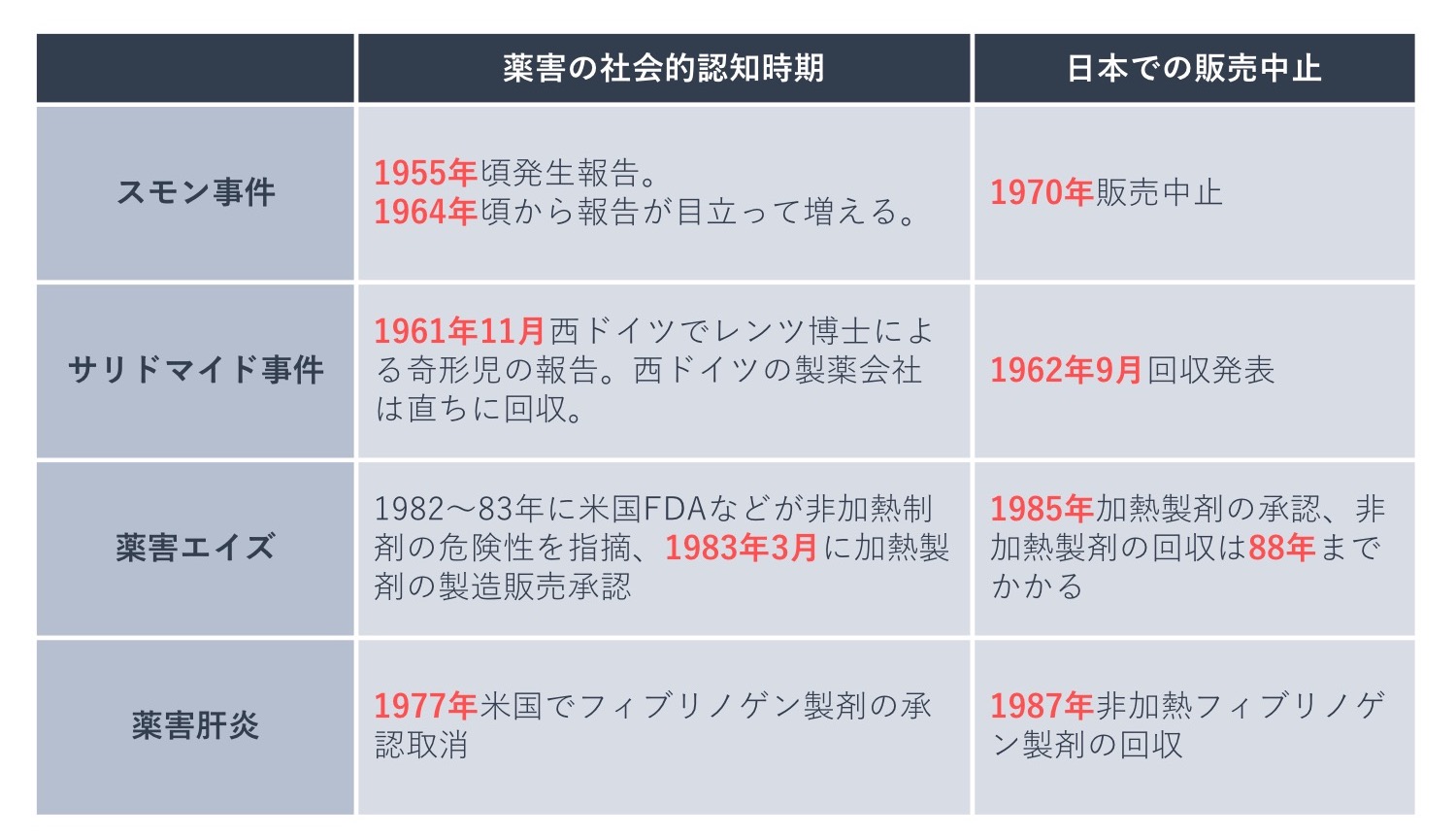
サリドマイド薬害、スモン薬害、薬害エイズ・肝炎・CJD、ソリブジン事件発生後の対応について、それぞれ詳しくみていきます。
薬害後の医薬品に関する規制の主な動き
サリドマイド薬害が発生するまでは、医薬品の副作用が胎児に影響を及ぼすことは知られていませんでした。そのため、今では信じられないことですが、医薬品開発に催奇形性試験は義務づけられていませんでした。サリドマイド薬害により、医薬品は胎児への影響を十分に調べなければならないことが認識されるようになり、催奇形性試験が1962~1963年に全世界で検討され、日本では1963(昭和38)年から新薬開発に催奇形性試験が義務づけられました。
1967(昭和42)年には、それまで慣例的に行われてきた承認審査の方針を明確化する「医薬品の製造承認等に関する基本方針」が通知され、承認申請に必要な資料の範囲が規定されました。
同じく1967(昭和42)年には、製薬企業に副作用報告を課す方針が示されました。これは現在の企業報告制度の原型です。また医療関係者が副作用を報告する現在の「医薬品・医療機器等安全性情報報告制度」の原型である医薬品副作用モニター制度が開始されました。
スモン事件後の対応としては、1979(昭和54)年に薬事法(現・医薬品医療機器等法)が改正され、新医薬品について承認から一定期間経過後に有効性等を再度確認する再審査制度、既存医薬品について有効性、安全性、品質を再度見直す再評価制度が新設されました。そして、サリドマイド薬害後の対応として行政指導で行われていた企業からの副作用報告制度が義務化されました。
同年、「医薬品副作用被害救済基金法」が制定され、翌年5月から「医薬品副作用被害救済制度」が開始されました。
薬害エイズ・薬害肝炎といった血液製剤による薬害発生後の対応として、1996(平成8)年に薬事法改正が行われ、医薬品の使用による感染症症例の報告が義務づけられました。
そして、その後に発生したCJD事件での被害を教訓に、2002(平成14)年には薬事法および血液法(※)が改正され、「生物由来製品(※)」と「特定生物由来製品(※)」が新たに規定され、生物由来の製品に対する安全対策の強化が図られました。生物由来製品の製造販売業者による感染症定期報告制度が導入されたのはこの時のことです。
2004(平成16)年には、従来からの医薬品副作用被害救済制度に加え、「生物由来製品感染等被害救済制度」が開始されました。
※血液法:「採血及び供血あつせん業取締法」が改正され、「安全な血液製剤の安定供給の確保等に関する法律」(いわゆる「血液法」)となった。
※生物由来製品:人その他の生物(植物を除く。)の細胞、組織等に由来する原料または材料を用いた製品のうち、保健衛生上特別の注意を要するもの。(例:ワクチン、遺伝子組換え製品、動物成分抽出医薬品、医療機器ではブタ心臓弁など)
※特定生物由来製品:生物由来製品のうち、製品における感染症の発生リスクが理論的にも、かつ、経験的にもより高いもの。(例:血液凝固因子、人血清アルブミン、人免疫グロブリン、輸血用血液のような血液製剤や、人胎盤抽出物など)
ソリブジン事件後の対応により、現在の医薬品安全対策に関する制度がほぼ整いました。
ソリブジン事件はCJD事件と同時期の発生であったため、先ほど触れた1996(平成8)年の薬事法改正はソリブジン事件への対応も含んでいます。具体的にはGCPの遵守の義務化があります。
ソリブジン事件の数か月前に「21世紀の医薬品のあり方に関する懇談会」が出した最終報告において、既に添付文書の見直しの必要性が提言されていましたが、事件を受けて改めて、安全性に関する情報提供のあり方が問われました。1997(平成9)年には、重要な注意喚起を文書の前方に出すなど、記載順序の変更を含む添付文書記載要領の全面改正通知が発出されました。
ちなみに、医療機関への医薬品情報提供の質的向上を図るため導入されたMR資格認定制度が始まったのも1997年のことです。
2000(平成12)年には「市販直後調査制度」が新設され、新薬発売直後の未知・重篤副作用の発現に備え、販売開始後6か月間の安全性情報の収集と提供が徹底されることになりました。
新薬メーカーのMRでは特に、当たり前に日常業務のなかに根付いている市販直後調査が、わずか20年ほど前に新設された制度であることに驚く人もいるでしょう。薬害は決して遥か昔の出来事ではないのです。
薬害は終わっていない
PMDA(医薬品医療機器総合機構)では健康被害救済業務として、医薬品副作用被害救済業務、生物由来製品感染等被害救済業務のほか、スモン患者に対する健康管理手当等の受託・貸付業務、HIV感染者、エイズ発症者に対する健康管理費用等の受託給付業務、特定フィブリノゲン製剤および特定血液凝固第IX因子製剤によるC型肝炎感染被害者に対する給付金の支給業務を現在も行っています。
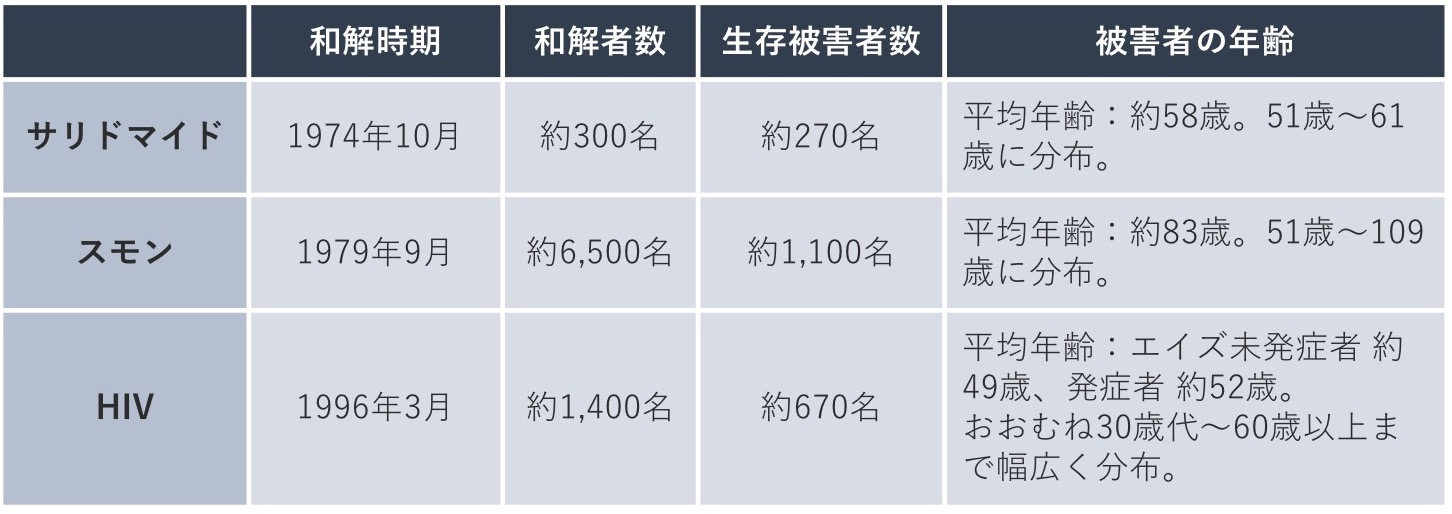
発生してから時間が経過した薬害では被害者が高齢化しているものもありますが、たとえばサリドマイド薬害被害者の平均年齢は現在約58歳、薬害エイズ被害者の平均年齢(エイズ未発症者)は約49歳と、まだまだ若い方も多く、薬害に今もなお苦しんでいる患者さんがたくさんいます。訴訟の終結などにより、薬害事件が一応の決着を迎えても、被害を受けた患者さんの命や身体が元に戻ることはないということを忘れてはいけません。
再び薬害を起こさないために
ここからは、司法、被害者、行政など、さまざまな視点から薬害再発防止について見つめ、製薬企業やMRは何をすべきか考えていきます。
司法の視点から
第1章で示した薬害の年表のなかで最も新しい事件である「イレッサ事件」は、世界に先駆けて日本で承認販売された分子標的薬イレッサの投与により間質性肺炎などの重篤な副作用が生じ、患者さんが死亡した事件です。厚生労働省の発表では、承認直後の半年で180人が死亡、その後、EGFR遺伝子変異が効果予測因子となるというエビデンスが確立されるまでの9年の間に、イレッサとの因果関係が否定できない死亡者は843人に達しました(2011年12月31日時点報告)。
患者さんと遺族が製薬企業と国に対し損害賠償を求めた訴訟は、2013年、原告の敗訴により終結しました。イレッサによる副作用被害に対し製薬企業と国の責任はないとした判決でしたが、その判決文には以下のような文章があります。

副作用が重篤であり,本件のように承認・輸入販売開始時に潜在的に存在していた危険がその直後に顕在化した場合について,使用した患者にのみ受忍を求めることが相当であるか疑問が残るところである。法の目的が,製造者の責任を規定し,被害者の保護を図り,もって国民生活の向上と国民経済の健全な発展に寄与することにあるならば,有用性がある新規開発の医薬品に伴う副作用のリスクを,製薬業界,医療界,ないし社会的により広く分担し,その中で被害者保護,被害者救済を図ることも考えられてよいと思われる。
「平成24年(受)第293号 損害賠償請求事件 平成25年4月12日 第三小法廷判決」より
原告側が敗訴した事件ということで、イレッサの副作用被害は薬害ではないとする声もあります。しかし、重篤な副作用を患者にのみ受け入れ耐えることを求めてよいのかは疑問が残る、新規開発の医薬品に伴う副作用のリスクは製薬業界、医療界を含め社会的に広く分担し、被害者保護、被害者救済を図ることも考えられてよいと思われる、という言葉には考えさせられるものがあります。
薬害被害者の視点から
薬害被害にあわれた患者さんは再び薬害が起こらないようにという一心から、自身やご家族の体験をさまざまな場で語っておられ、インターネット上で公開されているものも多くあります。
たとえば、全国薬害被害者団体連合協議会が主催する「薬害根絶フォーラム」での被害患者さんによる講演を当協会ウェブサイトで閲覧することができ、この講義で紹介しきれなかった薬害についても知ることができます。
壮絶な体験、今なお続く苦しみに胸が苦しくなりますが、製薬業界に身を置く者として、必ず知っておくべきことだと感じます。
薬害被害者の声の例

- 「薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会」での薬害肝炎被害者ヒアリング
- 薬害根絶フォーラムでの講演
筋短縮
MMR
陣痛促進剤
イレッサ
編集部作成
行政の視点から
薬害肝炎訴訟を経て、2008年に国と原告との間で交わされた基本合意書に基づき、厚生労働省は薬害再発防止のための医薬品行政のあり方を検討する委員会を発足しました。その委員会のとりまとめとして出された最終提言(「薬害再発防止のための医薬品行政等の見直しについて(最終提言)」)には、製薬企業のあり方として、下記の記載があります。
- 特に予防原則を基本として、国民の生命健康の安全を第一に迅速な意思決定と行動がとられるべきことは、製薬企業にも強く求められている。
- 特に安全対策については、薬害肝炎事件のみならず、過去の薬害事件の教訓は、製薬企業が、有効性を過大に、危険性を過小に評価する過ちを犯しやすいということを示している。現在はGVP省令をはじめとする安全対策基準が整備されているが、各企業は、過去の教訓を踏まえ、安全対策を一層強化すべきである。たとえば、副作用報告について、医薬品との因果関係の評価に関する消極的な姿勢は取るようなことがあってはならない。
「薬害再発防止のための医薬品行政等の見直しについて(最終提言)」より
医薬品による何らかの被害が発生した際、被害を拡大させないために重要になるのは製薬企業の迅速な意思決定です。製品回収の措置などは企業の意思決定を待たざるを得ない場面もありますが、被害拡大を防ぐためにMR個人ができること、また被害の予防のために日々の活動のなかでできることがあるはずです。
薬害再発防止のために、予防原則を基本として迅速な行動をとること、医薬品の有効性を過大に、危険性を過小に評価しないこと、副作用報告について医薬品との因果関係の評価に消極的な姿勢を取らないこと。これらはMR活動において常に心にとめておきたい提言です。
医薬品製造販売業者の薬害教育
最終提言には、製薬企業において薬害教育を必須項目とすべき、という記載もあります。
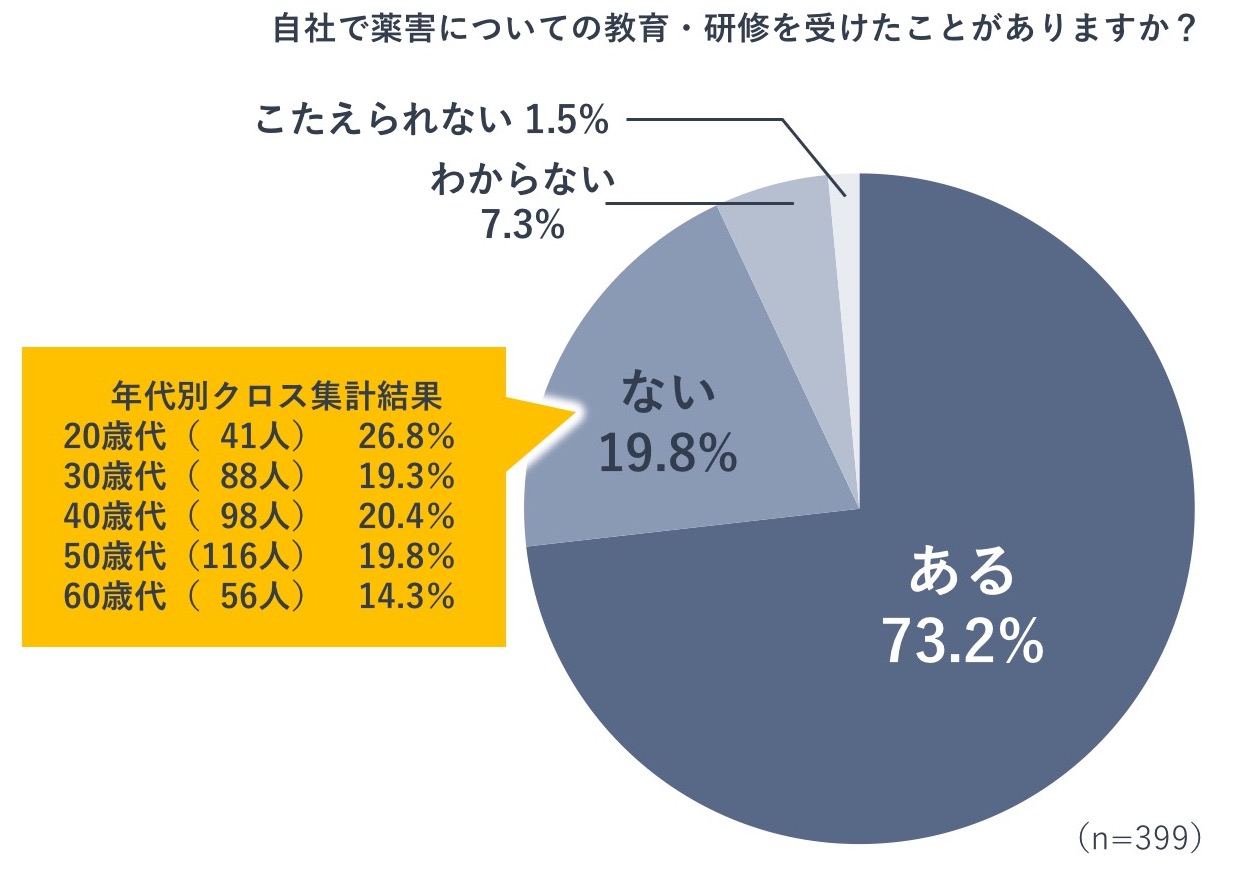
そこで、医薬品の製造販売に関する仕事に従事している20代~60代の男女399人に対してアンケート調査を行いました。
自社で薬害についての教育・研修を受けたことがあるかという質問に対し、73.2%の人が「ある」と回答し、19.8%の人が「ない」と回答しました(n=399)。回答を年代別にみると、「ない」と回答した人はどの年代でも一定数いることがわかります。
ちなみに、文部科学省の「薬害問題に対する各大学の取組状況調査結果(令和2年度)」によると、医学部医学科では99%、歯学部歯学科および薬学部では100%、看護学部等では86.2%が薬害被害について学ぶ授業を実施しています。
MRの皆さんへ
最後に、薬害発生当時を知るMR経験者、臨床開発職の方から伺ったエピソードと、MRの皆さんへ向けたメッセージを紹介します。
薬害エイズ発生当時を知るMRへのインタビュー
薬害エイズ発生当時を知る元MR(当時は「プロパー」と呼ばれていた)Aさんに、お話を伺いました。Aさんのお話から、薬害発生当時の空気を感じてください。
「私が新人の頃、薬害エイズが発生しました。当事者企業であったミドリ十字のプロパーとは担当病院でよく顔を合わせており、挨拶を交わす間柄でした。
薬害エイズ事件が起こった当時はプロパーにとって売り上げが最重要の時代で、ミドリ十字は『日本の非加熱製剤は問題ない』というリーフを配布するよう自社プロパーに指示を出していたようです。ミドリ十字のプロパーとは薬害の報道が苛烈を極めるなか病院の廊下で会いましたが、意外と落ち込んでいない様子で、当事者意識が薄いように私には感じられました。
新薬が発売されるとき、MRは売上というプレッシャーがある反面、新薬への期待と興奮を感じていることと思います。そんななか予期せぬ有害事象が発生すると、落胆し、これからの対応を思い不安に襲われたり、企業や開発者へ怒りを感じるMRもいるでしょう。しかし誰より落胆し怒りを感じているのは、病気の治癒や軽快を期待して医薬品を服用した患者さんです。発売してから長い年月が経過している薬剤でも、適応拡大などがきっかけとなり新たな有害事象が発見される可能性はあります。また、これまで気づかれなかった有害事象が検出されることも考えられます。
MRには企業の代表者として、製品についての説明責任があります。私にも経験がありますが、担当製品で有害事象が発生したとき、緊張して医療機関へ向かうはずです。このとき、医療機関が納得できる説明ができるか不安な気持ちになります。Q&Aなどの対策のシナリオを作成しますが、実際にはそれだけでは足りません。誠心誠意、自分にできることを最大限やるしかありません。新たな被害を生まないために、できるかぎり多くの医師や薬剤師に有害事象の発生を伝えなければなりません。
当事者企業の対応が遅れたり不誠実であるために被害が拡大した副作用被害は、『薬害』となってしまうと私は考えています。薬害を未然に防ぐために、どんな些細な有害事象も情報収集できるよう、日頃からの医療機関との関係構築が重要なのだと、薬害発生当時を知る経験が教訓として活かされていると思います。」

- 薬害エイズ事件が起こった当時はプロパーにとって売り上げが最重要の時代だった
- 薬害当事者企業のプロパーは当事者意識が薄いように感じられた
- 医薬品による有害事象が発生したとき、誰より落胆し怒りを感じているのは、病気の治癒や軽快を期待して医薬品を服用した患者さんである
- MRには企業の代表者として製品についての説明責任がある。新たな被害を生まないために、できるかぎり多くの医師や薬剤師に有害事象の発生を伝えなければならない
- 薬害を未然に防ぐために、どんな些細な有害事象も情報収集できるよう、日頃からの医療機関との関係構築が重要
編集部取材より
臨床開発職に就かれているBさんにもお話を伺い、MRの皆さんへメッセージをいただきましたので紹介します。
「臨床開発職は開発した医薬品を上市するために、安全性と有効性が科学的根拠をもって示されているかデータ分析を行い、PMDAとの交渉にあたっています。特に新規経路をもつ新薬では、社内の人間だけでなく、研究者や専門医師と共同で、安全に使用できる方法を模索しながら上市させています。
その結果、MRに覚えてもらうこと、注意してほしいことが増えます。これは二度と薬害を起こさないため、薬害の当事者企業にならないための知識です。添付文書やインタビューフォームは、医療機関が医薬品を適正に使用できるように、基礎研究から臨床試験までの成果が詰め込まれたものです。MRの皆さんには、開発時のことをもっと問い合わせに来て欲しい、それが開発者の願いです。
これは新薬に限った話ではありません。ジェネリック医薬品は先発品と有効成分は同一ですが、それ以外は別ものです。医薬品に限らず、人間のからだのなかに入るものは基本的にすべて異物です。つまり、ジェネリック医薬品でも未知の副作用が発生する可能性はあります。先発医薬品でもジェネリック医薬品でも、患者さんのからだに入るものとして、その重みは同じです。
近年、バイオシミラーの市場が拡大しており、開発に参入する企業も増えています。バイオシミラーはバイオ医薬品のジェネリックという位置づけではありますが、バイオ医薬品は動物の細胞などを使うため、不均一なものが産生される可能性が本質的に存在し、ウイルスやマイコプラズマ、プリオンなどの汚染物質が混入するリスクもあるなど、未知の副作用が発生しやすい特性をもっています。つまりバイオシミラーは、“先発品と同じだから安全性のエビデンスが蓄積されている”という考え方はできません。バイオシミラーを従来の化学合成医薬品のジェネリックと同様に捉えて活動することは、開発担当者からみると危険なことです。
医薬品をからだに入れるのは患者さんだけであること、すべてにおいて患者さんを中心に考えなければならないことを忘れないでほしいと思います。」

- 臨床開発職は医薬品を安全に使用できる方法を模索しながら上市させている
- MRに覚えてもらうこと、注意してほしいことは、二度と薬害を起こさないため、薬害の当事者企業にならないための知識である
- MRの皆さんには開発時のことをもっと問い合わせてほしい
- 先発医薬品でもジェネリック医薬品でも、患者さんのからだに入るものとして、その重みは同じ
- バイオシミラーを従来の化学合成医薬品のジェネリックと同様に捉えて活動することは、開発担当者からみると危険なこと
- 医薬品をからだに入れるのは患者さんだけであること、すべてにおいて患者さんを中心に考えなければならないことを忘れないでほしい
編集部取材より
リアルワールドデータを活用することで副作用の発生が早期に検出できるようになる、ゲノム医療や個別化医療の進展によって副作用が起こる可能性の低い治療を選択できるようになるなど、さまざまな技術の進歩により、令和の時代には薬害の根絶が期待されます。
しかし最近、製造工程で睡眠導入剤成分が混入した医薬品による健康被害が発生しました。これは製造工程での人為的なミスによる製品の欠陥が起こした事案であり、この講義で扱ってきた薬害事件とは性格が異なるところがありますが、医薬品による大規模な健康被害が再び起こってしまったことは残念でなりません。ある薬害被害者の言葉に、「薬は副作用被害の原因物質だが、被害を拡大させ薬害を引き起こすのは人なのだ」というものがあります。最近の事案は、現在のようにさまざまな技術が進歩した時代でも、人が原因で医薬品による健康被害が起こり得るのだと私たちに改めて気づかせる出来事でした。
令和の時代のMRが薬害再発防止のためにできることは、医薬品が起こした悲惨な被害から学ぶ気持ちを忘れないこと、常に患者さんを最優先に考えること、そしてMRの業務ひとつひとつが薬害防止につながっていることを心にとめ、日々の安全性監視活動とリスク最小化活動にあたることです。
MRの皆さんへ
- さまざまな技術の進歩により、令和の時代には薬害の根絶が期待される
- しかし最近の睡眠導入剤成分が混入した医薬品による健康被害の発生のように、現在のようにさまざまな技術が進歩した時代でも、人が原因で医薬品による健康被害は起こり得る
- MRの業務ひとつひとつが薬害防止につながっている
出典
- 厚生労働省ウェブサイト「誓いの碑」ページ(2021年6月アクセス)
- 厚生労働省「薬害を学ぼう」 2017年2月改訂版
- 2008年10月27日 第6回薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会 資料5の参考資料
- 2009年3月27日 薬害肝炎の検証および再発防止に関する研究班「薬害肝炎の検証及び再発防止に関する研究 中間報告書」
- 2019年1月1日 一般財団法人医薬品医療機器レギュラトリーサイエンス財団 薬害関連教育資料「行政担当者から見たソリブジン事件」
- 2019年1月1日 一般財団法人医薬品医療機器レギュラトリーサイエンス財団 薬害関連教育資料「薬害とは何か」
- 公益財団法人MR認定センター「MRテキスト2018 MR総論」「MRテキスト2018 医薬品情報」
- 2021年1月 厚生労働省医薬・生活衛生局 全国厚生労働関係部局長会議説明資料
- 平成24(受)293 損害賠償請求事件 平成25年4月12日 最高裁判所第三小法廷 判決
- 2008年6月5日 第2回薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会 ヒアリング資料
- 全国薬害被害者団体連絡協議会ウェブサイト(2021年6月アクセス)
- 2010年4月28日 薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会「薬剤再発防止のための医薬品行政等の見直しについて(最終提言)」
- 文部科学省「薬害問題に対する各大学の取組状況調査結果(令和2年度)」
- 財団法人日本公定書協会. 知っておきたい薬害の知識―薬による健康被害を防ぐために―. 株式会社じほう, 2011