この講義で伝えたいこと
新型コロナウイルス感染症の大流行で一般の報道でもよく耳にするようになった「院内感染」。医療の安全を脅かす問題として、新型コロナウイルス感染症流行以前から、臨床の現場では院内感染対策は重視されてきました。
治療薬がない感染症との闘いは非常に厳しいものになります。その意味で最も脅威であると言えるのが、薬剤耐性菌です。MRの皆さんのなかには、2017年から2018年にかけて鹿児島県の病院で、翌2019年には大阪府の病院で、薬剤耐性アシネトバクターの院内感染で死亡者が出てしまったことを記憶している方も多いでしょう。
MRとして薬剤耐性の問題に対してグローバルな視点を持ち、薬剤耐性対策を意識した情報提供ができているか考えてみましょう。
本編の前に
本編をはじめる前に、独自に行ったアンケート調査の結果の紹介と、用語の確認をしておきます。
「薬剤耐性菌」の認知度アンケート調査
MRの皆さんは職業柄、「薬剤耐性菌」を認知していることでしょう。では、一般の認知度はどの程度でしょうか。
医療従事者と医薬品製造販売に関する仕事に従事している人を除く20歳以上の人に、「薬剤耐性菌」という言葉を聞いたことがあるかアンケート調査を行ったところ、聞いたことがないと回答した人が半数を超えていました。
「薬剤耐性」とは
「薬剤耐性」とは、微生物に対し、抗微生物薬が効かなくなる、または効果が弱くなることをいいます。英語でAntimicrobial Resistanceといい、「AMR」と表記されます。薬剤耐性を示す細菌を特に「薬剤耐性菌」といいます。
薬剤耐性: Antimicrobial Resistance (AMR)
微生物(細菌、真菌、ウイルス、寄生虫)による感染症に対し、抗微生物剤が無効になる、又は、製剤による効果が減弱する事象を指す。
「薬剤耐性(AMR)対策アクションプラン 2016-2020」より(赤字:編集部)
「抗微生物薬」とは
抗微生物薬についても整理しておきましょう。
抗微生物薬とは、抗菌薬、抗真菌薬、抗ウイルス薬、抗寄生虫薬を含み、抗微生物活性を持ち、感染症の治療や予防に使用される薬剤の総称です。たとえば抗菌薬は、抗微生物薬のなかで、細菌に対して作用する薬剤を指します。抗生物質は微生物が産出する化学物質、抗生剤は抗生物質の抗菌作用を利用した薬剤を指します。
抗微生物薬等の定義
| 用語 | 定義 |
|---|---|
| 抗微生物薬 | 微生物(一般に細菌、真菌、ウイルス、寄生虫に大別される)に対する抗微生物活性を持ち、感染症の治療、予防に使用されている薬剤の総称。ヒトで用いられる抗微生物薬は抗菌薬(細菌に対する抗微生物活性を持つもの)、抗真菌薬、抗ウイルス薬、抗寄生虫薬を含む。 |
| 抗菌薬 | 抗微生物薬の中で細菌に対して作用する薬剤の総称として用いられる。 |
| 抗生物質 | 微生物、その他の生活細胞の機能阻止または抑制する作用(抗菌作用と言われる)を持つ物質であり、厳密には微生物が産出する化学物質を指す。 |
| 抗生剤 | 抗生物質の抗菌作用を利用した薬剤を指す通称。 |
「抗微生物薬適正使用の手引き 第二版」より編集部作成
抗生物質や抗生剤は、抗菌薬と学問的には意味が異なりますが、一般的には多くの場面で同じ意味で使われています。上の表に示したようにそれぞれ詳細な定義はありますが、臨床の場では、「抗菌薬」、「抗生物質」、「抗生剤」は、細菌に対して作用する薬剤を指すことばとして、互換性をもって使用されています。
薬剤耐性菌の院内感染防止のための取り組み
ここから、講義の本編をはじめます。
1928年の抗生物質ペニシリンの発見以来、新たな抗菌薬が次々と登場し、感染症の治療は飛躍的に進歩しました。一方で、治療薬に対し耐性を示す細菌が出現し、国内では、1980年代後半にメチシリン耐性黄色ブドウ球菌(MRSA)などの薬剤耐性菌による院内感染が問題となりました。
この章では、薬剤耐性菌の院内感染防止のために医療機関ではどのような体制がとられているかみていきます。
院内感染とは
院内感染とは、医療機関において患者さんが原疾患とは別に新たに罹患した感染症、または医療従事者等が医療機関内で感染した感染症をいい、「病院感染」や「医療関連感染」と表現されることもあります。
院内感染とは、①医療機関において患者が原疾患とは別に新たにり患した感染症、②医療従事者等が医療機関内において感染した感染症のこと
医政地発1219第1号(別記)「医療機関における院内感染対策に関する留意事項」 より
院内感染を注意すべき感染症はさまざまありますが、薬剤耐性菌による感染症は、治療薬が限られていたり、治療薬の効果が低かったり、最悪の場合は治療手段がないという可能性もあり、感受性菌による感染症と比較して死亡率が高くなってしまうため、特に警戒しなければなりません。
院内感染は、人から人へ直接、または医療従事者の手や医療機器、環境などを介して拡大します。特に、免疫力の低下した患者、低出生体重児、高齢者などの易感染患者は、通常の病原微生物だけでなく、感染力の弱い微生物によっても院内感染を起こす可能性があります。
また、治療のために多くの抗菌薬が使用される医療機関では、耐性菌が出現しやすい環境になっており、院内感染が起こる要因のひとつとなっています。
院内感染が起こる要因
- 入院患者は免疫機能が低下していることが多く、感染を受けやすく、また発病しやすい状態である
- 医療従事者の手や医療器具を介して感染を広げる可能性がある
- 風呂や空調など院内の環境が感染を広げる可能性がある
- 抗菌薬の使用により耐性菌が出現しやすい環境である
公益社団法人 全日本病院協会ウェブサイト「みんなの医療ガイド 医療安全推進」ページより編集部作成
医療機関での院内感染対策のための体制
医療法の規定に基づき、医療機関は安全管理の体制を確保しなければなりません。そして、安全管理の体制の確保にあたって講じなければならない措置のひとつに、院内感染対策のための体制確保があります。
具体的には、①院内感染対策のための指針の策定、②院内感染対策のための委員会の開催、③従業者に対する院内感染対策のための研修の実施、④感染症の発生状況の報告その他の院内感染対策の推進を目的とした改善のための方策の実施、です。このため、すべての医療機関で、院内感染対策のための指針を策定していることになります。
医療法施行規則に規定される院内感染対策のための体制の確保に係る措置
- 院内感染対策のための指針の策定
- 院内感染対策のための委員会の開催
- 従業者に対する院内感染対策のための研修の実施
- 当該病院等における感染症の発生状況の報告その他の院内感染対策の推進を目的とした改善のための方策の実施
医療法施行規則 より編集部作成
院内感染対策は、個々の医療従事者ごとの判断に委ねるのではなく、医療機関全体で取り組むことが必要です。そのため厚生労働省は、院内感染対策の体制のひとつとして、病床規模の大きい病院(目安として病床が300床以上)には感染制御チーム(ICT:Infection Control Team)を設置し、定期的な病棟ラウンドや院内の抗菌薬使用状況の把握などを行うよう求めています。
感染制御チーム Infection Control Team (ICT)
医政地発1219第1号(別記)「医療機関における院内感染対策に関する留意事項」より(赤字:編集部)
- 病床規模の大きい医療機関(目安として病床が300床以上)においては、医師、看護師薬剤師及び検査技師からなる感染制御チームを設置し、定期的に病棟ラウンド(感染制御チームによって医療機関内全体をくまなく、又は必要な部署を巡回し、必要に応じてそれぞれの部署に対して指導・介入等を行うことをいう。)を行うこと。(略)
- 感染制御チームは、医療機関内の抗菌薬の使用状況を把握し、必要に応じて指導・介入を行うこと。
院内感染対策の体制を確保していることは診療報酬で評価されます。
入院基本料に加算できる点数として、「感染防止対策加算」があります。この加算を算定するには、感染防止対策の部門の設置と、感染制御チームの設置が必要であり、下記の業務、たとえば院内感染事例の把握などを行っている必要があります。
「感染防止対策加算」算定要件として感染制御チームに求められる業務
- 1週間に1回程度の病棟ラウンド
- 院内感染事例の把握、院内感染防止対策の実施状況の把握・指導
- 院内感染事例、院内感染の発生率に関するサーベイランス等の情報分析、評価
- 病棟ラウンド、院内感染に関する情報の記録
- 抗菌薬の適正使用推進
- 抗MRSA薬及び広域抗菌薬等の使用に際して届出制又は許可制をとり、投与量、投与期間の把握、投与方法の適正化
- 院内感染対策を目的とした職員研修
- 院内感染に関するマニュアル作成、職員の遵守確認
保医発0305第1号別添1「医科診療報酬点数表に関する事項」 より編集部作成
さらに、抗菌薬適正使用支援チーム(AST:Antimicrobial Stewardship Team)を設置し、院内で使用可能な抗菌薬の見直しなど規定の業務を行っている場合は、「抗菌薬適正使用支援加算」も算定することができます。
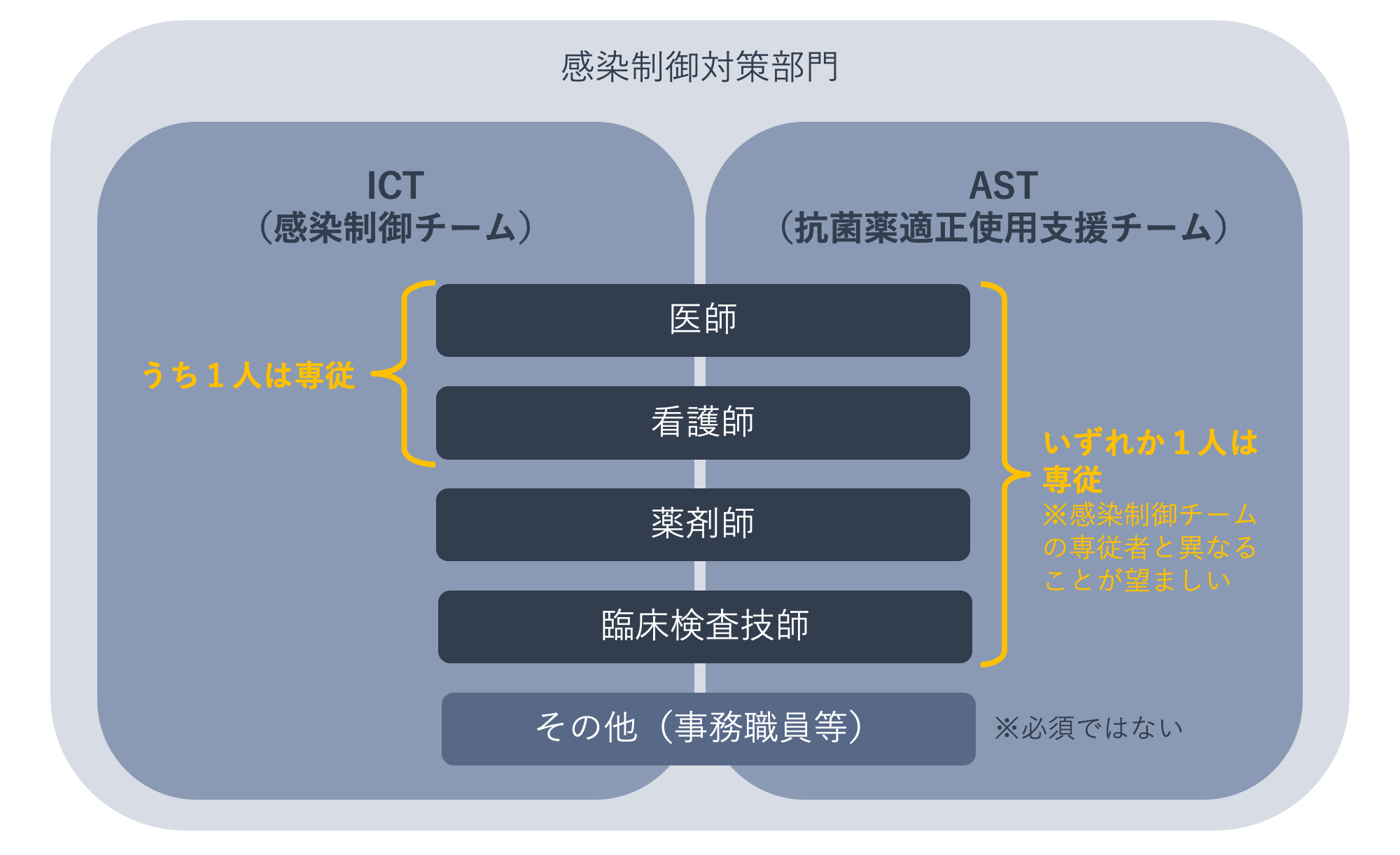
下の図は、感染制御チームと抗菌薬適正使用支援チームの構成メンバーを示したものです。構成メンバーは両チームを兼任できますが、感染制御チームの医師または看護師のうち1名は専従であること、抗菌薬適正使用支援チームのいずれか1名は専従であること、専従者は両チームで異なることが望ましいとされています。
院内感染対策サーベイランス(JANIS)
院内感染の早期探知と適切な対応推進を目的に、2000年から「院内感染対策サーベイランス(JANIS)事業」が開始されました。
本サーベイランスは、検査部門、全入院患者部門、手術部位感染(SSI)部門、集中治療室(ICU)部門、新生児集中治療室(NICU)部門から構成されており、医療機関はそれぞれの目的に応じて参加部門を選択します。たとえば、全入院患者部門は、全入院患者を対象とし、主要な薬剤耐性菌による感染症の発生状況を明らかにするものです。対象とする薬剤耐性菌はこちらです。
JANIS全入院患者部門での調査対象薬剤耐性菌
- メチシリン耐性黄色ブドウ球菌(MRSA)
- バンコマイシン耐性腸球菌(VRE)
- 多剤耐性緑膿菌(MDRP)
- ペニシリン耐性肺炎球菌(PRSP)
- バンコマイシン耐性黄色ブドウ球菌(VRSA)
- 多剤耐性アシネトバクター属(MDRA)
- カルバペネム耐性腸内細菌科細菌(CRE)
「院内感染対策サーベイランス実施マニュアルVer.8.0」 より作成
【参考】参加医療機関数:2021年1月時点において、全国参加医療機関数は2,418施設。
2020年報告によると、集計対象医療機関923施設において、対象とする薬剤耐性菌による新規感染症発症患者数の合計は16,600人でしたが、そのほとんどがメチシリン耐性黄色ブドウ球菌(MRSA)感染症でした。
このように、参加する医療機関での院内感染の発生状況や薬剤耐性菌の分離状況、薬剤耐性菌による感染症の発生状況を調査することで、国内の院内感染の状況を把握し、院内感染対策に有用な情報を医療現場へ還元することが、院内感染対策サーベイランスの目的です。
薬剤耐性率と抗菌薬使用の現状
ここからは、日本のヒト・医療分野での薬剤耐性の現状と、抗菌薬使用の現状についてみていきます。
薬剤耐性菌の脅威
有名な「オニールレポート」では、2013年時点で全世界の薬剤耐性菌に起因する死亡者数は年間70万人にのぼり、このまま何も対策しなければ2050年には1,000万人を超えると報告されました。
日本でも、メチシリン耐性黄色ブドウ球菌(MRSA)と