- 編集部からのコメント
-
この記事は『Medical Education for MR 2017冬号』に掲載されたものを再掲したものです。
最適使用推進ガイドラインが本格運用開始されたのは2017年9月からですが、この教材は、当ガイドラインが作成されることとなった背景や概要など普遍的な内容を解説しているため、現在も研修のテーマとして参考にしていただけると思います。
記事のなかで予想したとおり、当ガイドラインの策定対象医薬品は拡大し、2021年9月末時点での策定済みガイドラインは、14製剤38件まで拡大しています。
【参照】PMDAウェブサイト「最適使用推進ガイドライン(医薬品)」
最適使用推進ガイドライン誕生の背景
診療ガイドラインとの違い
2017年2月、厚生労働省から抗体医薬品(オプジーボ・キイトルーダ)の最適使用推進ガイドライン(以下、最適使用推進GL)が出されました。
最適使用推進GLは、医薬品使用に関するガイドラインではありますが、学会を中心に作成される診療ガイドライン(以下、診療GL)とは違い、患者の主訴や症状に合わせたスタンダード(標準的な治療)やエビデンスを提供するものではありません。
一般的に診療GLは、最新の知見から標準治療や推奨度に関する情報を医療の現場に届け、診療の質を保つためのものです。患者と医療者を支援する目的で作成されており、臨床現場で医療者が意思決定する際に判断材料のひとつとして利用されます。
対して、最適使用推進GLは「革新的医薬品を真に必要な患者に提供するため」に行政の視点から作成されたもので、対象医薬品の保険適用上の使い方を示すものと理解すべきです。基本的には診療報酬算定に付される施設要件や算定要件と同じ性格であると言えます。
革新的医薬品の使用の最適化推進
最適使用推進GLは、「骨太の方針2016」に「革新的医薬品の使用の最適化推進」が掲げられたことを受け、作成に向けた議論がスタートしました。
骨太の方針2016に盛り込まれた医薬品に関する施策はいずれも、医薬品適正使用や薬価制度改革と連動します。つまり、医療費適正化をねらいのひとつとしたものです。
近年登場した画期的C型肝炎治療薬や新規作用機序の抗がん剤等、革新的医薬品の薬剤費は医療財政の破綻を招きかねないとして、高額な薬剤への対応は国の急務となっています。
最適使用推進GLの誕生も、高額な薬剤への対応のひとつなのです。
高額薬剤議論のひきがねとなったオプジーボ
新規の作用機序を有するとして2014年9月に原価計算方式で薬価収載されたオプジーボ(ニボルマブ)は、収載時の適応は「根治切除不能な悪性黒色腫」であり、予測投与患者数470人、ピーク時予測販売金額31億円と想定されていました。しかし、2015年12月に年間数万人規模で患者が存在する非小細胞肺癌(NSCLC)で効能追加承認を得ると、風当たりが急に強くなりました。
特に2016年4月の財務省・財政制度等審議会財政制度分科会での、NSCLCに同剤を処方した際の年間薬剤費が1兆7,500億円にのぼるという肺がん専門医による試算公表は大きなインパクトをもたらし、中央社会保険医療協議会(以下、中医協)で高額な薬剤への対応策の検討が本格化しました。
まずはオプジーボ対応から
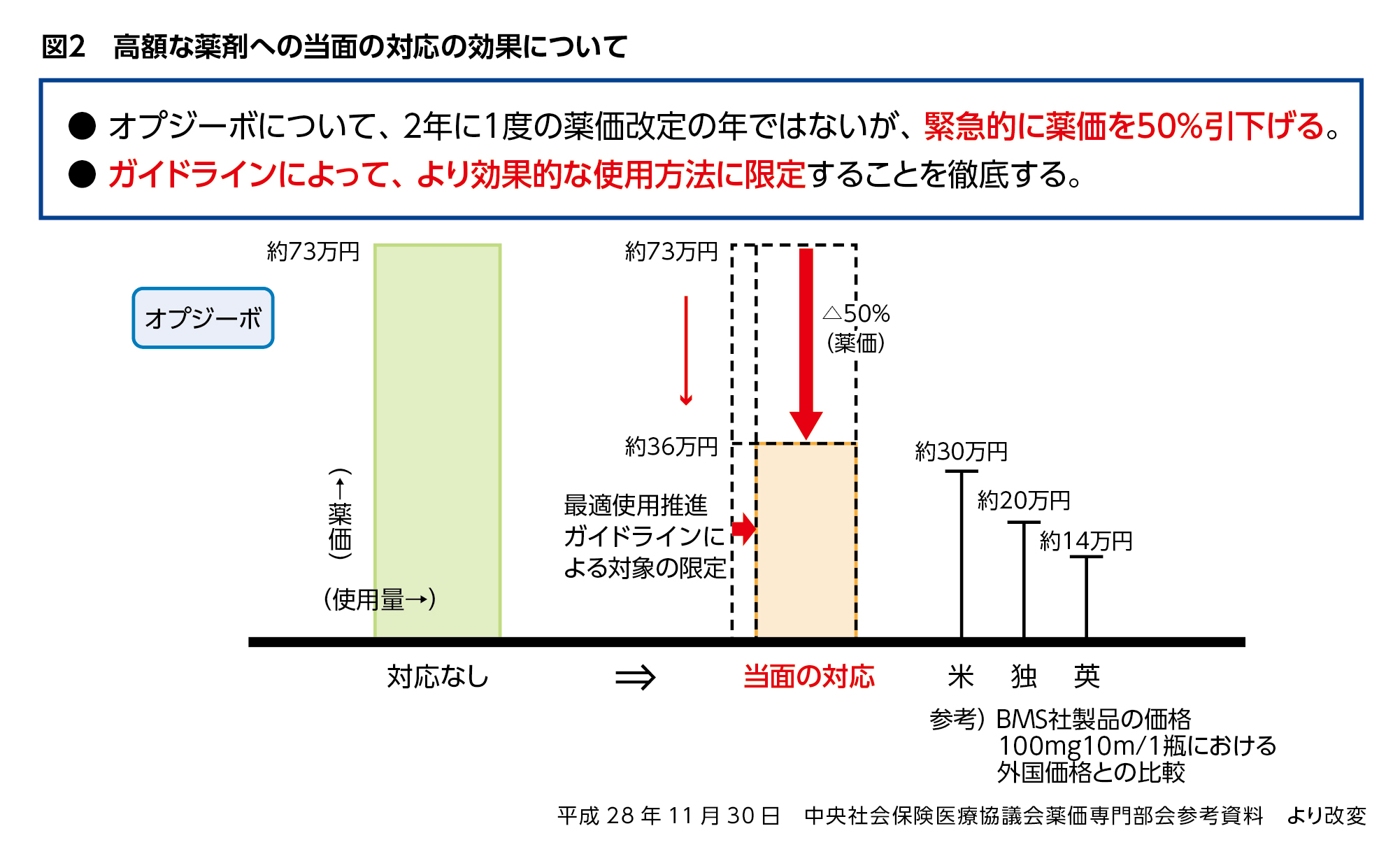
中医協における高額な薬剤への対応についての議論は、薬価制度の見直しを含めた次期薬価改定での対応と、当面の対応に分けて進められることになり(図1)、まず実施に移されたのがオプジーボの緊急薬価引き下げでした。
通常は、薬価調査で得た市場実勢価格との乖離を2年に1度の薬価改定で調整します。年間販売額が予想販売額を一定倍数超えた薬剤に対する市場拡大再算定や、予想販売額がさらに大きくなった薬剤に対する市場拡大再算定の特例ルールなどの既存のルールはありますが、2018年の次期薬価改定のタイミングまで待てないとして、市場拡大再算定の特例ルールの最大値である50%の薬価引き下げが決定し、2017年2月1日から適用されました。
最適使用推進ガイドラインの概要
「試行的」なガイドライン策定
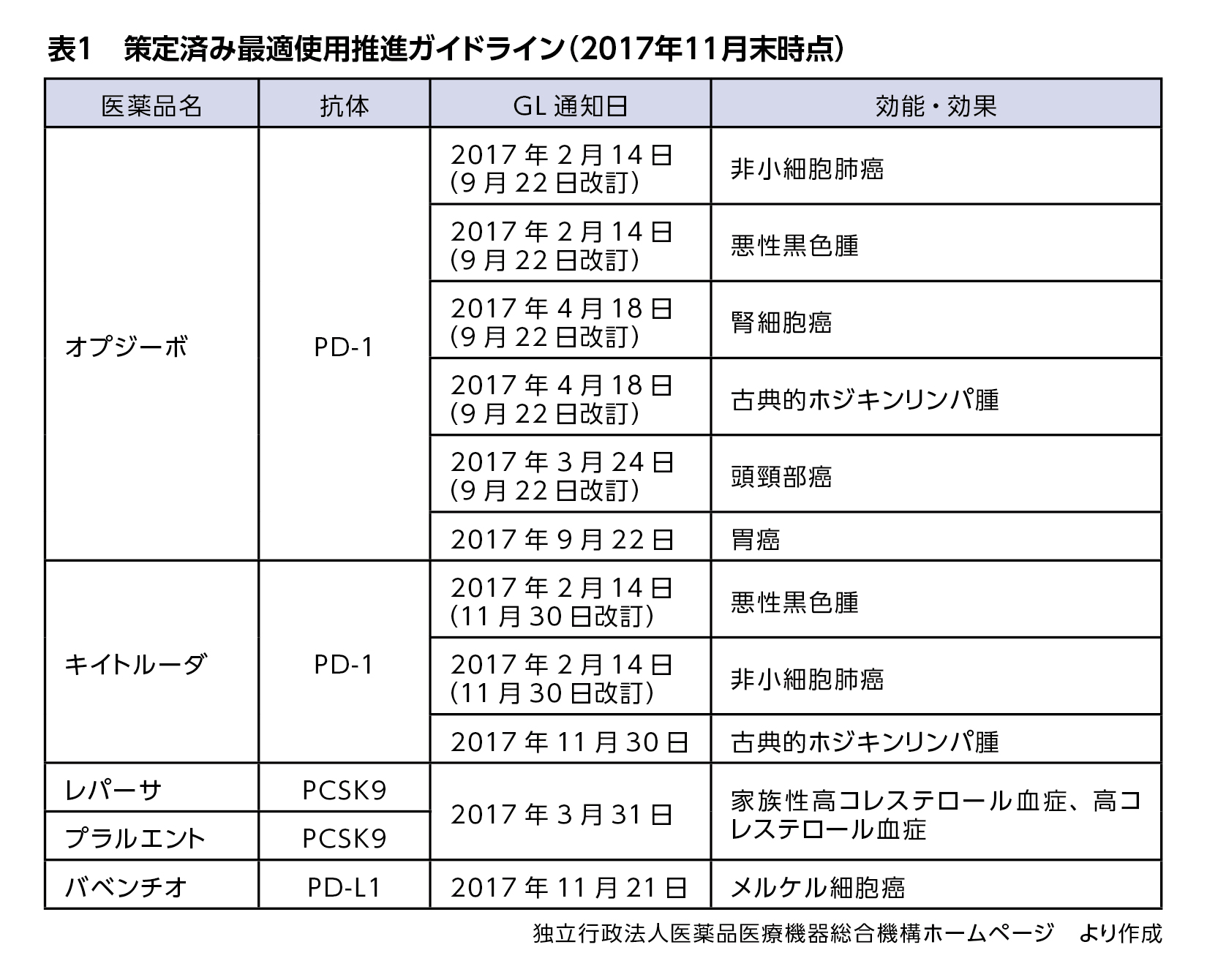
2016年度はまず試行的に、新規作用機序医薬品およびその類薬がガイドライン策定対象医薬品とされ、抗PD-1抗体製剤オプジーボとその類薬、抗PCSK9抗体製剤レパーサとその類薬についてガイドラインが策定されることになりました。
作用機序に差があるものの、オプジーボの類薬として承認された抗PD-L1抗体製剤バベンチオもガイドライン策定対象となり、2017年11月21日にガイドラインが通知されました。
2017年11月末時点で、5製剤12件のガイドラインが出されています(表1)。
最適使用推進GLの構成
- はじめに
ガイドライン作成協力学会等 - 本剤の特徴、作用機序
使用にあたり理解すべき特徴と作用機序 - 臨床成績
主な臨床試験における有効性・安全性に関連する臨床成績 - 施設について
投与が最適な患者の診断・特定、医療機関の要件(施設要件・医師要件) - 投与対象となる患者
安全性・有効性の観点から最適使用と考えられる患者 - 投与に際して留意すべき事項
特徴的な副作用や有効性の評価に関する事項
最適使用推進GLは、作成時点までに得られている医学薬学的・科学的見地に基づき必要な要件や留意事項を示すこととされ、このような構成になっています。
これは、革新的医薬品を有効かつ安全に使用するためには、有効性および安全性に関する情報が十分蓄積するまでの間、当該医薬品の恩恵を強く受けることが期待される患者に対して使用するとともに、副作用が発現した際に必要な対応をとることが可能な一定の要件を満たす医療機関で使用することが重要であるとの考えに基づきます。
「保険適用上の留意事項」との関係
最適使用推進GL策定の通知は医薬・生活衛生局医薬品審査管理課から発出されますが、それと同時に、保険局医療課から保険適用上の留意事項が通知されます。これはつまり、医薬品の使用ガイドラインと保険適用上の使い方とが連携することを意味します。
ガイドラインの「4.施設について」には、当該医薬品の使用にあたっての施設要件と医師要件が定められていますが、留意事項通知にも、ガイドラインをそのまま引用するのではなく、ガイドラインの実効性の確保や経済性の観点から、医療保険制度上必要な施設要件および医師要件が記載されます。
例えば、抗PD-1抗体製剤を投与する場合に求められる施設要件として、
- がん診療連携拠点病院(都道府県・地域)、地域がん診療病院など
- 特定機能病院
- 都道府県知事が指定するがん診療連携病院
- 外来化学療法室を設置し、外来化学療法加算1または2の施設基準届出施設
- 抗悪性腫瘍剤処方管理加算の施設基準届出施設
のいずれかに該当していなければなりません。
ガイドライン対象医薬品を治療に用いる場合は、保険適用上の留意事項通知に従い、該当する施設要件および医師要件を診療報酬明細書(レセプト)の摘要欄に記載する必要があります。たとえ添付文書通りの処方であっても、ガイドラインを遵守しなければレセプト査定される可能性がありますし、留意事項での欠格要件がある場合も同様です。
ガイドラインも薬剤料を抑える手段
最適使用推進GLは、革新的医薬品を有効かつ安全に使用するため策定されるものではありますが、図1に示したように高額な薬剤への当面の対応のひとつにも位置づけられています。
オプジーボに見られるように薬価を下げて薬剤料を抑えることに加え、ガイドラインおよび保険適用上の留意事項の通知により投与対象を限定することで、高額な薬剤の処方を適正に抑制し、使用量を抑える効果があると考えられます(図2)。
最適使用推進ガイドラインと製薬企業
最適使用推進GLの本格始動
2017年9月15日、厚生労働省は通知「最適使用推進ガイドラインの取扱いについて」を発出しました。
これまでの試行的策定の経緯を踏まえ、あらためてガイドラインの取扱いのルールが示され、通知日以降に申請された医薬品がこの取扱いの対象となります。
この通知では、あらためてガイドライン作成の趣旨、対象となる医薬品を選定する手順、ガイドラインの作成手続、ガイドラインの改訂などが示されました。
ガイドラインの対象医薬品は、「有効性及び安全性に関する情報が十分蓄積されるまでの間、有効性・安全性の観点から、投与が適切と考えられる患者の要件及び当該医薬品を使用する上で必要な医療機関の要件等を定めることが適切であると考えられる医薬品」とされ、具体的な基準は以下のとおりです。
今後の具体的なガイドライン策定対象医薬品は未定ですが、対象医薬品が拡大するものと思われます。
- 対象疾患において使用可能な既存の医薬品と異なる作用機序を有する
(投与対象となる患者数が非常に多く、多施設で使用される可能性が高い医薬品に限る)
・薬理作用が大きく異なる
・安全性のプロファイルが大きく異なり、使用の上で特別な注意が必要
・有効性が著しく高い
・臨床的位置付けが異なり、より広い患者に使用される可能性が高い
・他の疾患を対象とした開発(効能又は効果の追加)等による使用患者の拡大の可能性
- 既にGLの対象となっている医薬品と同様の作用機序を有する医薬品
- ①又は②により既にGLの対象となっている医薬品であって、効能または効果の追加を行うもの
ガイドライン策定のタイミング
最適使用推進GLは、承認審査と並行して策定作業が進められます(図3)。
製薬企業(申請者)は医薬品の承認申請(一部変更承認を含む)に先立ち、厚生労働省医薬・生活衛生局審査管理課へ事前相談することになります。
ガイドライン対象医薬品と判断された場合は、素案や検討に必要な参考情報を提出する等、製薬企業はガイドラインの策定にあたり協力する義務があります。
GLに盛り込まれた製薬企業からの情報提供
抗PCSK9抗体製剤の最適使用推進GLの「4.施設について」および「6.投与に際して留意すべき事項」には、製薬企業から提供される情報、特にRMP(医薬品リスク管理計画)についての記載があります(図4)。
RMPは作成時点で考え得るリスクとその安全対策がまとめられた非常に重要な情報資材ですが、情報量が多いことを理由のひとつに、その活用はまだ浸透していないのが実態です。
しかし最適使用推進GLにRMPが明記されたことで、医療機関でその重要性が改めて認識されるでしょう。重要性を認識しつつも、多忙な業務のなかでボリュームのある文章すべてに目を通すのは難しいというジレンマを抱える医療機関にとっては、MRによる効率的な情報提供は大きな助けとなるはずです。
MRによる情報提供は添付文書が中心ですが、企業から発信される医薬品情報であるインタビューフォームやRMPそして最適使用推進GLは、それぞれが連携し補完しあって安全性情報が構築されていると理解しましょう。
薬価制度の抜本的見直しへ
高額な薬剤への対応を議論するなかで試行的にスタートした最適使用推進GLにより、医薬品の適正使用の推進を図ると同時に、医薬品使用に係る保険給付の適正化を強化する方向が見えてきました。
先述したとおり、オプジーボの緊急薬価引き下げも最適使用推進GL策定も、高額な薬剤への当面の対応にすぎません。本丸は、薬価制度の抜本的な見直しです。
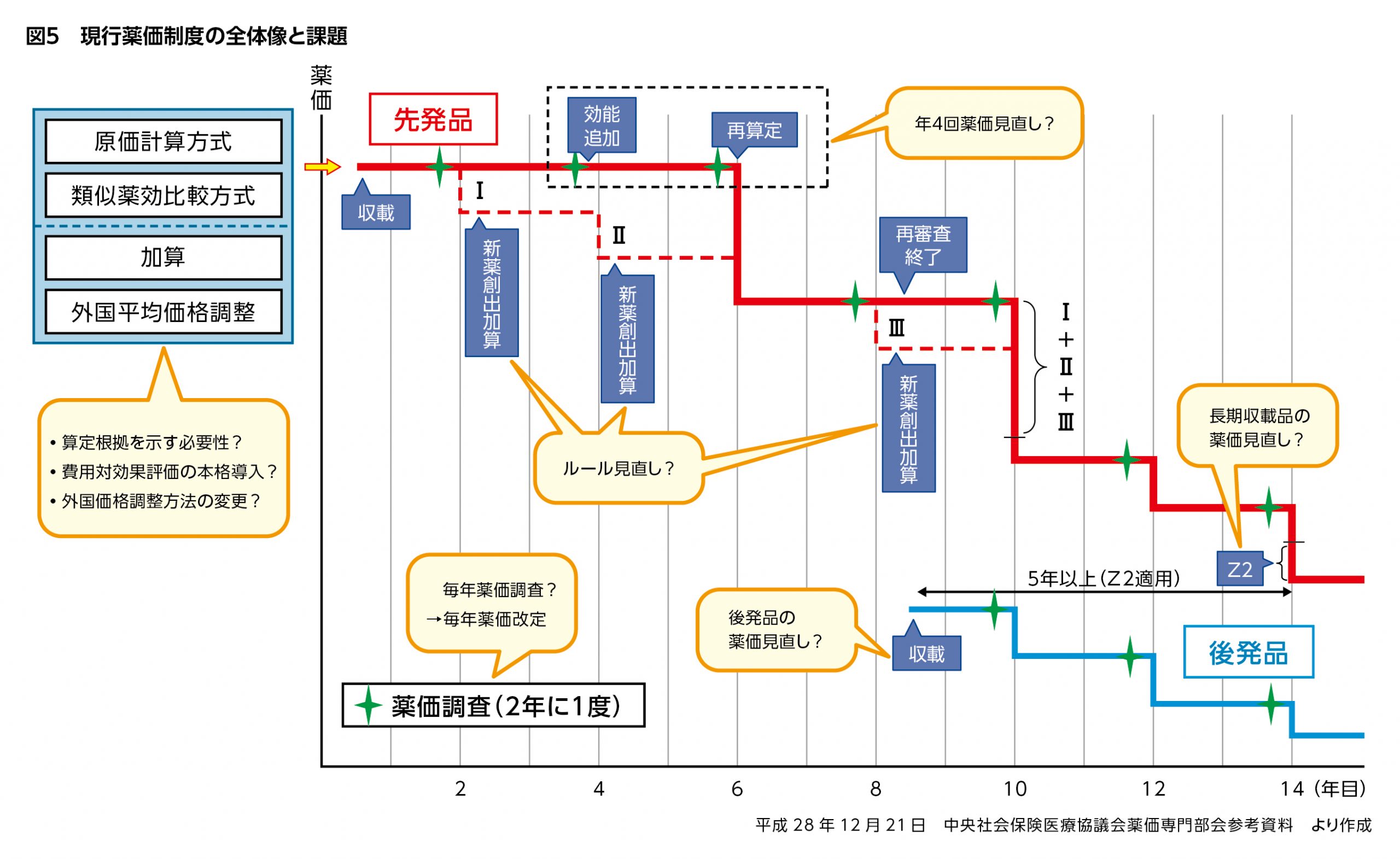
2018年度薬価改定を目前に、中医協における議論は、現行薬価制度の課題(図5)に対する方策の決定に差し掛かろうとしています。
オプジーボの薬価引き下げは当初、緊急的な対応とされていましたが、薬価制度改革に向けた議論の中で、適応拡大で対象患者が大幅に増えた新薬については今後、状況の変化に応じた薬価引き下げを導入する方針が掲げられ、新薬収載のタイミングを活用した年4回の薬価見直しも検討されています。
現行薬価制度が抜本的に見直され、また「費用対効果評価」も新たな薬価算定の仕組みとして本格導入へ踏み出す2018年度薬価制度改革は、これまでにない大改革になると考えられます。
参考資料
- 内閣府「経済財政運営と改革の基本方針2016~600兆円経済への道筋~」(2016年6月2日)
- 財政制度等審議会財政制度分科会資料(2016年4月4日)
- 第117回・第121回・第123回中央社会保険医療協議会薬価専門部会資料(2016年8月24日)
- 独立行政法人医薬品医療機器総合機構ホームページ(2017年11月アクセス)
- 厚生労働省 医薬品・医療機器等安全性情報No.342(2017年4月18日)
- 厚生労働省 各種最適使用推進ガイドライン(2017年2月~11月)
- 保医発0214第4号 厚生労働省保険局医療課長通知(2017年2月14日)
- 薬生薬審発0915第1号・保医発0915第1号 厚生労働省医薬・生活衛生局医薬品審査管理課長・保険局医療課長通知(2017年9月15日)