臨床検査値と副作用
MRが、医師・薬剤師を訪問して添付文書に記載された以上の情報を提供することは簡単ではありません。そこにMR独自の解釈を加味すればプロモーションコードに抵触するおそれがあります。
臨床検査値に関する項目も同様です。MRが提供できる情報には制限がありますが、医療現場で臨床検査値がどのように扱われているかを知ることは、医薬品適正使用のための情報提供・収集というMR業務の本分を果たすには欠かせません。
今回は、医療の現場における臨床検査値の捉え方と、MRにとって手薄となりがちな臨床検査値に関する情報提供・収集の強化策について、日本医科大学武蔵小杉病院薬剤部長・笠原英城先生にご寄稿いただきました。
臨床検査値はどう使う
医薬品投与時の臨床検査値は副作用の早期発見に役立つため、添付文書に定期的な血液検査の必要性が記載されている薬は少なくありません。
臨床検査値の意味合いは大きく2つにわけられます。
1つ目は、用量を設定するための検査です。腎機能や肝機能、血球等の検査を行い、患者さんの状態に応じて至適用量を決定するものです。
2つ目は、副作用の未然回避や遷延化防止のための検査です。たとえば、スタチン系薬剤であれば横紋筋融解症のリスクがあるためCPKを、甘草を含んでいる漢方薬であれば血清Kの変動をみることはよくあることです。
MRは医療従事者に情報提供する場において、検査値がどのように扱われているかを知ることが肝要です。
検査値異常は副作用か?
添付文書の「副作用」の項は、一定のルールに従って記載されています。
臨床試験や海外の規制情報(添付文書等)・自発報告がその根拠になることが多いですが、当然、国内の市販後調査を受け、追記されるものも多くあります。
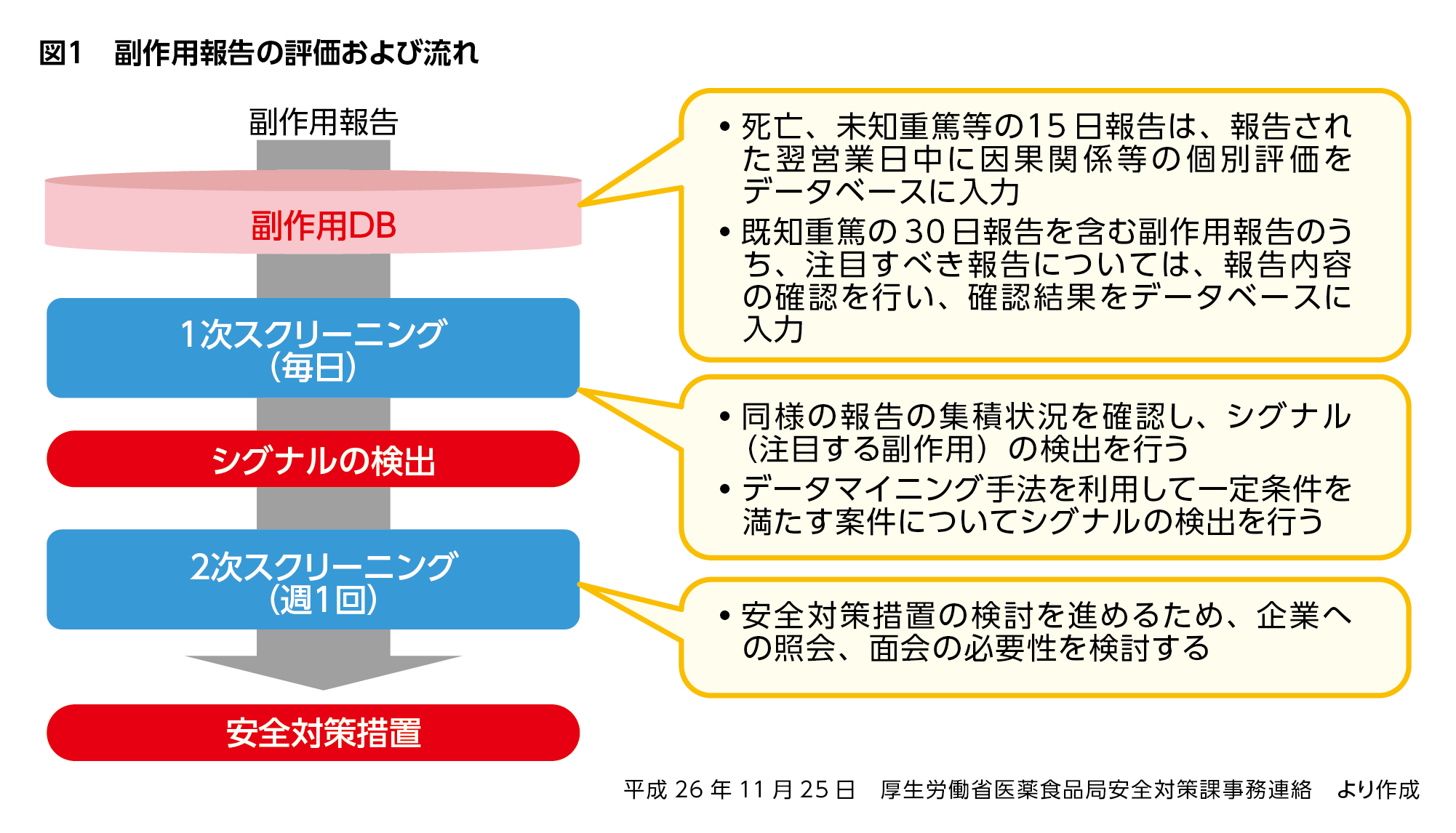
厚生労働省(PMDA)は、2009年度からデータマイニング手法(シグナル検出手法)を導入し、新たな安全対策業務が開始されました。副作用情報は図1に示したフローに基づき分析・評価され、添付文書に反映するか否か判断されます。
当然、そこには分析・評価の対象となるMRや医療職、患者自身からの自発報告が必要となります。報告対象となる情報は、未知のものは当然のこと、既知・因果関係不明のものも含まれます。
検査値は正常範囲が決められているため、その逸脱程度によっては副作用とみなされない場合も多く、判断は複合的となる場合が多いです。
MRは医師から「患者さんの検査値に気になることがあるんだけど」と質問を受けることがあるでしょう。添付文書記載事項であれば当然副作用の可能性があるので、他処方薬との関連性も踏まえて情報提供を迅速に行います。添付文書に記載がない検査値であっても、自発報告や海外添付文書(PDRで閲覧可能)を確認して情報提供すると、「よく知っているね」と評価されること間違いなしです。
臨床検査値と医療の現場
検査が必要な医薬品に対する課題
抗血小板剤の塩酸チクロピジン(チクロピジン塩酸塩)製剤は、血栓性血小板減少性紫斑病(TTP)、無顆粒球症、重篤な肝障害等の重大な副作用が報告されたことから、2002年にイエローレター(緊急安全性情報)が発出されました。
これを踏まえ現在の添付文書の「警告」欄には、投与開始後2ヵ月間は、原則として2週に1回血球算定と肝機能検査を行うこと、定期的に血液検査を行い副作用の発現に注意すること、と記載されています。
しかし、イエローレター、ブルーレター(安全性速報)が発出された際には院内に周知されるものの、当該事例のように15年も前の情報になると、それが遵守されているかをチェックするのは至難の業です。
また、「定期的」がどれくらいの頻度(間隔)か定められていないため、医療機関によって対応がバラつくという問題もあります。
「定期的な検査が必要な医薬品」=「ハイリスク薬」
2007年4月より、病院・診療所・歯科診療所・助産所の管理者および薬局開設者に、医薬品・医療機器の安全使用、管理体制の整備を目的とする「医薬品の安全使用のための業務手順書」(以下、手順書)の作成が義務づけられています。
手順書の作成マニュアルには、管理上だけでなく使用に際しても注意が必要と考えられる医薬品として「特に安全管理が必要な医薬品」が挙げられ(表1)、その中には「定期的な検査が必要な医薬品」も含まれています。
その後、日本薬剤師会、日本病院薬剤師会それぞれで作成された業務ガイドラインにおいて、手順書作成マニュアルの「特に安全管理が必要な医薬品」は「ハイリスク薬」として定義されました。
ハイリスク薬は医療機関の規模・機能によってさまざまな捉え方があり、一律的な定義は難しいと言えますが、添付文書に定期的な検査が必要と記載している医薬品はハイリスク薬であるという認識が必要です。
医師の処方は必ずしも完璧ではない
医師は専門領域を標榜し、患者は自らの疾患や症状に応じて医療機関を選択します。しかし、複数の疾患をもつ高齢者等は、各専門医ではなくひとつの医療機関を受診していることが多いようです。
こうした状況などで、自身の専門領域ではない医薬品を処方する医師が添付文書記載項目を熟慮していないケースがみられます。
たとえば、専門領域外の医師が抗甲状腺薬や抗血栓薬を処方する場合、添付文書に記載のある「定期的な血液検査」を実施しているか、検証の余地があります。
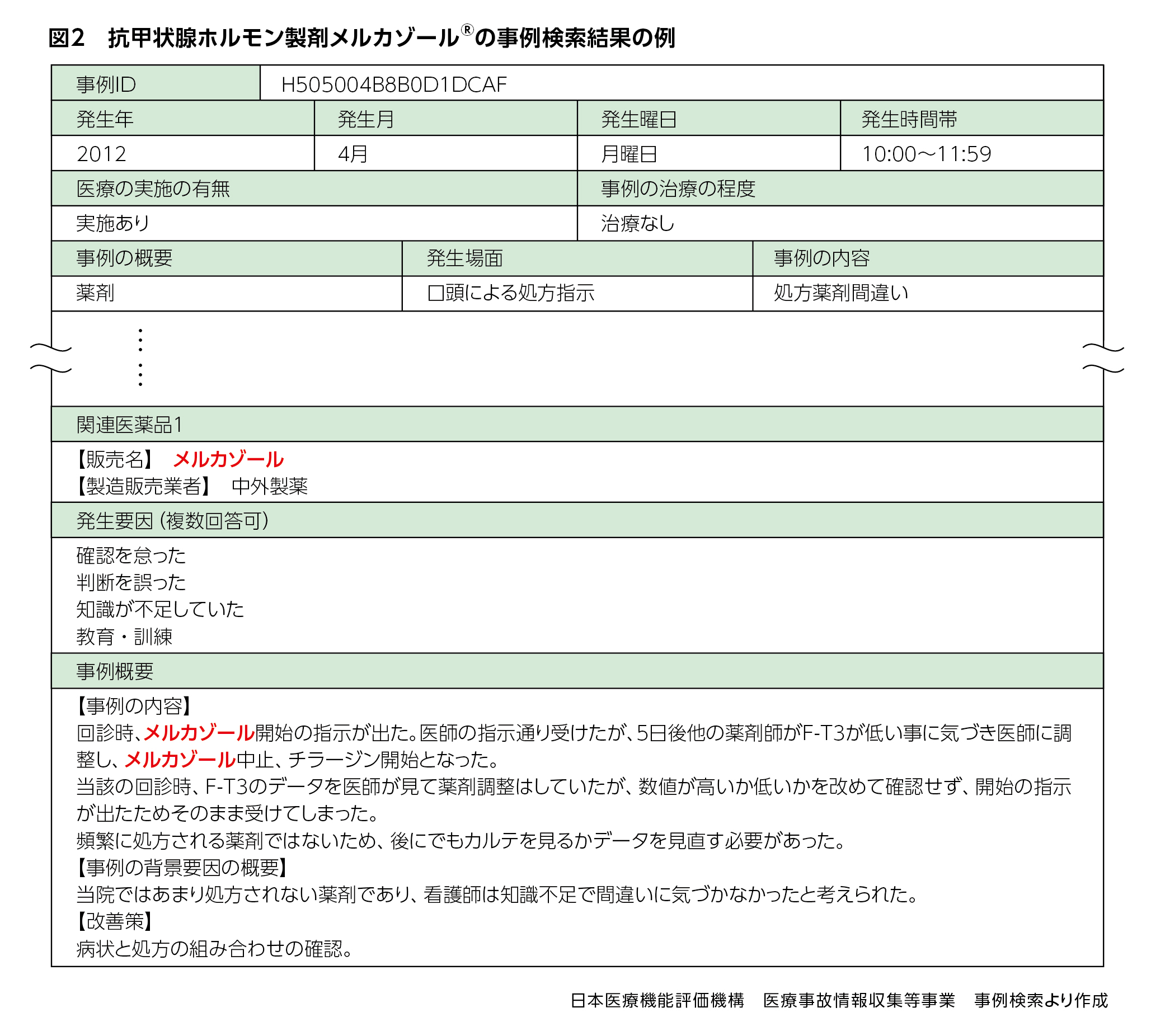
MRが医師に、「この薬剤は定期的な検査が必要ですが実施していらっしゃいますか?」とはなかなか聞きづらいでしょう。しかし、日本医療機能評価機構が提供している医療事故情報の事例検索(図2)等を話題に、「添付文書にこういう記載があります」と情報提供することで、「検査してくださいね」と何気なく注意喚起することができます。
院外処方箋への臨床検査値印字
検査値情報の重要性
近年、薬局薬剤師が処方鑑査を確実に行える体制づくりを目的として、院外処方箋に臨床検査値を記載する医療機関が増えています。
病院薬剤部では入院患者の血液検査情報を容易に把握できますが、薬局では限られた情報しかない中で副作用が生じていないかをチェックしなければなりません。また、必要な情報は患者本人から聞き出さないといけないため、「早く薬をくれ」とトラブルに発展してしまうこともあります。
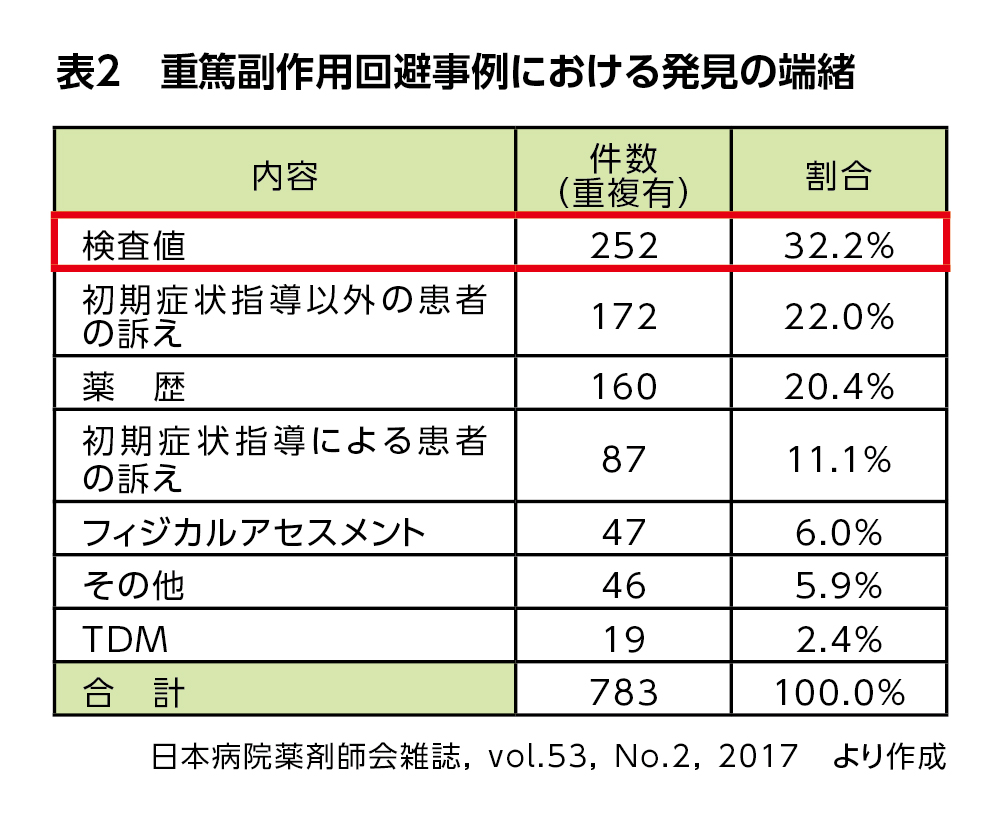
日本病院薬剤師会が行うプレアボイド報告では、重篤副作用回避事例の32.2%が検査値を発端としている(表2)ことからも、薬剤師にとって検査値情報がいかに重要かが推測できます。
大学病院での具体事例
福井大学病院薬剤部は2011年4月から臨床検査値や薬物血中濃度の測定結果を院外処方箋に記載し、薬局へ患者情報の提供を行っています。同薬剤部では、臨床検査値の印字は処方鑑査や患者指導の質的向上に有用なツールと考え、活用促進のため連携する近隣薬局と定期的な会合を開き、継続的な情報共有を図っています。同薬剤部によるアンケート結果では、印字された検査値を患者指導の参考にしている薬局薬剤師は90%以上(n=21)にものぼるそうです。
千葉大学病院薬剤部では、2014年10月以降、地域の薬局との連携の一環として検査値の一部を院外処方箋に記載しています。検査値は、すべての処方箋に共通の「固定検査値」16項目と、添付文書の禁忌・警告欄に検査値に関する記載がある薬剤や腎機能調節が必要な薬剤ごとに印字する「医薬品別検査値」に分けて記載されます。
検査値の印字は疑義照会を深化させる
疑義照会とはまさしく「疑わしい」というスイッチをどこで押すかに集約されます。
医師は専門性が高い医療職であり、スペシャリストであることが多いです。薬剤師は最近でこそ、認定、専門制度が確立されていますが、基本的にはジェネラリストです。整形外科の医師に緑内障の点眼薬の相談をする患者はいないでしょうが、薬剤師にはよくあることです。
臨床検査値も同様で、医師は自らの専門領域の検査値には詳しいですが、専門以外の項目にはさほど注意しないこともあります。
前述のプレアボイド報告によると、薬剤師が重篤副作用を回避した事例の発現部位で最も多かったのは代謝-電解質異常でした。これはK、Ca、Na等の電解質の検査値異常が起こっているのに医師が気付かず、薬剤師が気付いたことで副作用の遷延化を防止できた実例になります。
MRに何ができるのか?
「薬薬連携」の今後の可能性
院外処方箋に検査値を表記する医療機関は増加の一途をたどり、今後、疾病名を表記する施設も出てくるもようです。そこには当然、薬局との連携が必要になってきます。厚生労働省は「病院前の景色を変える」、すなわち門前薬局の地域への移行推進を断言しており、薬薬連携は新たな時代に入ったと言ってよいでしょう。
連携体制がまだじゅうぶんに整っていない地域ではMRの協力を仰ぐ施設も出てくることになります。製薬会社の垣根を越えたMR体制が、将来的には望まれる姿かもしれません。
医師が患者に検査データを渡し、治療経過や副作用がない等の説明を行っていることもあります。患者から「この検査値はどういう意味?」と質問を受けた薬剤師が「今調べます」と答えていては患者からの信頼度が低下するため、薬剤師は検査値に関する知識の習得に必要性を感じています。添付文書の検査値関連の項目についてMRに質問するケースも今後増えてくるでしょう。
イエローレター発出時の医療機関の対応
医薬品安全性情報等のうち、迅速な対応が必要となるものを把握した際に、電子媒体に保存された診療録、薬剤管理指導記録等の活用により、当該医薬品を処方した医師及び投与された患者を速やかに特定でき、必要な措置を迅速に講じることができる体制を有していること。
上記は、2012年度診療報酬改定で新設された病棟薬剤業務実施加算の施設基準のひとつです。これは必要な情報を患者にも伝えることを意味していますが、その方法論は厳密には確立されていません。
電子カルテを採用する施設では患者の特定は容易ですが、そうでない場合、院外薬局の薬歴やレセコン、また、時には納品情報を頼りにMS・MRまで協力を仰ぐ施設もあります。
現在の病院薬剤部DI室では、イエローレター・ブルーレターが発出された際には、処方医だけでなく患者等への周知までおこなうことが少なくありません。院外処方が該当する場合が多いので、MRにも協力を仰ぐ施設もあるでしょう。
PMDA添付文書DBを使いこなす
MRの業務を医療機関側から見てみると、MR とMSL(メディカル・サイエンス・リエゾン)や学術との連携が各社によって異なるため、知りたい情報がすぐに収集しにくいことが問題となっています。
一方、病院薬剤部は製薬会社以外からも情報収集できる環境を整えていますが、薬剤師のスキルによって、情報収集の程度が異なるという問題があります。
現在、最も信頼性が高く、確実な情報として評価できるのはPMDAの添付文書情報です。しかし、その使用方法に習熟している医師・薬剤師はそう多くありません。そこでMRがPMDAのデータベースを使いこなすスキルを身につけることは、DI担当薬剤師との会話にも有用であり、武器になることは間違いありません。
MRが強化すべき情報編集能力
理屈っぽく説明がくどい人を「能書きばかりいう人」と表現します。この「能書き」は「効能書き」、つまり添付文書を意味しており、それほど添付文書はわかりづらいものです。
しかし、すべての医療従事者にとって医薬品の適正使用情報の基本は添付文書であり欠かせない情報であるという認識は共有されています。
医薬品情報の変化は迅速で、添付文書の改訂は頻繁に行われます。MRが日々発信される安全性情報や添付文書の更新情報等、現場が求める情報にいち早くたどり着き、医師・薬剤師に情報提供できるようになりましょう。
また、PMDAをはじめ各種DBの検索方法を覚え使用経験を積むことで、ファクトを集積し、自分なりの編集ができるようになれば、添付文書情報をもとにした複合的な情報提供が可能になるでしょう。
医療の現場で医師や薬剤師等の助けとなる情報提供ができるかどうか、そこに教科書はなく、日々の研鑽と努力、そして経験がすべてなのです。
笠原 英城
日本医科大学武蔵小杉病院 薬剤部長
院内での治験管理事務局長をはじめ、公務では以下の各委員をご担当。
・日本病院薬剤師会 医薬情報委員、プレアボイド報告評価委員長、インタビューフォーム検討委員
・日本薬剤師会 薬価基準検討委員
・厚生労働省 重篤副作用対応マニュアル検討委員
・日本医療機能評価機構 医療事故情報収集事業専門分析班 委員
添付文書「臨床検査結果に及ぼす影響」の項目についての薬剤師アンケート
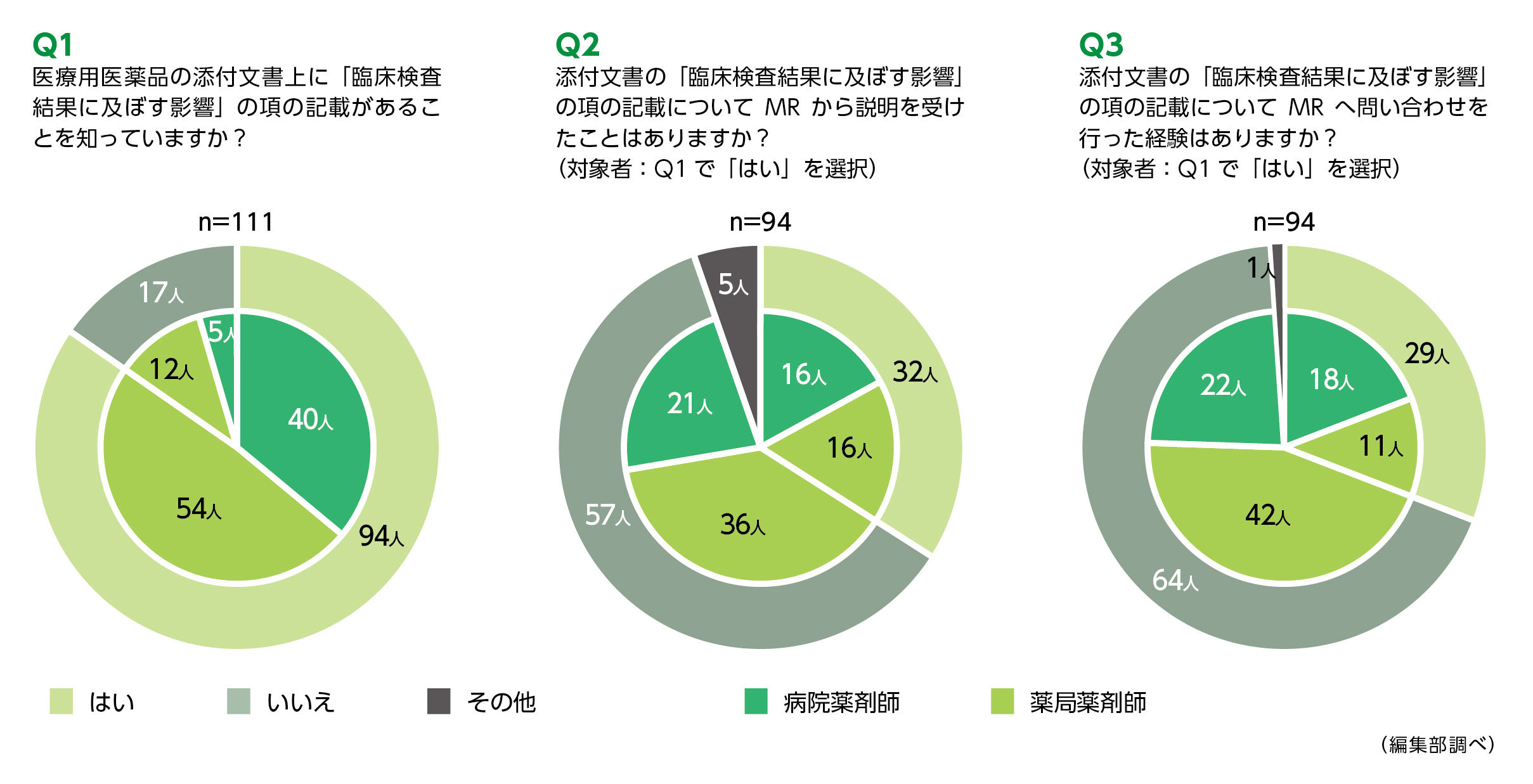
図は薬剤師を対象に編集部が実施したアンケート調査の結果を示したものです。
添付文書に「臨床検査結果に及ぼす影響」の項があることを認識していなかった薬剤師は約15%(17/111)。認識があった薬剤師のうち、60%以上(57/94)が当該項目の記載についてMRから説明を受けたことがなく、約68%(64/94)の方がMRへの問い合わせ経験がないと回答しています。
皆さんはこの数字をどう捉えるでしょうか?
参考資料
- 厚生労働省医薬食品局安全対策課 事務連絡「『医薬品の添付文書改訂業務に至る標準的な作業の流れ』の改訂について」(2014年11月25日)
- PMDA緊急安全性情報「塩酸チクロピジン製剤による重大な副作用の防止について」(2002年7月23日)
- 厚生労働科学研究「『医薬品の安全使用のための業務手順書』作成マニュアル」(2007年3月)
- 日本薬剤師会「薬局におけるハイリスク薬の薬学的管理指導に関する業務ガイドライン」(第2版)(2011年4月15日)
- 日本病院薬剤師会「ハイリスク薬に関する業務ガイドライン」(Ver.2.2)(2016年6月4日)
- 日本医療機能評価機構ホームページ「医療事故情報収集等事業」事例検索(2017年11月アクセス)
- 日本病院薬剤師会「日本病院薬剤師会雑誌,vol.53,No.2,2017」
- 千葉大学医学部附属病院薬剤部ホームページ「保険薬局の皆様へ」(2017年11月アクセス)
- PMDAホームページ「添付文書等検索」(2017年11月アクセス)