- 編集部からのコメント
-
この記事は『Medical Education for MR 2017冬号』に掲載されたものを再掲したものです。
2018年4月1日に施行された臨床研究法に関する情報は、厚生労働省ウェブサイト「臨床研究法について」にまとめられています。
個人情報保護法は2020年6月に一部改正法が公布され2022年4月に全面施行されますが、記事で取りあげた「要配慮個人情報」に関する記述内容に変更はありません。
記事掲載当時から各法整備の状況に変化はありましたが、記事の本筋である臨床研究倫理は普遍的なものであり、現在も倫理教育のテーマとして参考にしていただけます。
臨床研究のいまと臨床研究倫理の誕生
法規制される臨床研究
2017年4月、臨床研究法が公布されました。同法は近年の臨床研究にまつわる不正事案に端を発したもので、これまで倫理指針のみに委ねられていた臨床研究を法規制するものです(図1)。
現在、2018年4月の施行に向けて、同法に基づく臨床研究実施基準等について、厚生科学審議会の臨床研究部会において議論が進められています。
MRの皆さんが医薬品の適正使用情報を提供するために診療の現場に係わる際には、プロモーションコードや透明性ガイドラインといった倫理指針や行動基準を常に意識しなければなりません。
同様に、医学研究の場にもさまざまな規制や倫理指針があります。原則、MRの皆さんが研究の現場にタッチすることはありませんが、診療とは別の「倫理的考え方」があることを理解しておきましょう。
臨床研究倫理の誕生
臨床研究倫理(以下、研究倫理)の議論は、第二次世界大戦中にドイツで行われた非倫理的研究への反省からスタートしました。
そして、戦後のアメリカでのウィローブルック事件や、タスキギー梅毒研究などの臨床研究スキャンダルが明るみに出され、研究倫理確立への契機となりました。
1974年、こうした動きを受け、アメリカでは世界に先駆けて全米研究法が成立し、翌1975年には研究倫理に関する初の連邦レベルの委員会が設置されました。この委員会報告の総論として出されたのが「ベルモント・レポート」です。
このレポートでようやく、研究倫理の基本的な枠組みが示されました。
「研究」と「診療」の区別
ベルモント・レポートの構成
A節 研究と診療の境界
B節 基本的倫理原則
- 人格の尊重
- 善行
- 正義
C節 応用
- インフォームド・コンセント
- リスク・ベネフィット評価
- 被験者の選択
ベルモント・レポートの構成では、基本的倫理原則の前に、「研究と診療の境界」という節を設けています。
研究と診療はどう違うのか、また、両者の境界はどこにあるのでしょうか。
研究の目的と診療の目的
人(試料・情報を含む。)を対象として、傷病の成因(健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を含む。)及び病態の理解並びに傷病の予防方法並びに医療における診断方法及び治療方法の改善又は有効性の検証を通じて、国民の健康の保持増進又は患者の傷病からの回復若しくは生活の質の向上に資する知識を得ることを目的として実施される活動をいう。
「人を対象とする医学系研究に関する倫理指針」より抜粋
研究と診療の基本的な区別の基準は、「目的の違い」です。
上記は日本の医学研究における指針のひとつ「人を対象とする医学系研究に関する倫理指針」(以下、医学系倫理指針)での「研究」の定義です。また、同指針のガイダンスでは、「傷病の予防、診断又は治療を専ら目的とする医療は、この指針でいう『研究』に該当しない」と明示されています。
診療は、目の前の患者のための最善を意図して行われるものです。しかし研究は、あくまでも知識を得ることが目的であり、必ずしも個々の患者のためにベストな治療を提供することを主目的としていません。患者の協力を得て、信頼できる、将来のヘルスケアの改善に役立つ知識をつくるのが目的です。
研究に規制が必要なのは、研究が研究参加者のためだけではなく、社会・人類のために協力してもらうことであり、医療者の裁量権の範囲を超えることも前提としているためです。公共の福祉のために、場合によっては身体的なリスクを負わせ、人体実験的なニュアンスもあることから、倫理指針による管理が必須なのです。
人間関係の違い
医療と研究における人間関係には、「医療者-患者」関係、「研究者-被験者」関係という二面性があります。この2つの関係は、並行して同じ人が、医療者であり研究者である、また患者であり被験者であることがあります。
一般的に患者は自分の身体の異変や痛みを主訴として、その解決を求め受診し、医療者は患者の問題を専門的な知識や技術を使って解決しようとします。
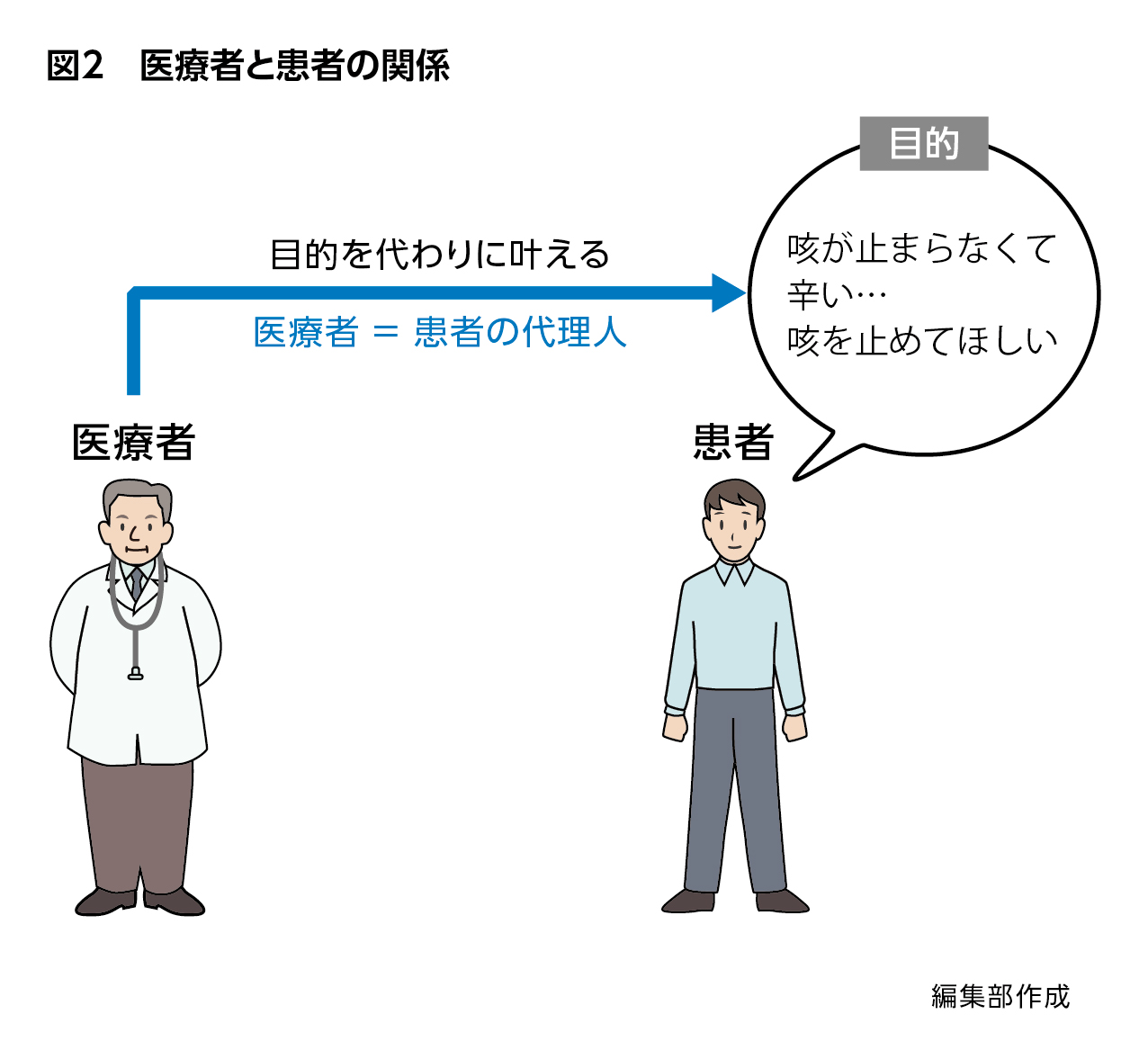
こうした関係から、医療者は「患者の代理人」と呼ばれます。「目的」は患者が持っており、医療者はその目的を代わりに叶えるという意味から「患者の代理人」なのです(図2)。
これに対し、「研究者―被験者」の関係はまったく異なります。
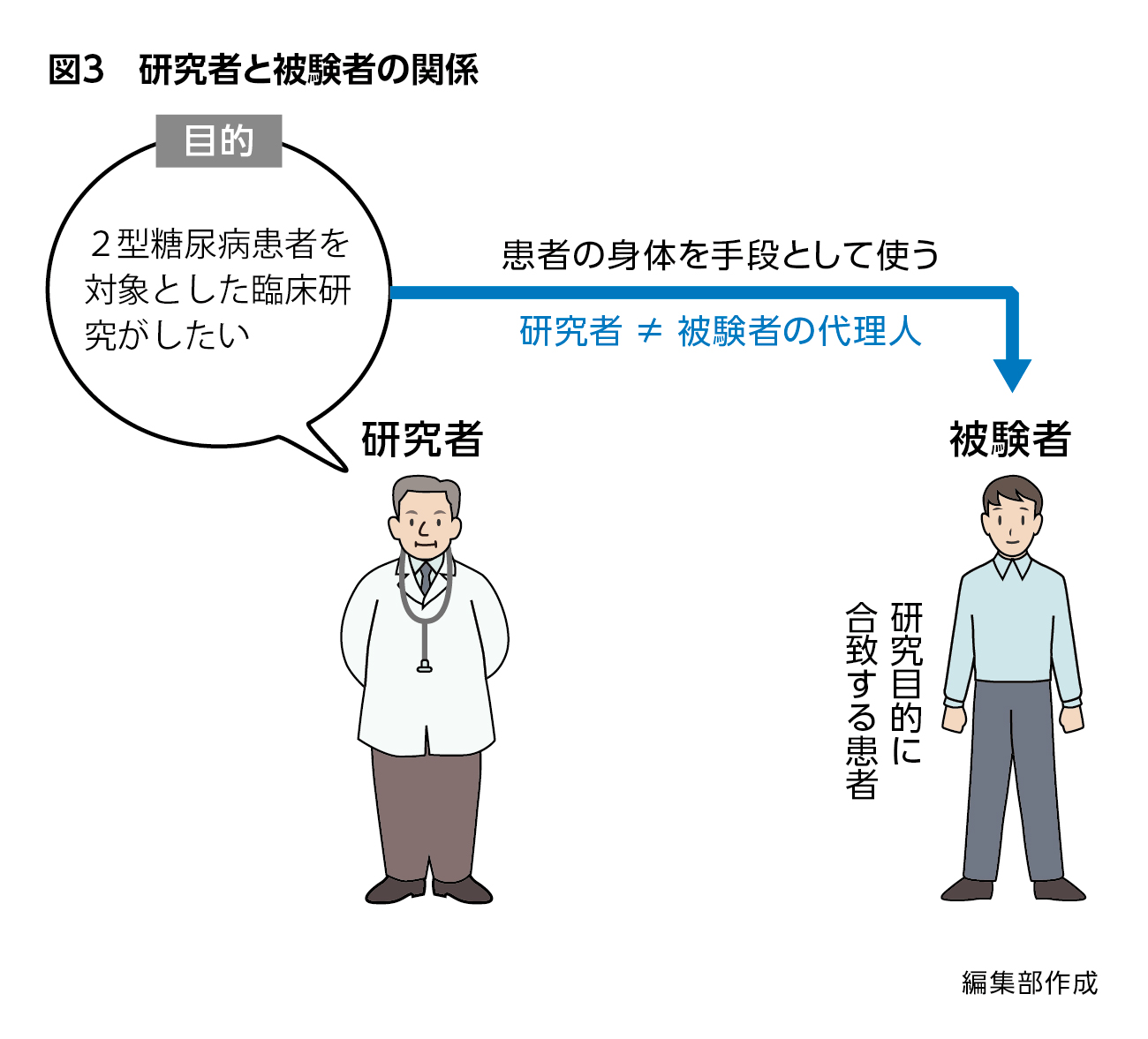
研究者は「被験者の代理人」ではありません。「目的」は研究者が持っており、目の前に研究目的に合致する人(患者)が現れた場合に、研究対象として、その身体を手段として使うということになります(図3)。
それは、常に「搾取」の危険性があるということです。患者自身のためではなく、他の人のために患者の身体の一部が使われてしまう可能性があり、場合によってはリスクを負うこともあり得るのです。
医療の現場では、診療と研究を同じ医師が担当しているケースも多いのが実情です。
現状は、当事者同士の合意で実施できる仕組みではなく、倫理審査委員会という第三者による事前審査が加わります。この審査が必要であることが、「研究」と「診療」との一番の相違点となります。
「研究」と「診療」の区別の難しさ
医学系倫理指針の「研究」の定義から除外される項目には、特定の地域の健康状態を引き上げるための「保健事業」があります。
公衆衛生的な危機に遭遇し、現状の問題点を行政的に、かつ迅速に判断して施策を打つために実施する悉皆調査などが該当し、疫学サーベイランスやがん登録などがこれに近いものです。
しかし、研究と診療の区別は難しいものです。現実には研究活動とその他の実践は混在しています。
例えば、以下の例は研究でしょうか?診療でしょうか?
- 標準治療の存在しないがん患者に対して新しい治療法を試みた
- 経験豊富な外科医が手術手技に関して若干の変更を行い手術を行った
新しい医療行為は、研究でも診療でも行われます。外科系の手技関係は創意工夫から発展する傾向があり、必ずしも研究から新しいことが始められたとは限りません。移植医療などは、最後の救命手段として選択され、症例が蓄積されたものです。検証的研究から標準治療になったものもあります。採血検査や投薬など、処置自体は研究でも診療でも変わらず、外から見ただけではわかりません。
「研究」か「診療」か、その都度ごとに線引きが必要であり、どう区別すれば正当化可能かを考えることが重要です。
インフォームド・コンセントとリスク・ベネフィット評価
インフォームド・コンセント
適切なICに必要な3つの要素
- 情報
- 理解
- 自発性
インフォームド・コンセント(IC)は、相手に同意能力があることを前提に成立します。
適切なICに必要な3つの要素は研究も診療も共通しますが、研究の場合は、情報提供項目のルールが決められています。
例えば医学系倫理指針では、研究対象者等に対し説明すべき事項として21項目が設定され、うち14が必須項目です(図4)。
一方、診療では説明文書の項目についてルールはなく、病院の標準化された説明文書で個別の状況に応じて対応しています。
リスク・ベネフィットをどう評価するか
リスク・ベネフィットについて、医療者は「患者の益になるようにふるまいなさい」という格言を医療倫理の根本原則としています。しかし、研究倫理の利益のコアとなるのは社会的利益(将来世代への利益)です。
一般的な医療では、リスクを負うのも、利益を得るのも患者です。しかし研究の場合は、研究対象者の利益が予想される場合もある一方、利益が確定しない、さらには全く期待できない場合もあり得ます。つまり、リスクとベネフィットは非対称であるということです。
研究対象者自身の身体のためではないのに、研究を正当化できるのは、社会的利益を目指すためのものであることにほかなりません。
研究倫理と「福祉の向上」の議論
2008年改定のGCP省令で第1条に「この省令は、被験者の人権の保護、安全の保持及び福祉の向上を図り、治験の科学的な質及び信頼性を確保するため」という規定が入りました。
通常の医療の提供はwell beingを引き上げるものです。しかし、前提として研究参加はwell beingを引き上げるとはいえないものであり、「福祉の向上」という表現は研究倫理の基本的な考え方と矛盾します。被験者の「福祉の向上」が自明には図れないからこそ、研究をめぐる倫理が論じられる必要があるのです。
臨床研究は、被験者へのベネフィットが未確定のまま、研究目的のために協力してもらうことであり、特別なルールが必要だという発想が必要です。臨床研究法や医学系倫理指針などは、こうした特別なルールということができます。
研究における倫理審査委員会の役割
研究実施の妥当性を倫理面から判断するのが倫理審査委員会です。
研究と診療では、倫理審査委員会の役割や性格が大きく異なります。
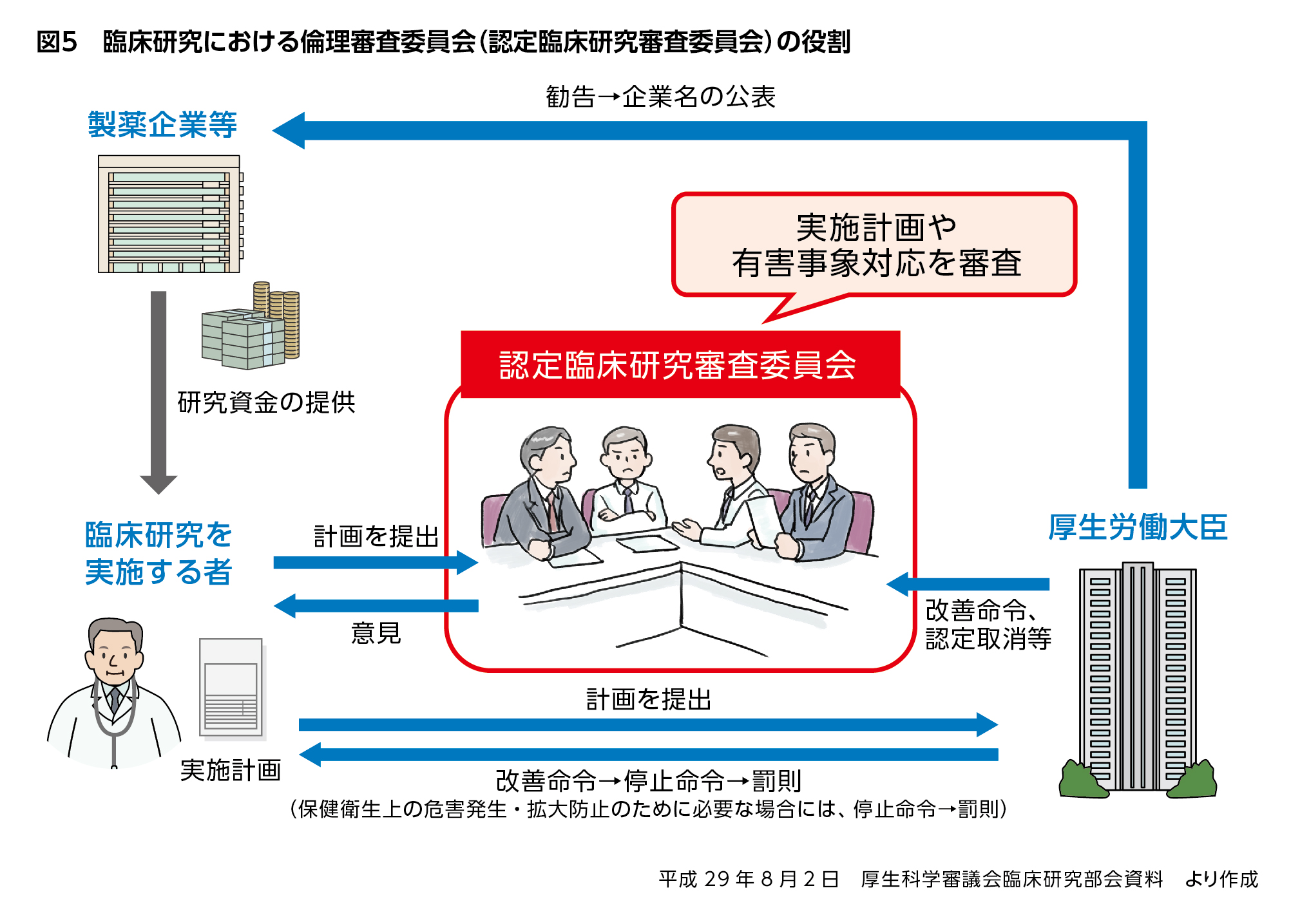
研究では倫理審査委員会の設置が必須であるのに対し、診療に関しては設置が必須とはなっていません。これは、一般診療に関する院内の倫理審査委員会が助言的な役割にとどまる一方、研究における倫理審査委員会は権限をもって「Go」「No Go」を明確に判断(決定)する役割があるからです(図5)。
例えば、一般医療における倫理審査委員会は、特定の患者について担当医や担当部署だけでは判断が難しい人工呼吸器の停止などといった場合に助言します。この倫理審査委員会は院内組織であり、外部委員の参加が望ましいとはいえ内部関係者だけで設置されるのが一般的です。
これに対し、研究における倫理審査委員会は、リスクとベネフィットのバランスを冷静に判断する必要があるため、施設からの独立性・中立性が求められ、より公的に近い性格のものとなります。
PMSと臨床研究倫理
研究にタッチしてはならないMR
MRは、直接研究に関わることはできません。PMS活動の流れの延長線上で関わってしまうことのないように、常に注意が必要です。
例えば、企業が研究費を提供して日常診療のデータを収集するような特定臨床研究のように、研究方法がPMSの調査形式に類似している場合があります。医療者側には、PMS調査の一環であればMRに頼めるものとの感覚がありますが、しっかりと線引きできなければなりません。
MRの皆さんは、安全対策として医薬品医療機器等法(以下、薬機法)の規定に従いやらなければならないことと、自主臨床研究として実施される観察研究とでは、類似した研究内容であっても根拠が全く異なるということを理解する必要があります。
研究倫理と個人情報保護法
2017年5月、個人情報保護法が改正されました。
この改正では、要配慮個人情報のなかに病歴も含められることになり、原則として第三者に提供するには本人の同意を得ることが義務化されました。
医療・介護関係事業者が取り扱う「要配慮個人情報」の具体的な内容
患者の身体状況、病状、治療等について、医療従事者が知り得た診療情報や調剤情報、健康診断の結果及び保健指導の内容、障害(身体障害、知的障害、精神障害等)の事実、犯罪により害を被った事実
また改正後においては、氏名やカルテIDが削除(「匿名化」)されていても、患者情報が医療機関から外部の関係者に提供される際には要配慮個人情報の第三者提供に該当すること、また、病歴等については希少疾患や特異的な記述が含まれると要配慮個人情報に該当する場合があること、についても明確化されています。
PMSと研究との区別
患者情報の利用は、研究のためであっても目的外利用にあたり、医学系倫理指針に沿う必要があります。
しかしPMSは、企業に薬の安全性を確保するための情報収集を義務づけたもので、患者情報を得ることに本人の同意は免除され、倫理審査委員会も介入しません。
したがって、薬機法に基づくPMSなのか、倫理指針に沿った研究なのか、しっかりと区別しなければなりません。
MRの皆さんが普段関わっている情報は、患者本人の同意なしには取得も第三者提供も行ってはいけない情報であり、PMS活動では公共の利益のために極めて例外的に患者情報を使わせてもらっているということを、強く意識する必要があります。
(取材協力:国立がん研究センター 研究支援センター 生命倫理部長 田代志門先生)
参考資料
- 田代志門,2011,『研究倫理とは何か 臨床医学研究と生命倫理』,勁草書房.
- 神里彩子、武藤香織編,2015,『医学・生命科学の研究倫理ハンドブック』,東京大学出版会.
- 田代志門,2016,「臨床研究の倫理と規制」水谷修紀監修『よくわかる臨床研究~小児がん~』,36-46.
- 田代志門,2017,「医学研究の現場からみた個人情報保護法改正―「適切な同意」とは」『NBL』No.1103:34-41.
- 厚生労働省,2017,厚生科学審議会・臨床研究部会(第1~4回),審議資料
- 文部科学省・厚生労働省,2014,「人を対象とする医学系研究に関する倫理指針」