- 編集部からのコメント
-
この記事は『Medical Education for MR 2017夏号』に掲載されたものを再掲したものです。
新記載要領に基づく添付文書への変更は2019年4月から始まり、各MRの担当製品の添付文書も新記載要領のものへと順次置き換えが進んでいることでしょう。置き換えは2024年3月31日までに完了する必要があります。添付文書が変わった際にMRがきちんと関係各所へ通知できているか、中間地点でいちど見直してみてはいかがでしょうか。
2021年8月からは電子化がスタートするなど、添付文書を巡る制度変更の動向は、MRとして必ず押さえておくべきトピックです。
20年ぶりの全面改正、その背景を振り返る
前回の全面改正の背景
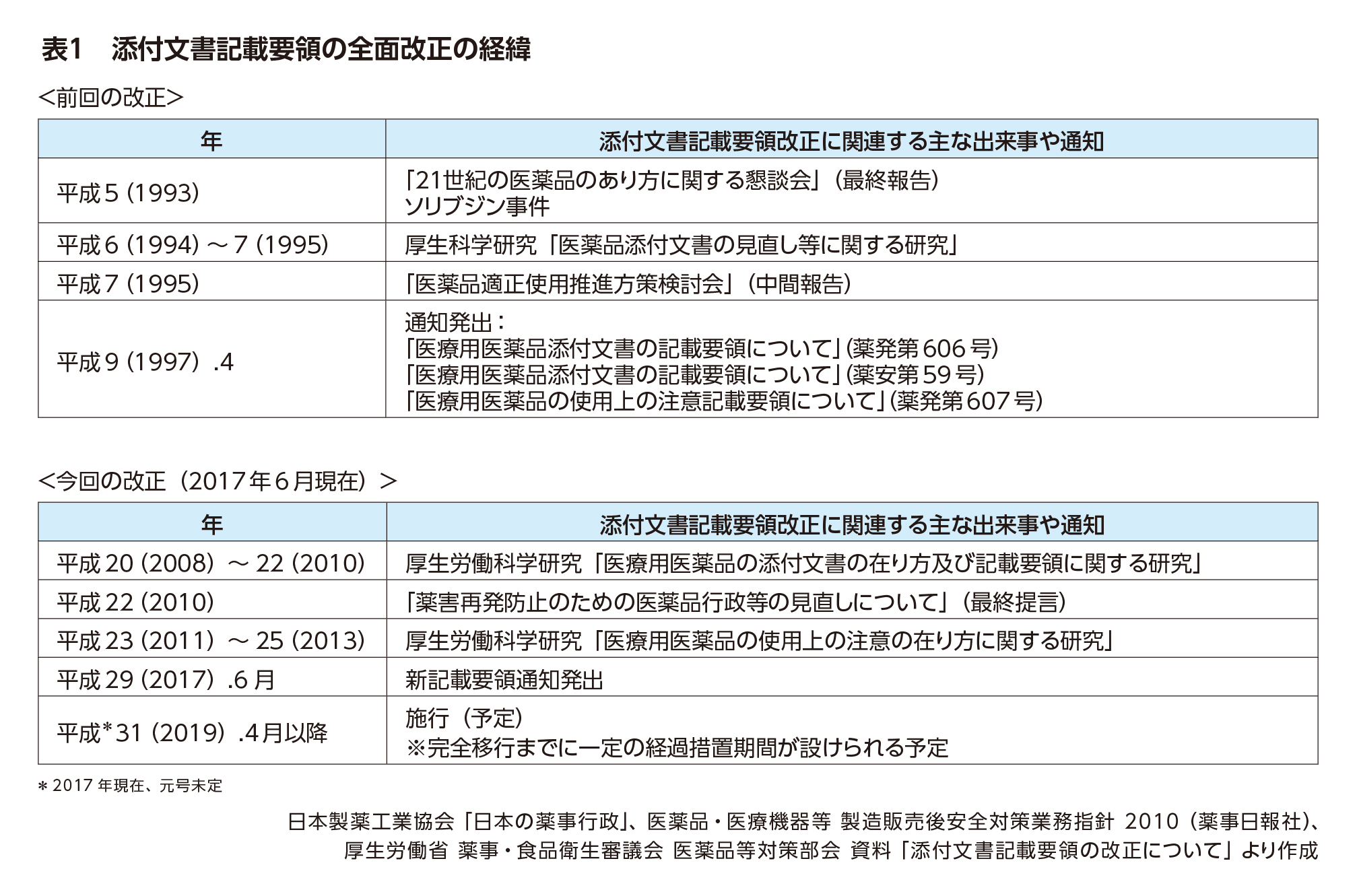
2019年4月、添付文書の記載要領が全面的に改正されます。添付文書はこれまでにも何度も改訂が重ねられてきましたが、大きく見直されるのは約20年ぶりです。
前回の全面改正のきっかけは、1993年に「21世紀の医薬品のあり方に関する懇談会」の最終報告書で、添付文書の見直しの必要性が提言されたことでした(表1)。
そのわずか数ヵ月後にソリブジン事件が起こり、安全性に関する情報提供のあり方が問われました。その後も添付文書見直しの検討が続けられ、記載要領の改正に関する通知が出されたのは1997年。ちょうどMR認定制度が始まった年でした。
このときの主な改正点は、ヒトでの科学的データを充実させたことと、医療現場で利用頻度が高い項目を前に配置するなど、より理解しやすく、活用しやすいものにしたことでした。
医療を取り巻く環境の変化や医療現場からの声
前回の改正以降、日本は高齢社会から超高齢社会に突入し、医療の進歩やIT技術の進展など、医療を取り巻く環境は目まぐるしく変化しています。
このような社会背景を考慮し、2010年に出された「薬害再発防止のための医薬品行政等の見直しについて(最終提言)」では、添付文書に最新の知見を反映することに加え、記載要領の見直しや改訂内容の迅速な周知などが提言されました(表1)。
ほぼ同じ時期に実施された添付文書に関する大規模アンケート調査(以下、「医師・薬剤師大規模アンケート」)では、医師や薬剤師の多くが現行の添付文書の位置づけを重要と考えている一方で、記載方法や記載内容などについて多くの問題点があることが指摘されました。さらに、添付文書のモデル案を用いた検証アンケート調査(以下、「検証アンケート」)では、記載項目など具体的な改善案が細かく検討されました。
これらの調査結果とパブリックコメントで寄せられた約1,000件の意見を踏まえ、2017年3月に添付文書記載要領改正案の概要が示され、同年6月に新記載要領の通知が発出されました。
施行は2019年4月以降の予定ですが、円滑な移行に向け、一定の経過措置期間が設けられることになっています。
具体的に何がどのように変わるのか?
現行の添付文書の問題点
先の医師・薬剤師大規模アンケートでは、現行の添付文書の課題として表2のような問題点が指摘されました。記載順序や記載方法の見直しが必要と思われる意見や、使用上の注意には臨床上必要とされる情報を具体的に記載してほしいという意見などが寄せられました。
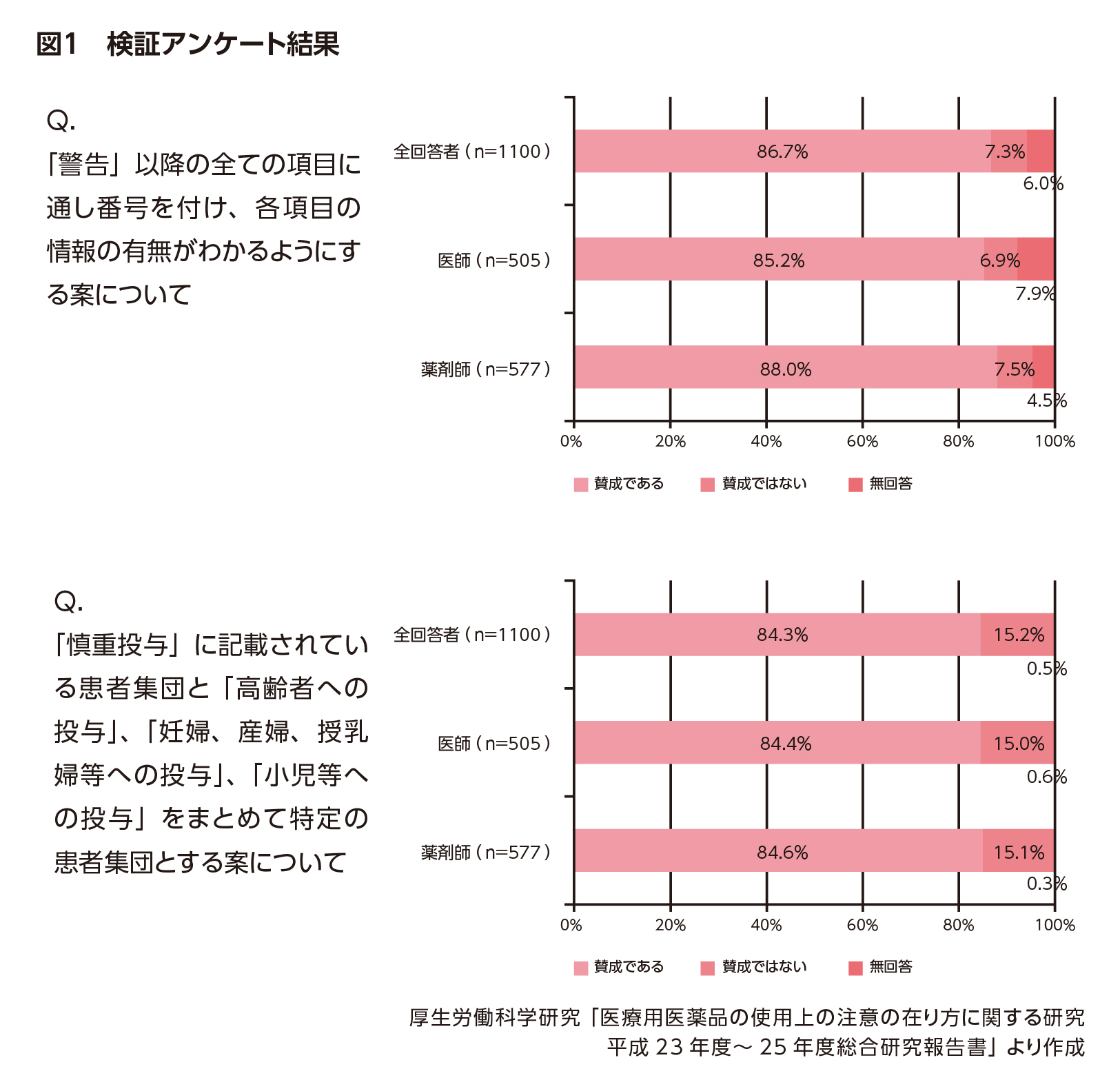
その後の検証アンケート(図1)では、記載方法の改善策として、「警告」以降の全ての項目に通し番号を付け、各項目の情報の有無がわかるようにするという案に約87%の賛同が得られました。
また、使用上の注意については、「慎重投与」に記載されている患者集団と「高齢者への投与」、「妊婦、産婦、授乳婦等への投与」、「小児等への投与」をまとめて特定の患者集団とする案に約84%の人が賛同しました。
このほか、副作用情報の記載内容が画一的にならないようにするなどの案にも多くの医療従事者の賛同が得られました。
改正の主なポイント
新添付文書では、これらの調査結果を反映して大きく次の3つの点が改正されます(図2)。
- 項目の通し番号の設定
- 「特定の背景を有する患者に関する注意」の新設と「高齢者への投与」、「妊婦、産婦、授乳婦等への投与」、「小児等への投与」の廃止
- 「原則禁忌」と「慎重投与」の廃止
Point 1:通し番号の設定について
「警告」以降の全項目に番号が付けられ、該当がない項目は欠番となります。各項目の順番は図2の通りです。
Point 2:「特定の背景を有する患者に関する注意」の新設と「高齢者への投与」、「妊婦、産婦、授乳婦等への投与」、「小児等への投与」の廃止について
「特定の背景を有する患者に関する注意」が新設され、その中に「合併症・既往歴等のある患者」、「腎機能障害患者」、「肝機能障害患者」、「妊婦」、「生殖能を有する者」、「授乳婦」、「小児等」、「高齢者」が新たな項として設置されます。
これに伴い、これまで「使用上の注意」に含まれていた「高齢者への投与」、「妊婦、産婦、授乳婦等への投与」、「小児等への投与」は廃止されます。
この変更の最大の目的は、特定の患者集団を集約することで注意喚起しやすくすることにあります。これはアメリカの添付文書と同様の考え方で、検証アンケートを行った研究班では、「より国際標準に準じた添付文書となる」と考察されています。
なお、「合併症・既往歴等のある患者」は、投与に際して特に注意を要する場合や適正使用に関する情報がある場合に記載されます。
Point 3.「原則禁忌」と「慎重投与」の廃止について
「原則禁忌」は廃止され、但し書き付きの「禁忌」または「特定の背景を有する患者に関する注意」(「合併症・既往歴等のある患者」の項など)に記載されます。
「原則禁忌」については、検証アンケートで必要と不要の意見が大きく分かれたことから、最終的に設定しないことが妥当と判断されました。
また「慎重投与」も廃止され、「特定の背景を有する患者に関する注意」など、その他の適切な項に記載されます。
このほか、臨床上必要と思われる情報の充実や記載内容の細かい整備なども行われます。
MRは医療従事者やMSなどから記載内容がどのように変わるのかを尋ねられた場合に備え、今のうちから改正のポイントを押さえておくことが必要です。
具体的には、通し番号の導入で製品ごとに情報の有無が明確になるため、自社製品についてどの情報があるのかないのかを把握し、情報が追加される項目は関連する臨床試験や製造販売後調査などの結果を見直す必要があります。
また、特定の患者集団の各項は特定使用成績調査の項目に直結しており、MRが収集した安全性情報がこれまで以上に添付文書に反映されることになります。
このように、添付文書の改正は単なる書面上の変更ではなく、MRの日常業務と深く結びついているのです。
医療現場などへの影響
医療現場での添付文書活用術
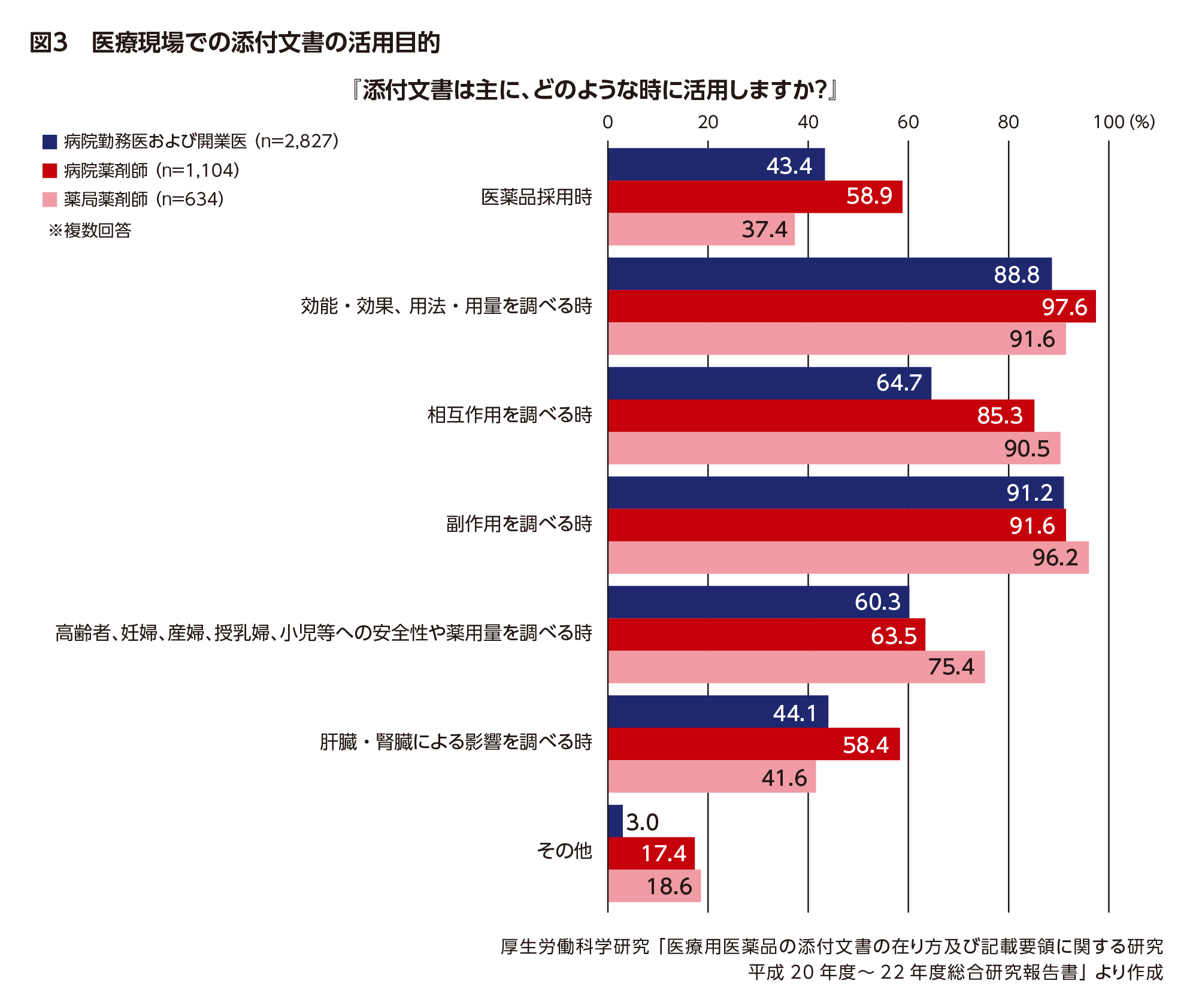
MRにとって、添付文書が医療現場でどのように活用されているのかを知っておくことも重要です。先の医師・薬剤師大規模アンケートでは、添付文書の活用状況についても調査が行われました。
その結果、8割以上の医師と大多数の薬剤師が、添付文書を「よく活用する」または「時々活用する」と回答しました。また、主にどのような時に活用するかという問いには、「副作用を調べる時」や「効能・効果、用法・用量を調べる時」という回答が約9割を占め、次いで相互作用や特定の患者集団への投与に関する情報を調べるために活用されていることがわかりました(図3)。
つまり、添付文書は医師や薬剤師などが医薬品情報を得るために活用する最も基本的で身近な資材です。今回の改正で情報がより充実し、整理されることで、医療現場での添付文書の活用頻度は今後さらに高くなっていくことが期待されます。
患者向医薬品ガイドへの影響の可能性
最新の添付文書情報を基に作られている患者向け情報媒体の一つに「患者向医薬品ガイド」があります。医療用医薬品の正しい理解や、重大な副作用の早期発見などに役立てるため、広く国民に対して提供されているものです。厚生労働省によって作成が望まれる医薬品が随時特定され、製造販売業者によって作成されたガイドはPMDA(医薬品医療機器総合機構)の一般向け情報検索ページより、入手が可能になっています。
今回の添付文書記載要領の改正では直接大きな影響はないと考えられますが、医薬品によっては一部見直しが必要となるかもしれません。
今はインターネットを通じて誰でも簡単に情報を入手できるため、自身の病気についての情報を積極的に収集する患者も珍しくはありません。
最近ではキュレーションサイト問題の影響もあって、信頼できる医療情報が求められており、PMDAのwebサイトはその情報源の一つとも考えられます。
MRは直接患者に情報提供を行うことはありませんが、患者の利益のために医療従事者を介して適正な医薬品情報を提供していく役割を担っていることを心に留めておく必要があります。
試されるMRの力
MRに求められる情報伝達能力
厚生労働省では以前、全国の医療機関を対象に、添付文書改訂などの適正使用情報の提供状況に関するwebアンケート調査を実施しました。
それによると、添付文書の改訂情報の入手手段として最も多いのは「製薬企業のMR」で、その割合は8割近くに上りました。一方で情報入手の際の問題点として、「製薬企業によって情報伝達能力(MR教育)に差がある」、「情報提供の方法等に問題がある」といった意見が寄せられました。
添付文書記載要領の全面改正に伴い、MRの医療機関への訪問機会が増えることが予想されます。このときに問われるのが情報伝達能力です。今回の改正では、「特定の背景を有する患者に関する注意」など使用上の注意に関する情報が細かく整備されるため、現行の添付文書に比べて注意喚起がより明確になります。MRは医療従事者からさらに詳しい情報を求められることもあるでしょう。そのときに正確な情報をわかりやすく伝えられるよう、製品情報を改めて見直し、整理しておく必要があります。
医薬品情報の基本資材を使いこなす力
今回の改正の対象は添付文書に限定されていますが、製品情報概要や医薬品インタビューフォーム(IF)などは添付文書を補完する資材であることから、これらもいずれ変更が必要になることが予想されます。
近年、医薬品のプロモーションに関する規制が厳しくなる中、MRにとってこうした製品情報の基本資材を使いこなすことは、医療現場との関係を維持していく上でも重要です。製品に関する科学的情報や臨床上必要とされる情報を、基本資材を使いながら適切に説明できる知識や技術を培っておくことがこれからのMR活動には欠かせません。
変化を大きなチャンスと捉える
前回の添付文書記載要領の全面改正から20年が経ち、添付文書は大きな転換点を迎えました。MR認定制度も誕生から20年を経て、MRのあり方も今まさに転換期に差し掛かっています。MR認定センターの調べでは、2016年3月末時点のMR総数は64,135名と、前年度に引き続き500名以上減少しています。MRにとってこの現象は望ましいことではないかもしれません。しかし、見方を変えれば、人数が減った分だけ個々のMRの力が所属企業に寄与する度合いが高まるということです。
添付文書記載要領の全面改正は、MRが直面している厳しい状況を乗り越えるためのチャンスでもあります。同じ医薬品であっても、担当地域や担当施設によって欲しい情報は異なることもあり、添付文書はそれを引き出すための一手段です。添付文書を使いこなし、画一的ではない情報提供ができるようになれば、その強みはこれからのMR活動の大きな武器となるに違いありません。
(文:メディカル・コミュニケーター 清川愛弓)
参考資料
- 日本製薬工業協会. 国際委員会 薬事情報タスクフォース「日本の薬事行政」(2017年)
- 医薬品・医療機器等 製造販売後安全対策業務指針 2010(薬事日報社 2010年4月2日)
- 薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会「薬害再発防止のための医薬品行政等の見直しについて」(最終提言)(2010年4月28日)厚生労働科学研究費補助金 医薬品・医療機器等レギュラトリーサイエンス総合研究事業「医療用医薬品の添付文書の在り方及び記載要領に関する研究 平成20年度~22年度 総合研究報告書」(2011年3月)
- 厚生労働科学研究費補助金 医薬品・医療機器等レギュラトリーサイエンス総合研究事業「医療用医薬品の使用上の注意の在り方に関する研究 平成23年度~25年度 総合研究報告書」(2014年3月)
- 厚生労働省 薬事・食品衛生審議会 医薬品等対策部会 資料4-1 厚生労働省医薬・生活衛生局安全対策課「添付文書記載要領の改正について」(2017年3月17日)
- 厚生労働省 平成21年度 医薬品の添付文書改訂等の適正使用情報入手状況等調査「適正使用情報提供状況確認等事業 最終報告書」(三菱総合研究所 2010年5月)
- 公益財団法人MR認定センター「2016年版 MR白書」(2016年8月)
- 薬生安発0608第1号 厚生労働省 医薬・生活衛生局安全対策課長通知 「医療用医薬品の添付文書等の記載要領の留意事項について」(2017年6月8日)