- 編集部からのコメント
-
この記事は『Medical Education for MR 2018春号』に掲載されたものを再掲したものです。
この教材は法制度の具体内容も取りあげていますが、それが趣旨ではなく、再生医療を倫理的な視点で見つめることをメインの目的としています。
現行の再生医療等安全性確保法や施行規則、最新の再生医療等の提供状況や承認状況などをお調べになりたい場合に参考になる情報を下記に挙げておきます。
再生医療に関する情報が全般的にまとめられた厚生労働省ウェブサイト「再生医療について」も参照いただくとよいかと思います。
【参考情報】
・再生医療等の提供状況の定期報告のまとめ
・再生医療等製品(加工細胞等)の初回治験計画届出件数の推移
・承認を受けた再生医療等製品の一覧
・再生医療等安全性確保法施行規則の改正
再生医療の実用化促進に向けた動き
再生医療への国民の期待と国による推進
iPS細胞の発見、作製の成功による国民の期待の高まり、再生医療研究者による国への働きかけを受け、再生医療の促進を目的とした「再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律」(いわゆる再生医療推進法)が2013年に議員立法で制定されました。
この法律では、国は再生医療の迅速かつ安全な研究開発、提供、普及の促進に関する基本方針を定めて公表すること、そして少なくとも3年ごとにこの基本方針を検討すること、再生医療の施策や実施に当たって安全性を確保し、生命倫理に対する配慮を行うことなどを定めています。
安全性の確保と生命倫理への配慮
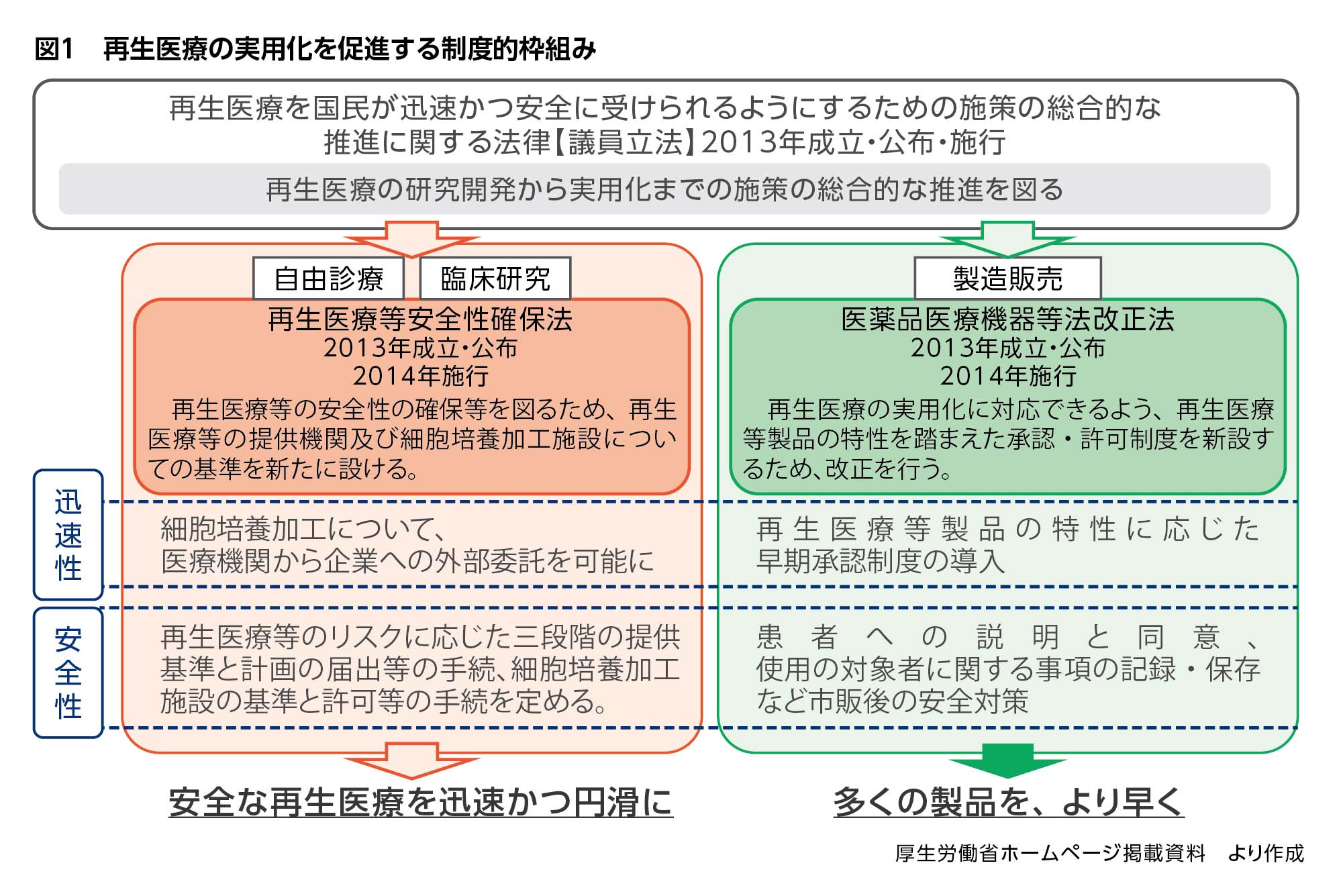
再生医療推進法を受け、国は再生医療の安全性を確保するための規定を定めた「再生医療等の安全性の確保等に関する法律」(以下、再生医療等安全性確保法)を2014年に施行しました。
そして再生医療等安全性確保法の施行と足並みを揃え、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(=旧・薬事法、以下、医薬品医療機器等法)において、医薬品や医療機器とは別に「再生医療等製品」を新たに定義し、再生医療等製品が均質でない認識のうえで、条件および期限を付して早期に製造販売承認を与える改正を行いました。
再生医療等安全性確保法は主に再生医療の実施を規律するもの、医薬品医療機器等法は再生医療の製品を規律するものという位置付けです(図1)。再生医療等安全性確保法の注目すべき点は、これまで医師の裁量に委ねられてきた自由診療にも踏み込み、自由診療の名目で医師が細胞を自由に使うことに歯止めを掛けたことです。
再生医療等安全性確保法の対象範囲
再生医療等安全性確保法がカバーする範囲は、①人の身体の構造又は機能の再建、修復又は形成、②人の疾病の治療又は予防、に用いられることが目的とされている医療技術であって、細胞加工物を用いるものとされています。
細胞加工物は、①細胞(細胞加工物の原材料となる人又は動物の細胞)、②細胞加工物(人又は動物の細胞に培養その他の加工を施したもの)、③特定細胞加工物(再生医療等に用いられる細胞加工物のうち再生医療等製品であるもの以外のもの)が想定されています。
リスク別の審査・手続き体制
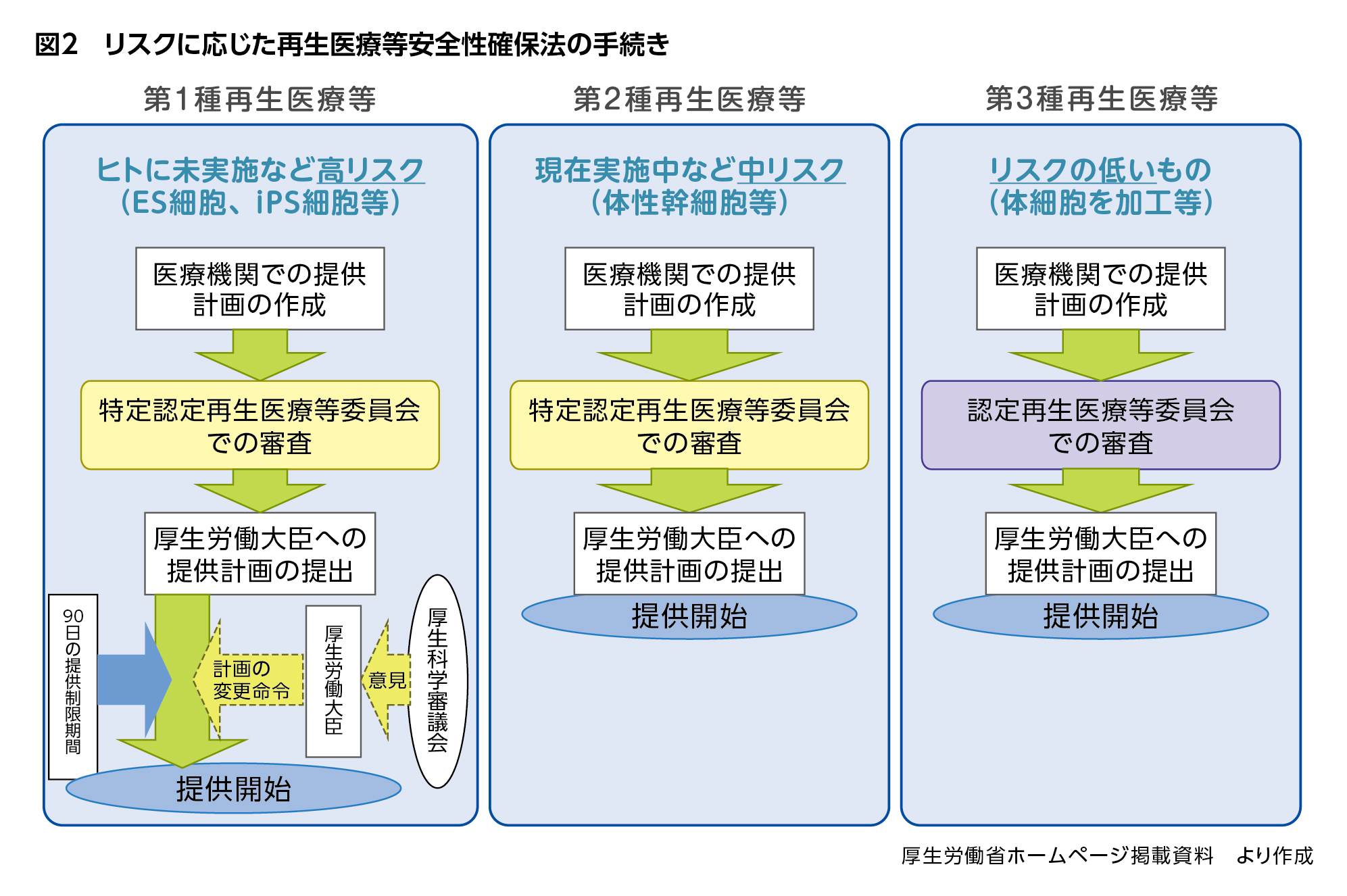
再生医療等安全性確保法では再生医療を、投与する細胞や投与部位、投与方法等によるリスク別に、人の生命及び健康に与える影響が大きい順に、第1種再生医療等、第2種再生医療等、第3種再生医療等と区分しています。
例えば、ES細胞やiPS細胞の移植のような新規性が高く効果や副作用が未知数のものについてはリスクが最も高いとして第1種に、臍帯血のように体性幹細胞を用いる研究や治療は第2種に、体細胞を用いるが再建や修復を目的としないがん免疫療法といったものは第3種に分類されます。
そしてこの分類によって、患者さんへ提供を開始するまでの流れが異なります(図2)。いずれも臨床研究や治療を始める前に、患者さんへの提供計画を厚生労働大臣へ提出する必要がありますが、その妥当性について、第3種は「認定再生医療等委員会」で、第1種と第2種はより高度な審査能力を持つ専門家や第三者性を重視した委員で構成される「特定認定再生医療等委員会」の審査を受けることが求められています。どちらの委員会にも生命倫理に関する識者を入れる必要があり、両委員会とも厚生労働大臣の認定が必要です。
再生医療のいま
再生医療を届ける2つのトラック
先述したように、再生医療等安全性確保法は、安全な再生医療を迅速かつ円滑に患者さんに届けるために再生医療の実施を規律するものですが、医薬品医療機器等法は、多くの再生医療等製品をより早く患者さんに届けるために再生医療等製品を規律するものです。
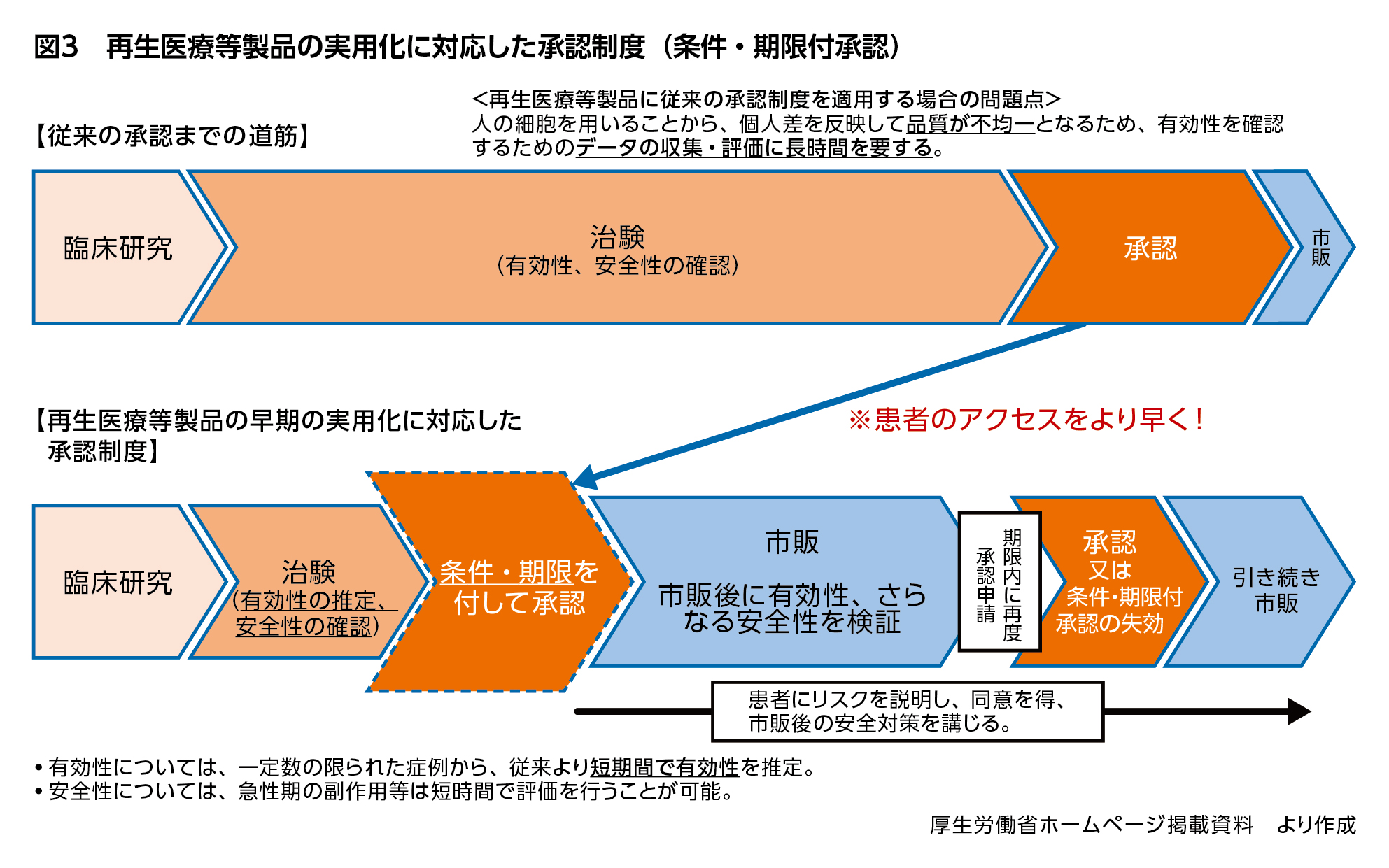
再生医療等製品に従来の承認制度を運用する場合、細胞を用いる再生医療等製品は品質が不均一となるため、有効性を確認するためのデータの収集・評価に長時間を要するという問題点がありました。そこで、2014年の医薬品医療機器等法改正により、再生医療等製品を定義付けするとともに、「条件及び期限付承認制度」を導入しました。これは、細胞に由来するため均質の製品とならない再生医療等製品の特徴を認識したうえで、有効性が推定され安全性が確認されれば、販売先を専門的な医師や設備を有する医療機関等に限定する条件や7年以内の期限付きで、特別に早期に承認できる仕組みです(図3)。この場合、承認後に有効性・安全性を改めて検証するべく使用成績調査を行うため、MRの役割が重要になってきます。
つまり、再生医療を患者さんに届ける環境として、再生医療等安全性確保法による治験を通らないトラック、医薬品医療機器等法による治験を通るトラックという、2つのトラックが整備されたということです。
再生医療の提供状況と治験届出件数
再生医療を提供する施設では、再生医療等提供計画を提出した再生医療等技術ごとに、提供の状況について厚生労働大臣に定期報告を行う義務があります(再生医療等安全性確保法第21条)。加えて、医薬品医療機器等法に則った治験も届け出が必要であるため、再生医療の実施状況は厚生労働省や医薬品医療機器総合機構(PMDA)がすべて把握し、ホームページに公開しています。
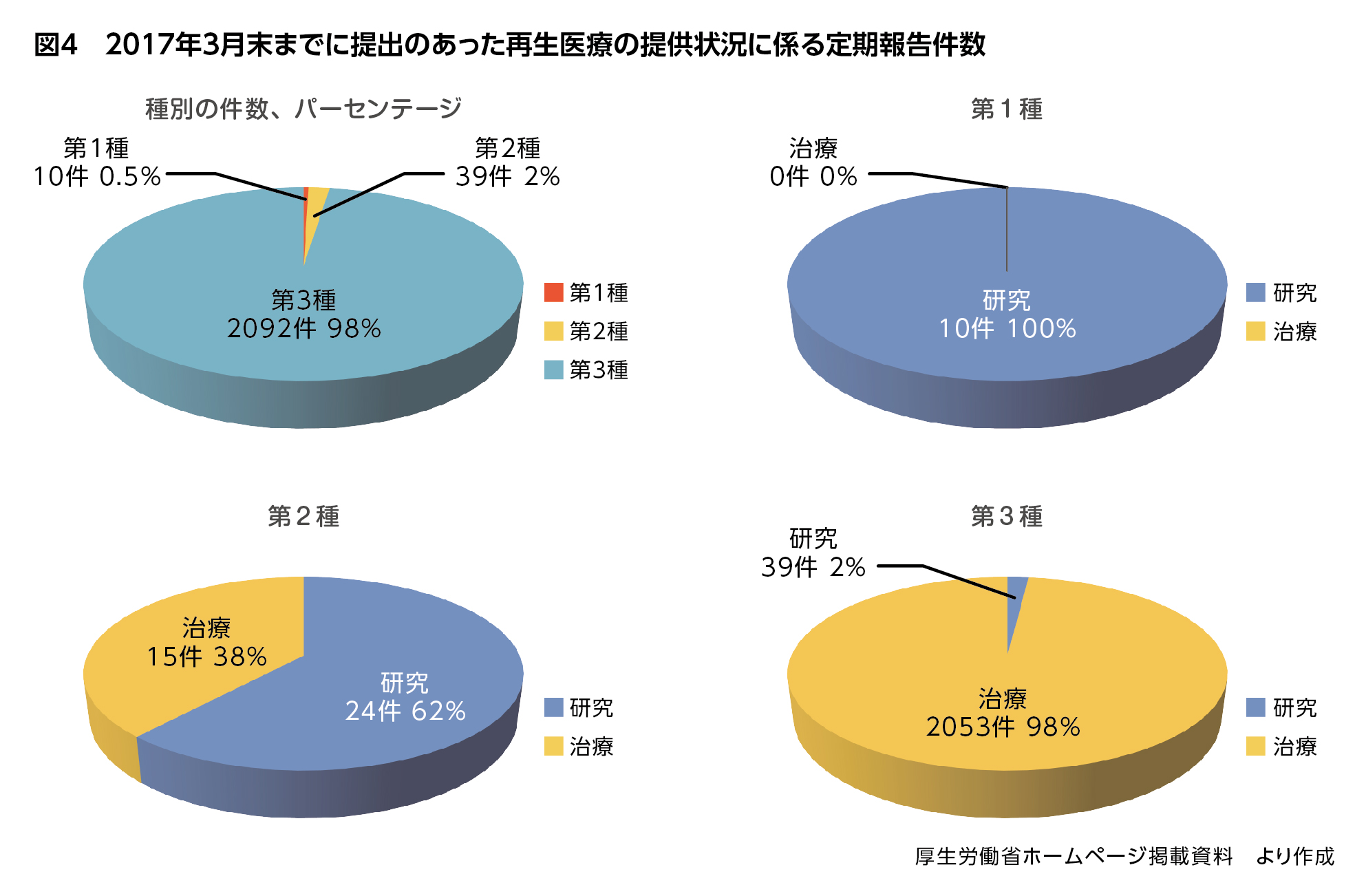
最新の定期報告のまとめによると、2017年3月末までに提出のあった定期報告総数は2,141件でした。このうち第1種は研究のみ10件、第2種は研究24件、治療15件の39件で、残りの2,092件(定期報告総数の98%)が第3種で、その98%が治療です(図4)。
一方、再生医療等製品(加工細胞等)の初回治験計画届出件数は、2016年度は16件でした。なお、承認を受けた再生医療等製品の一覧もPMDAのホームページで見ることができ、2016年度はヒト(自己)表皮由来細胞シートが承認を受けています。
無届けでの臍帯血を用いた再生医療
図4でも見られるように、再生医療の提供、特に治療は第3種がほとんどを占めています。その中には、自己血等を用いた美容目的での提供も含まれています。
とくに、臍帯血を用いる治療は再生医療等安全性確保法での制限に該当するにもかかわらず、自由診療下で無届けで行われる例が目立ち、厚生労働省は同法を周知徹底するよう、都道府県の衛生主管部などに向け通知を発出しています。
2017年5月から6月にかけて厚生労働省は、必要な手続きを行わず他人の臍帯血を用いた再生医療を提供していたとして、再生医療等安全性確保法違反により複数のクリニックに当該再生医療の提供の一時停止を命じました。悪質な施設には刑事告発の措置が執られており、2017年8月には、同法違反で初めて、治療にあたった医師らが逮捕されています。
この事件では、使用された臍帯血が破産した民間臍帯血バンクから流出したものであったことが判明し、ショッキングなニュースとして大きく報じられました。これは倫理的に非常に由々しき問題です。
こうした事件の影響で再生医療そのものに対する不信が広がったこともあり、厚生労働省は、再生医療を提供する施設名や提供する再生医療等の内容、その説明文書や同意文書の様式、再生医療等提供計画書に記載された認定再生医療委員会の名称に至るまですべてホームページ上に公開しました。
自身が担当する施設が再生医療の臨床研究や治療を行っているかチェックしてみるのもいいでしょう。
再生医療に関する倫理的・社会的問題
再生医療を巡る倫理的・社会的問題について、東京大学医科学研究所 武藤香織先生にお話を伺いました。
武藤先生は、まだルールがなく大至急考えなければならない新しい倫理の問題が大きく2つあると言います。ひとつは、細胞提供者の将来的な権利の在り方。もうひとつは、再生医療、特にiPS細胞研究に対する国民やメディアの受け止め方です。これについて詳しく解説していきます。
説明同意文書に書ける限界
再生医療等安全性確保法は「生命倫理への配慮に関する措置」も目的にしています。
再生医療を受ける患者さんへの説明と同意を得ることはもちろん、再生医療に用いる細胞提供者のインフォームド・コンセントについても規定されています。
施行規則によると、細胞を提供する時点で明らかとなっている情報についてできる限り具体的に説明することとされています。しかし、特に第1種再生医療技術や第2種再生医療技術で用いられるようなiPS細胞や臍帯血などの細胞は、バイオバンクから研究機関や企業に分配され、分化誘導されてさまざまな研究に使われるため、その細胞の行く末は研究者も正確には予想できず、最初の説明同意文書に書けることには限界があります。
細胞提供者は提供の段階で、今後の細胞の展開を知ることなく、同意することになります。研究や治療に対して包括同意をしていたとしても、自分の提供した細胞が誰の手に渡り、どのように展開していったかを知りたいと考えたときにその権利はどうなるかは議論されていません。
説明同意文書の記載事項の追加検討
臨床研究法が今年4月に施行されることに伴い整合性を図るため、再生医療等安全性確保法施行規則の改正が検討されています。
細胞提供者への説明同意文書には、「細胞提供者から取得された試料・情報について、当該細胞提供者又はその代諾者から同意を受ける時点では特定されない将来の研究のために用いられる可能性又は他の実施医療機関に提供する可能性がある場合には、その旨と同意を受ける時点において想定される内容」を追加することが検討されています。
細胞提供者の知的財産権はどう考える?
知的財産権は細胞の転換時にそれぞれ研究者たちの努力で生まれるもので、提供者本人の努力ではないため、通常、知的財産権は提供者に帰属しないと同意文書に書かれています。提供者はそれを納得のうえで同意していることになっていますが、本当にこのままでよいのか、例えば、提供した細胞がもし莫大な利益を上げる製品になった場合でも権利を主張できないのか、ベネフィット・シェアリングをどう考えるかといった点も議論が必要です。
アメリカでは、知的財産権を獲得した人と、その疾患の患者団体で共有する例もあります。
細胞から「患者さん」を感じる
製薬企業は薬の開発にバンクから分配される細胞株を使います。MRの皆さんは企業の研究・開発に直接携わるわけではありませんが、細胞が提供された当初はどんな同意書だったのか、どんな方から提供されたのか、どのような想いで提供されたのか、提供者の意に反した使用となっていないだろうかと想像してみてください。
医師から自社の薬剤を投与した患者さんの経過を聞いたり、自身が担当する施設で臨床試験が行われている場合など、MRは患者さんを感じられる瞬間が日常的にあることでしょう。患者さんの側に立って考えるということが身についている職種であるとは思いますが、それが「細胞」になったときに、「患者さん」から意識がどんどん離れていってしまうかもしれません。
ただの「細胞」ではなく、畏怖の気持ちや、提供者の想いに応える研究・開発になるかを考えることは、製薬企業の使命です。実際に再生医療製品の情報提供・収集を行っているMRはまだほとんどいないでしょう。しかし、将来的に再生医療等製品は確実に増えていきます。自分が関わる再生医療製品の向こう側に、細胞を提供した人、その製品による治療を待っている患者さんがいることを意識することが大切です。
iPS細胞に関する過剰報道
次に、iPS細胞に対する国民やメディアの受け止め方について考えます。
山中伸弥教授らが世界で初めてiPS細胞の発見・作製に成功し2012年にノーベル生理学賞・医学賞を受賞したこともあり、再生医療、特にiPS細胞に対する日本国民の期待と関心は高い状態にあります。
2014年に実施された自己iPS細胞を用いた一例目の臨床試験では、「国民が知りたいことだから」と報道関係者から手術日等の問い合わせが相次ぎ、その対応として、手術実施日に研究代表者らによる記者会見が行われました。
通常の臨床試験では、手術日や患者さんの年齢等の情報は一切公開されません。それは適切なデータを得るためであり、データを歪めるものを排除するためでもあります。しかしiPS細胞の臨床試験は通常の臨床試験のルールと全く異なるメディアへの暴露のしかたをしているため、患者さんのプライバシーの侵害に加え、研究倫理的にも非常に問題があります。
日本ではiPS細胞の臨床試験の報道が過熱しすぎる傾向にあり、これは日本特有の現象のようです。
臨床試験は確立された治療ではない
臨床試験に参加する人が、「これは自分のための治療なんだ」と勘違いしてしまう事態を「治療と研究の誤解(セラピューティック・ミスコンセプション)」といいます。
研究と治療は全く異なるものです。研究は患者さんに未知のリスクを負わせることであり、だからこそ患者さんが誤解して期待するようなことがないよう、インフォームド・コンセントでしっかりと理解してもらう必要があります。
しかし、iPS細胞の臨床試験に見られた過剰報道によって、社会全体が「これは確立された治療なんだ」と勘違いをしてしまう事態にも陥りかねません。報道を見た家族や友人が勘違いすると、患者さんにも悪影響を与えます。「夢の治療だ」という煌びやかなイメージのある再生医療分野で特に注意しなくてはならないことです。
iPS細胞をはじめとする再生医療を待つ患者さんに安全な治療を迅速に届けるためにも、国民全体で報道の在り方を考える必要があるでしょう。
(取材協力:東京大学 医科学研究所 公共政策研究分野 教授 武藤香織先生)
参考資料
- 再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律
- 再生医療等の安全性の確保等に関する法律
- 再生医療等の安全性の確保等に関する法律施行規則
- 医政研発1031第1号 厚生労働省医政局研究開発振興課長通知(2014年10月31日)
- 第25回厚生科学審議会再生医療等評価部会資料(2018年1月24日)
- 厚生労働省・PMDAホームページ掲載資料(2018年2月アクセス)
- 武藤香織・八代嘉美「手術日の即日報道は必要か?ヒトiPS細胞臨床試験と報道」(朝日新聞社『Journalism』no.326 2017,7)
- 一家綱邦「再生医療安全性確保法に関する考察」(甲斐克則編『再生医療と医事法【医事法講座8】』,2017,信山社)